Bróm
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Általános | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Név, vegyjel, rendszám | bróm, Br, 35 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Latin megnevezés | bromium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemi sorozat | halogének | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Csoport, periódus, mező | 17, 4, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Megjelenés | gáz/folyadék: vörösbarna szilárd: fémesen csillog 
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomtömeg | 79,901–79,907 g/mol[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronszerkezet | [Ar] 3d10 4s² 4p5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronok héjanként | 2, 8, 18, 7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fizikai tulajdonságok | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Halmazállapot | folyékony | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sűrűség (szobahőm.) | (folyadék) 3,1028 g/cm³ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Olvadáspont | 265,8 K (-7,3 °C, 19 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Forráspont | 332,0 K (58,8 °C, 137,8 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Olvadáshő | (Br2) 10,571 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Párolgáshő | (Br2) 29,96 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Moláris hőkapacitás | (25 °C) (Br2) 75,69 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomi tulajdonságok | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristályszerkezet | rombos | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidációs szám | ±1, 5 (erősen savas oxid) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativitás | 2,96 (Pauling-skála) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionizációs energia | 1.: 1139,9 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2.: 2103 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3.: 3470 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomsugár | 120 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomsugár (számított) | 94 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalens sugár | 114 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals-sugár | 185 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Egyebek | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mágnesség | diamágneses[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fajlagos ellenállás | (20 °C) 7,8·1010 Ω·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hőmérséklet-vezetési tényező | (300 K) 0,122 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hangsebesség | (20 °C) 206 m/s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-szám | 7726-95-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fontosabb izotópok | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hivatkozások | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
A bróm (nyelvújításkori magyar nevén: büzeny) a periódusos rendszer VII. csoportjába, a halogének közé tartozó kémiai elem. Vegyjele Br, rendszáma 35. Standard hőmérsékleten és nyomáson vöröses-barna színű, könnyen párolgó, maró, mérgező folyadék. Tulajdonságai átmenetet képeznek a klór és a jód tulajdonságai között. A brómot egymástól függetlenül két kémikus is izolálta: Carl Jacob Löwig 1825-ben és Antoine Jérôme Balard 1826-ban, nevét az ógörög βρῶμος (bromosz = bűz) szóból kapta, ami az erős kellemetlen szagára utal.
Az elemi bróm igen reaktív, és ezért elemi formában nem is fordul elő a természetben, csak vegyületeiben. A földkéregben lényegesen kisebb gyakorisággal fordul elő, mint a fluor, vagy a klór, de a bromidion (Br−) nagy oldhatósága miatt felhalmozódott az óceánok és tengerek vizében, ahol mennyisége körülbelül háromszázad része a klórénak. A brómot ipari mennyiségben a bromidion oxidációjával állítják elő, amihez az alapanyagot a különböző sós vizek és sótartalmú iszapok szolgáltatják, melyekből legnagyobb mennyiségben az Egyesült Államokban, Izraelben és Kínában termelik.
Magasabb hőmérsékleteken a szerves brómvegyületekből szabad brómatomok szabadulnak fel, ami megszakítja a szabad gyökös láncreakciót. Ez a hatás a szerves brómvegyületeket hatékony égésgátló anyaggá teszi, és a világszerte előállított bróm több mint felét erre a célra használják fel. Ugyanezen tulajdonságuk miatt az illékony brómorganikus vegyületekből a napfény hatására is keletkezhetnek szabad brómatomok a légkörben, ezzel károsítva az ózonréteget. Ennek következtében számos brómtartalmú szerves vegyületet, például a kártevőirtó metil-bromidot ma már nem használnak. A brómvegyületeket mind a mai napig használják még fúróemulzióként, fényképezésben és szerves vegyületek előállításában. A brómnak nincs bizonyítható biológiai szerepe az emberben. A bromidionoknak gátló hatása van a központi idegrendszerre, ezért régen nyugtatóként használták, amíg rövidebb hatású gyógyszerek fel nem váltották.
Története[szerkesztés]

A brómot egymástól függetlenül két kémikus is felfedezte, Carl Jacob Löwig[3] 1825-ben és Antoine Balard,[4][5] 1826-ban.[6]
Löwing a brómot szülővárosának, Bad Kreuznachnak egy ásványvízforrásának vizéből vonta ki 1825-ben. A sóoldatot klórral telítette, majd abból dietil-éterrel nyerte ki a brómot. Az éter elpárolgása után tiszta, folyékony bróm maradt vissza. Az eredményei publikálásával azonban késlekedett, így Balard előbb tette közzé az eredményeit.[7]
Balard a Montpellier-i sós mocsarak vizéből, a nátrium-klorid és -szulfát kikristályosítása után visszamaradt anyalúgból izolálta 1826-ban. A folyadék nagy mennyiségben tartalmazott magnézium-bromidot, és Balard észrevette, hogy ez klóros víz hozzáadására sötétsárga színű lesz. Éteres, majd kálium-hidroxidos extrahálás után a kapott kálium-bromidot kénsav és mangán-dioxid elegyével reagáltatta, így sikerült előállítania magát az elemet.[8] A bróm a klórhoz és jódhoz nagyon sok tulajdonságában hasonlított, ezért először megpróbálta bizonyítani, hogy az jód-monoklorid, de miután ez nem sikerült meggyőződött arról, hogy új elemet fedezett fel, aminek a muride nevet javasolta.[5] Ezt a Francia Akadémia nem fogadta el, helyette az elemet brómnak nevezték el átható szaga miatt a görög βρωμος (bromosz = büdös) szó után. A brómot korábban már Justus von Liebig is előállította, de ő is tévesen a jód és klór vegyületének tartotta.
1909-ben Paul Friedländer kimutatta, hogy az ókorban a bíborcsigából (Murex brandaris) nyert és festékanyagként használt bíbor nem más, mint 6,6’-dibróm-indigó. Az első brómtartalmú ásványt, a brómargiritet (AgBr) 1841-ben fedezték fel Mexikóban, de az ipari termelése csak azt követően indult meg, hogy 1858-ban felfedezték a hatalmas strassfurti hamuzsírtelepeket.[8] Kisebb gyógyászati felhasználásoktól eltekintve, a brómot először a fényképezésben használták. 1840-ben felfedezték, hogy a bróm előnyösebb a korábban használt jódgőznél a fényérzékeny ezüst-halogenid réteg kialakításában a dagerrotípiában.[9] A kálium-bromidot és a nátrium-bromidot egykor nyugtatóként és görcsoldóként alkalmazták az epilepszia kezelésében, amíg a klorál-hidrátok és a barbiturátok fel nem váltották.[10] Az első világháború során néhány brómvegyületet, mint például a xilil-bromidot vegyi fegyverként használtak.[11]
Tulajdonságok[szerkesztés]

A bróm egy nemfémes elem a periódusos rendszer VII. főcsoportjában, a halogének közül a harmadik. Tulajdonságai ennél fogva hasonlítanak a halogének tulajdonságaira és átmenetet képeznek a periódusos rendszerben fölötte elhelyezkedő klór és az alatta elhelyezkedő jód tulajdonságai között. A bróm elektronszerkezete [Ar]3d104s24p5 hét vegyértékelektronnal a negyedik, legkülső héján. A többi halogénhez hasonlóan egy elektronja hiányzik a nemesgázszerkezet eléréséhez, emiatt erős oxidálószerként viselkedik és számos elemmel reagál, hogy egy elektron felvételével kialakítsa az elektronoktettet.[12] A periodikus trendeknek megfelelően elektronegativitása a klór és jód közé esik (F: 3,98, Cl: 3,16, Br: 2,96, I: 2,66), és reaktivitása is a két elem közt van. A bróm a klórnál gyengébb oxidálószer, de a jódnál erősebb. Megfordítva, a bromidion gyengébb redukálószer, mint a jodidion, de erősebb, mint a kloridion.[12] E hasonlóságok miatt a klórt, a brómot és a jódot Johann Wolfgang Döbereiner egy triádba sorolta, felismerve az elemekre jellemző periodicitást.[13][14] A bróm atomsugara a klór és a jód atomsugara közti érték, és emiatt számos atomi tulajdonsága, mint például az ionizációs energiája, az elektronaffinitása, a disszociációs energiája, a Br2-molekula kötéshossza, és az ionsugara is átmenetet képez a klór és a jód tulajdonságai között.[12]
A halogének molekulái között gyenge van der Waals-erők hatnak, melyek erőssége az atomok méretével nő. Így a bróm olvadáspontja (−7,25 °C) és forráspontja (59,5 °C) a klór és a jód olvadás- és forráspontja közé esik. A bróm standard hőmérsékleten és nyomáson vörösesbarna színű folyadék, a nemfémek közül az egyetlen folyékony elem. A csoportban lefelé haladva a halogének növekvő atomtömegei miatt azok sűrűsége, párolgás- és olvadáshője is növekszik, így a brómnál ezek a mennyiségek ismét a klór és a jód közötti értéket vesznek fel. A csoportban lefelé haladva a halogének színe is mélyül, így a fluor halvány sárga, a klór sárgászöld, a bróm pedig sötétvörös színű. Ennek az eltérésnek az oka, hogy a nehezebb halogének a látható hullámhosszokon több fényt nyelnek el.[12] Konkrétan egy halogén színét a legnagyobb energiájú betöltött lazító πg molekulapálya és a legkisebb energiájú betöltetlen σu molekulapálya közti elektronátmenet határozza meg.[15] A hőmérséklet csökkenésével a bróm színe halványodik, −195 °C-on a szilárd bróm színe halványsárga.[12]

A szilárd klórhoz és jódhoz hasonlóan a szilárd bróm is ortorombos rétegrácsban kristályosodik, amelyben a Br2-molekulák egymással párhuzamosan helyezkednek el. A Br−Br távolság a molekulán belül 227 pm, ami közel azonos a gázfázisban lévő 228 pm-es kötéshosszal; a Br···Br távolság a molekulák közt rétegen belül 331 pm, a rétegek között pedig 399 pm (összehasonlításként a bróm van der Waals-rádiusza 228 pm). Ebből a szerkezetből adódóan a bróm igen csekély vezetőképességgel rendelkezik, vezetőképességi értéke mindössze 5·10−13 Ω−1 cm−1 közvetlenül az olvadáspontja alatt, noha ez még mindig nagyobb a klór nem mérhető vezetőképességénél.[12]
Hozzávetőlegesen 55 GPa (kb. 540 000 atmoszféra) nyomáson a bróm fémes sajátságúvá alakul át. 75 GPa nyomáson lapcentrált ortorombos szerkezetet vesz fel, 100 GPa-on pedig tércentrált monoatomos ortorombos szerkezetűvé alakul.[16]
Izotópok[szerkesztés]
A brómnak két stabil izotópja van, a 79Br és a 81Br. Egyedül ezek találhatók meg a természetben, a 79Br az összes bróm 51%-át, a 81Br pedig a maradék 49%-át teszi ki. Mindketten 3/2-es magspinnel bírnak, ezért NMR-spektroszkópiában használhatóak, azonban mivel a magspin nagyobb 1/2-nél a magtöltés eloszlása nem gömbszimmetrikus, és ez magkvadrupól-momentumot és a kvadrupólrelaxációnak köszönhetően rezonanciaszélesedést eredményez, korlátozva a módszer hatékonyságát.[12] A többi brómizotóp felezési ideje túl kicsi ahhoz, hogy előforduljanak a természetben. Ezek közül a legfontosabb a 80Br (t1/2 = 17,7 perc), a 80mBr (t1/2 = 4,421 h), és a 82Br (t1/2 = 35,28 h), melyek előállíthatók a természetes bróm neutronaktivációjával.[12] A legstabilabb radioaktív brómizotóp a 77Br (t1/2 = 57,04 h). A 79Br-nál könnyebb izotópok zömmel elektronbefogással szelénizotópokká, a 81Br-nál nehezebb izotópok pedig béta-bomlással kriptonizotópokká bomlanak. A 80Br mindkét módon bomolhat stabil 80Se-re, vagy 80Kr-ra.[17]
Kémiai tulajdonságok és vegyületek[szerkesztés]
| X | XX | HX | BX3 | AlX3 | CX4 |
|---|---|---|---|---|---|
| F | 159 | 574 | 645 | 582 | 456 |
| Cl | 243 | 428 | 444 | 427 | 327 |
| Br | 193 | 363 | 368 | 360 | 272 |
| I | 151 | 294 | 272 | 285 | 239 |
A bróm reaktivitását tekintve a klór és a jód között helyezkedik el és a legreaktívabb elemek közé tartozik. A bróm oxidációs száma vegyületeiben −1 és +7 közt változhat, de leggyakrabban −1-es oxidációs számmal, bromidok formájában fordul elő. A brómmolekulában a kötési energia kisebb, mint a klórban, de nagyobb, mint a jódban és a más elemekkel létesített kötései erősségei is a két elem közt helyezkednek el. A bróm gyengébb oxidálószer, mint a klór, de a jódnál erősebb, ez a X2/X− párok standard elektródpotenciál értékeiből is látható (F: +2,866 V; Cl: +1,395 V; Br: +1,087 V; I: +0,615 V; At: kb. +0,3 V). A brómozás gyakran magasabb oxidációs állapotot eredményez, mint a jódozás, de a klórozásnál alacsonyabbat, vagy megegyezőt. A bróm hajlamos a M−M, M−H, vagy M−C kötéseket tartalmazó vegyületekkel reagálni M−Br kötés képződése közben.[15]
Hidrogén-bromid[szerkesztés]
A legegyszerűbb brómvegyület a hidrogén-bromid (HBr). A hidrogén-bromidot főként szervetlen bromidok és alkil-bromidok előállítására, valamint szerves kémiai reakciók katalizálására használják. Az iparban elsősorban hidrogén- és brómgáz 200–400 °C-on való reakciójával állítják elő platina katalizátor jelenlétében. Laboratóriumban azonban praktikusabb előállítási mód a bróm vörösfoszforral és vízzel való redukciója:[18]
- 2 P + 6 H2O + 3 Br2 → 6 HBr + 2 H3PO3
- H3PO3 + H2O + Br2 → 2 HBr + H3PO4
A hidrogén-bromid standard hőmérsékleten és nyomáson színtelen, szúrós szagú gáz, úgy mint a többi hidrogén-halogenid a hidrogén-fluorid kivételével, mert a molekulái között nem alakulnak ki hidrogénkötések. Alacsony hőmérsékleten viszont a szilárd hidrogén-bromid kristályokban a molekulák gyenge hidrogénkötések kialakításával cikk-cakk láncokat alkotnak, amelyek hasonlóak a szilárd hidrogén-fluoridban létrejövő szerkezethez. A hőmérséklet emelésével azonban a rendezetlenség jelentősen nő.[18] A hidrogén-bromid vizes oldata erős sav (pKa = −9), mivel a vizes oldatban kialakuló gyenge O−H···Br hidrogénkötések túl gyengék ahhoz, hogy megakadályozzák a teljes ionos disszociációt. A HBr nem elegyedik korlátlanul a vízzel, nagy koncentrációjú oldata nem állítható elő és számos hidratált részecske jelenik meg az oldatban (HBr·nH2O ahol n = 1, 2, 3, 4, vagy 6), melyeket hidratált oxóniumionokként jellemezhetünk. A hidrogén-bromid a vízzel állandó forráspontú (124,3 °C) azeotrópos elegyet alkot 47,63 tömegszázalékos oldat esetén, ezért desztillációval nem lehet ennél töményebb oldatot előállítani.[19]
A hidrogén-fluoriddal szemben a vízmentes, cseppfolyós hidrogén-bromid kevésbé használható oldószerként, ami a fizikai tulajdonságai közül különösen az alacsony olvadáspontból, a folyadék halmazállapot kis hőmérséklet-tartományából, a kis dielektromos állandóból és az elhanyagolható mértékű H2Br+ és HBr−2 ionokra való öndisszociációból következik. Ez utóbbi oka, hogy a HBr−2-ion sokkal kevésbé stabil, mint a bifluoridion (HF−2), a hidrogén és brómatomok közt kialakuló nagyon gyenge hidrogénkötések miatt, bár nagy méretű és gyengén polarizáló kationokkal, például céziumionnal, vagy kvaterner ammónium kationnal előállíthatók sói. A vízmentes hidrogén-bromid gyenge oldószer, mindössze kisebb molekulavegyületeket (pl.: nitrozil-klorid, fenol) vagy kis rácsenergiájú sókat (pl. tetraalkil-ammónium-halogenidek) képes feloldani.[19]
Más egyszerű bromidok[szerkesztés]

A periódusos rendszer majdnem minden eleme alkot bromidokat. Kivételt képeznek a nemesgázok a xenont leszámítva (XeCl2, XeCl4), melyek közömbösségük miatt nem vihetők reakcióba; a nukleárisan instabil nehezebb elemek, melyek elbomlanak mielőtt kémiai vizsgálatnak tehetnék ki őket, illetve a fluor, az oxigén és a klór, melyek ugyan alkotnak vegyületeket a klórral, de ezek a fluor és oxigén nagyobb elektronegativitása miatt fluoridoknak, oxidoknak, vagy kloridoknak minősülnek.[20]
A fémek Br2-al való brómozása általában alacsonyabb oxidációs állapotú vegyületet eredményez, mint a klórozás, hogy ha több oxidációs állapot is lehetséges. A bromidok előállíthatók az elemek, vagy oxidjaik, hidroxidjaik és karbonátjaik hidrogén-bromiddal való reakciójával, majd enyhe melegítéssel, alacsony nyomáson, vagy vízmentes hidrogén-bromid gázzal dehidratálhatóak. Ezek a módszerek akkor működnek a legjobban ha a keletkező bromid stabil a hidrolízissel szemben. Más esetben valamilyen száraz eljárást kell alkalmazni, gyakran magas hőmérsékleten. A lehetőségek közt szerepel az elem magas hőmérsékletű oxidatív brómozás elemi brómmal, vagy hidrogén-bromiddal. Abban az esetben, ha egynél több oxidációs állapot lehetséges, néha előfordul, hogy elemi brómmal oxidálva a nagyobb, hidrogén-bromiddal pedig a kisebb oxidációs számú vegyület keletkezik, például a vas esetén:
- Fe + 3⁄2 Br2 → FeBr3
- Fe + 2 HBr → FeBr2 + H2
További eljárásokat jelent a fém-oxidok, vagy más fém-halogenidek magas hőmérsékletű brómozása brómmal, illékony fém-bromiddal, szén-tetrabromiddal, vagy szerves bromiddal. Például a nióbium(V)-oxid szén-tetrabromiddal 370 °C-on reagál nióbium(V)-bromid képződése mellett.[20] Más megoldást jelentenek a halógén cserereakciók, amelyekben a „halogénező ágens” feleslegben van jele, például:[20]
- FeCl3 + BBr3 (feleslegben) → FeBr3 + BCl3
Ha alacsonyabb oxidációs állapotú bromid előállítása a cél, akkor ez elérhető a magasabb oxidációs állapotú bromid fémmel, vagy hidrogénnel való redukciójával, termikus bomlással, vagy diszproporcióval:[20]
- 3 WBr5 + Al → 3 WBr4 + AlBr3 (hőmérséklet csökkentés 475°C → 240°C)
- EuBr3 + 1⁄2 H2 → EuBr2 + HBr
- 2 TaBr4 → TaBr3 + TaBr5 (500°C)
Az alkáli- és alkáliföldfémek, valamint az aktinoidák és lantanoidák +2-es és +3-as vegyértékű bromidjainak többsége ionos, míg a nemfémek és a fémek +3-as oxidációs állapottól felfelé kovalens bromidokat alkotnak. Az ezüst-bromid vízben gyakorlatilag oldhatatlan sárgás-fehér színű csapadék, ezért az analitikában gyakran alkalmazzák bromidok kimutatására.[20]
Interhalogének[szerkesztés]
A halogének számos kettős, diamágneses, XY, XY3, XY5, vagy XY7 sztöchiometriájú (ahol X a nehezebb elem) interhalogén vegyületet alkotnak és ez alól a bróm sem kivétel. A bróm klórral és jóddal kétatomos, fluorral kettő-, négy-, illetve hatatomos interhalogén vegyületet alkot. Ezen vegyületek termikus stabilitása igen nagy változatosságot mutat: a jód-monobromid meglehetősen stabil és szobahőmérsékleten kinyerhető kristályos formában, a bróm-monoklorid megfordítható reakcióban alkotóelemeire disszociál, a bróm-monofluorid pedig gyorsan és irreverzibilisen diszproporcionálódik magasabb oxidációs állapotú fluoridra és brómra. Ezeknek a vegyületeknek néhány kation- illetve anionszármazéka is ismert,példáulilyenek a BrF−2, BrCl−2, BrF+2, BrF+4, és a BrF+6. Ezeken kívül néhány pszeudohalogenid is ismert, mint a cianogén-bromid (BrCN), a bróm-tiocianát (BrSCN) és a bróm-azid (BrN3).[21]
| A bróm fluoridjainak szerkezete | ||

|

|

|
| Bróm-monofluorid | Bróm-trifluorid | Bróm-pentafluorid |
A halványbarna színű bróm-monofluorid (BrF) szobahőmérsékleten instabil, gyorsan és irreverzibilisen diszproporcionálódik brómra, bróm-trifluoridra és bróm-pentafluoridra, emiatt nem is nyerhető ki tisztán. Előállítható az elemek közvetlen reakciójával, vagy a bróm és bróm-trifluorid magas hőmérsékletű szinproporciójával.[21] A bróm-monoklorid (BrCl) standard körülmények között sárgásbarna gáz, ami könnyen disszociál elemeire, ezért ez sem nyerhető ki tisztán, de előállítható az elemek direkt reakciójával gázfázisban, vagy szén-tetrakloridban.[20] A bróm-monofluorid etanolban oldva könnyedén brómozza a PhX szerkezetű aromás vegyületeket (para-brómozás történik X = Me, But, OMe, Br esetén; meta-brómozás a deaktiváló X = –CO2Et, –CHO, –NO2 csoportok esetén); ennek az az oka, hogy a Br-F kötés heterolitikus felhasadásakor keletkező Br+ gyors elektrofil brómozáshoz vezet.[20] A legkevésbé illékony bróm-monohalogenid a jód-monobromid. Ebben a szilárd, fekete kristályos vegyületben a jód-bromid molekulák a jódhoz hasonló szerkezetet alkotva, halszálka-mintában kapcsolódnak egymáshoz. A jód-bromid olvadékában részben ionjaira disszociál és ez az elektromos vezetőképesség jelentős mértékű növekedését eredményezi.[20]
A bróm-trifluorid (BrF3) szobahőmérsékleten szalmasárga színű folyadék. Előállítható a bróm direkt fluorozásával szobahőmérsékleten, majd desztillációval tisztítható. Vízzel és szénhidrogénekkel robbanásszerűen reagál, de a klór-trifluoridnál kevésbé erélyes fluorozószer. Bórral, szénnel, szilíciummal, arzénnel, antimonnal, jóddal és kénnel hevesen reagál fluoridok képződése mellett, ezenkívül a legtöbb fémmel és oxidjaikkal is reagál, emiatt például az atomiparban az urán oxidációja által urán-hexafluorid előállítására használják. A tűzálló oxidokat (például MgO, Al2O3, MnO2, Fe2O3) csak részben fluorozza, ebben az esetben rokon vegyületei (KBrF4 és BrF2SbF6) használatosak. A bróm-trifluorid sokoldalúan alkalmas preparatív célokra nemvizes ionos oldószerként, mivel könnyen disszociál BrF+2 és BrF−4 ionokra, emiatt vezeti az elektromosságot.[22]
A bróm-pentafluoridot (BrF5) először 1930-ban izolálták. Nagyobb mennyiségben a bróm feleslegben lévő fluorral való közvetlen reakciójával állítják elő 150 °C feletti hőmérsékleten, kisebb mennyiségben pedig kálium-bromid 25 °C-on történő fluorozásával is gyártják. A bróm-pentafluorid nagyon erélyes fluorozószer, vízzel robbanásszerűen reagál és 450 °C-on a szilikátokat is fluorozza.[23]
Polibróm vegyületek[szerkesztés]
Noha a bróm erős oxidálószer nagy ionizációs energiával, de a nagyon erős oxidálószerek, mint a peroxo-diszulfonil-fluorid (S2O6F2) képesek oxidálni meggypiros Br+2 kationná. Néhány másik brómkation is ismert, köztük a barna színű Br+3 és a sötétbarna Br+5.[24] Emellett a trijodiddal analóg szerkezetű tribromid-aniont (Br−3) is jellemezték.
Oxidok és oxosavak[szerkesztés]
| E°(pár) | a(H+) = 1 (savoldat) |
E°(pár) | a(OH−) = 1 (lúgoldat) |
|---|---|---|---|
| Br2/Br− | +1,052 | Br2/Br− | +1,065 |
| HOBr/Br− | +1,341 | BrO−/Br− | +0,760 |
| BrO−3/Br− | +1,399 | BrO−3/Br− | +0,584 |
| HOBr/Br2 | +1,604 | BrO−/Br2 | +0,455 |
| BrO−3/Br2 | +1,478 | BrO−3/Br2 | +0,485 |
| BrO−3/HOBr | +1,447 | BrO−3/BrO− | +0,492 |
| BrO−4/BrO−3 | +1,853 | BrO−4/BrO−3 | +1,025 |
A bróm-oxidok száma kisebb és messze kevésbé tanulmányozták őket, mint a klór-, vagy jód-oxidokat. Ennek oka, hogy mind igen instabilak, egykor azt hitték egyáltalán nem is léteznek. A dibróm-monoxid sötétbarna szilárd anyag, ami −60 °C alatti hőmérsékleten viszonylag stabil, de olvadáspontján −17,5 °C-on elbomlik. Brómozási reakciókban használják[26] és előállítható brómgőz és higany(II)-oxid reakciójával, vagy bróm-dioxid alacsony hőmérsékleten, vákuumban történő elbontásával. A jódot jód-pentaoxiddá, a benzolt 1,4-benzokinonná oxidálja, lúgos oldatban hipobromit anionokká alakul.[27]
A bróm-dioxid világossárga, szilárd kristályos anyag, amelynek szerkezete inkább bróm-perbromátként (BrOBrO3) adható meg. −40 °C fölött termikusan nem stabilis és 0 °C-on heves reakció közben elemeire bomlik. A dibróm-trioxid (BrOBrO2) szintén ismert, ami formálisan a hipobrómossav és a brómsav vegyes anhidridje. Narancssárga kristályos vegyület, −40 °C fölött bomlik és ha gyorsan melegítik, 0 °C körül felrobban. Ezek mellett a nem stabil BrO, BrO2 és BrO3 monomer gyököket is előállították.[27]
A bróm négy oxosavja, a hipobrómossav (HOBr), a brómossav (HOBrO), a brómsav (HOBrO2), és a perbrómsav (HOBrO3) nagyobb stabilitással bír az oxidoknál, de csak vizes oldatban léteznek. A bróm vízben való oldásakor a következő reakciók játszódnak le:[25]
- Br2 + H2O ⇌ HBrO + H+ + Br− (savas oldat)
- Br2 + 2 OH− ⇌ BrO− + H2O + Br− (lúgos oldat)
A hipobrómossav könnyen diszproporcionálódik brómsavra és bromidra:[25]
- 3 BrO− ⇌ 2 Br− + BrO−3
A hipobrómossav sói, a hipobromitok vizes oldata lúgos kémhatású, mivel a hipobromitionok hidrolízisekor hidroxidionok keletkeznek.

A brómossav és sói, a bromitok nagyon instabilak, de a stroncium és bárium bromitjai ismertek.[28] Fontosabbak a bromátok, melyeket kisebb mennyiségben elő lehet állítani bromidionok hipoklorit-oldattal való oxidációjával és erős oxidálószerek. A brómsav vizes oldatban erős savként viselkedik. A bromidok és bromátok szinproporcióval brómmá alakulhatnak a következők szerint:[28]
- BrO−3 + 5 Br− + 6 H+ → 3 Br2 + 3 H2O
Számos sikertelen próbálkozás történt a perbromátok és a perbrómsav előállítására, melyek különböző elképzelésekhez vezettek arról, hogy ezek miért nem léteznek. A perbromátion radiokémiai szintézisét végül 1968-ban sikerült megvalósítani a 83SeO42- radioaktív bomlásának felhasználásával. Ma a legjobb eljárás a perbromátok előállítására a bromát lúgos oldatának fluorgázzal való oxidációja. A gyakorlatban a fluorgázt addig buborékoltatják át az oldaton, amíg az semleges nem lesz, és ekkor a feleslegben lévő bromát- és fluoridion ezüst-bromát és kalcium-fluorid csapadék formájában leválik és ezután tisztítással nyerhető a perbrómsav híg vizes oldata. A perbromátion szobahőmérsékleten viszonylag inert, ami éles ellentétben áll a nagy termodinamikai oxidálóképességével, ami az összes többi oxohalogénionnál nagyobb. Emiatt csak a legerősebb oxidálószerek képesek a bromátokat perbromáttá oxidálni, például a fluor, vagy a xenon-difluorid. A Br−O kötés a BrO−4-ban lényegesen gyengébb, mint más perhalogenátok X−O kötése, ami összhangban van a 4p elemek (különösen az arzén, szelén és bróm) maximális oxidációs állapot kialakítására való kis hajlandóságával.[29]
Szerves vegyületek[szerkesztés]
A többi szén-halogén kötéshez hasonlóan a szén-bróm kötés is gyakori funkciós csoport és a szerves kémia szerves részét képezi. Formálisan ezt a funkciós csoportot tartalmazó vegyületeket a bromidion szerves származékainak tekinthetjük. A bróm és a szén elektronegativitása közti különbség miatt (2,96 és 2,55) a brómhoz kapcsolódó szénatom elektronhiányos és ezért elektrofil. A brómorganikus vegyületek reakciókészsége a klórorganikus és jódorganikus vegyületek közt helyezkedik el. Számos felhasználási területen a szerves brómvegyületet kompromisszumos megoldást jelentenek a reaktivitás és az ár szempontjából.[30]
A szerves brómvegyületeket jellemzően más szerves vegyületek addíciós, vagy szubsztitúciós brómozásával állítják elő. Ehhez magát a brómot is lehet használni, de toxicitása és illékonysága miatt többnyire biztonságosabb brómozó reagenseket alkalmaznak, például N-brómszukcinimidot. A szerves brómvegyületek alapvető reakciói közé tartozik a hidrogén-bromid elimináció, a Grignard-reakció, a Wurtz-szintézis és a nukleofil szubsztitúció.[30]
A szerves brómvegyületek a leggyakoribb szerves halogenidek a természetben, annak ellenére, hogy a bróm koncentrációja a tengervízben mindössze 0,3%-a a klórénak. Ennek oka a bromidion könnyű oxidálhatósága az erős elektrofil Br+ ionná. A brómperoxidáz enzim katalizálja ezt a reakciót.[31] Becslések szerint az óceánok évente 1–2 millió tonna bromoformot és 56 000 tonna brómmetánt bocsátanak ki.[32]
Az alkének kimutatására szolgáló hagyományos kvalitatív teszt az, hogy az alkének a sárgás-barna brómos vizet elszíntelenítik, mivel addíciós reakcióba lépnek vele brómhidrint és dibrómalkánt alkotva. A reakció a rövidéletű elektrofil bromónium ionon megy keresztül.[33]
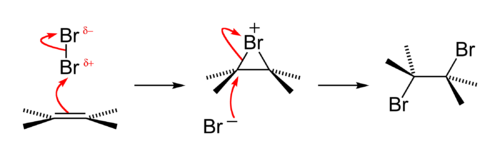
Előfordulás és előállítás[szerkesztés]

A bróm a földkéregben lényegesen kisebb gyakorisággal fordul elő, mint a fluor, vagy a klór: 2,5 ppm-el mindössze a földkéreg 46. leggyakoribb eleme, mennyisége hasonló a céziumhoz (1,6 ppm), vagy az uránhoz (2,3 ppm). Az óceánokban ennél jóval nagyobb mennyiségben található meg, itt a koncentrációja 65 ppm-et tesz ki, így minden brómatomra körülbelül 660 klóratom jut. A sóstavak és sós vizű források ennél általában gazdagabbak brómban, például a Holt-tenger vize 0,4% bromidiont tartalmaz.[34] A brómtermelés leginkább ezekből a forrásokból valósítható meg.[35][36][37]
A legfőbb brómtermelő országok az Egyesült Államok, ahol főként az Arkansas-i sós vizekből és Izrael, ahol a Holt-tenger vizéből nyerik ki a brómot. A tengervízből kinyert bromidokat klórral oxidálják, ezt követően kigőzölögtetéssel, vagy levegővel kifúvatva távolítják el az oldatból, majd cseppfolyósítják és tisztítják. A világ brómtermelése 1990-ben 438 000 tonna volt, ami hozzávetőlegesen az egyszázada a világ klórtermelésének. Az előállított brómot 100 kg kapacitású Monel-fém hordókban, vagy 24–48 tonna kapacitású ólombélésű tartályokban szállítják.[38]
Felhasználás[szerkesztés]
Az iparban a szerves brómvegyületek széles választékát alkalmazzák. Egyes ilyen vegyületeket brómból gyártanak, másokat hidrogén-bromidból, amelyet a hidrogén brómban való égetésével nyernek.[39]
Égésgátlók[szerkesztés]

A brómvegyületeket széles körben alkalmazzák égésgátló anyagokként. Magas hőmérsékleten ezekből a vegyületekből hipobrómossav keletkezik, amely befolyásolja az égés során végbemenő gyökös láncreakciót. Az égés során keletkező igen reaktív hidrogén-, oxigén- és hidroxi- gyökök a hipobrómossavval reagálva kevésbé reaktív brómgyököket (vagy szabad brómatomokat) alkotnak. Ezen kívül a brómatomok is reagálhatnak más gyökökkel végetvetve a szabad gyökös láncreakciónak.[40][41]
Brómozott polimerek és műanyagok előállításához a brómtartalmú vegyületet be lehet építeni a polimerbe a polimerizáció során. Erre egy mód viszonylag kis mennyiségű brómozott monomer hozzáadása a polimerizációs eljárás során. Például vinil-bromidot lehet használni a polietilén, poli(vinil-klorid), vagy a polipropilén gyártásakor. Specifikus, erősen brómozott molekulákat is hozzá lehet adni, melyek részt vesznek a polimerizációban. Például a tetrabrómbiszfenol A-t poliészterekhez, vagy epoxigyantákhoz adva az a polimer részévé válik. Egyes esetekben a brómtartalmú vegyületet a polimerizáció után is hozzá lehet adni a termékhez, például a dekabróm-difenil-éter esetén.[42]
Számos nem mérgező, gáz halmazállapotú, vagy illékony brómozott halometán vegyület ugyanezen mechanizmus alapján kitűnően használható tűzoltószerként, főként zárt terekben, például repülőkön, űrhajókon, vagy tengeralattjárókon. Ezek a vegyületek ugyanakkor elég drágák és a termelésük ma már erősen korlátozva van az ózonrétegre való káros hatásaik miatt. Ma már nem használják őket az általános tűzoltókészülékekben, mindössze egyes légi, vagy katonai automatikus tűzoltó-berendezésekben. Ilyen vegyületek például a bróm-klórmetán (Halon 1011, CH2BrCl), a bróm-difluor-klórmetán (Halon 1211, CBrClF2) és a bróm-trifluormetán (Halon 1301, CBrF3).[43]
Egyéb felhasználás[szerkesztés]
Valamikor a bróm ipari felhasználása szinte egyetlen vegyület, a dibrómetán (etilén-dibromid) előállítására korlátozódott, ami a benzinhez kopogásgátlóként adott ólomvegyületekből származó ólom hatástalanítására szolgált. Az 1970-es évektől kezdve azonban a környezetvédelmi szabályozások miatt ez az alkalmazási terület jelentősen lecsökkent.[44]
A mérgező brómmetánt széles körben alkalmazták féregirtószerként, valamint általános gyomirtó, gombaölő és rovarirtó szerként is. Ilyen célokra alkalmazták még a dibróm-etánt és a dibróm-klór-etánt is. A montréali jegyzőkönyvben azonban előírták e vegyületek termelésének fokozatos beszüntetését és azóta nem használnak brómvegyületeket kártevőirtásra. A montréali jegyzőkönyv előtt, 1991-ben a metil-bromidból becslések szerint 35 000 tonnát használtak fel kártevőirtásra.[45][46]
A XIX. században és a XX. század elején brómvegyületeket, különösen kálium-bromidot elterjedten használtak általános nyugtatóként. A bromidokat egyszerű sók formájában még ma is használják görcsoldóként állati és emberi gyógyászatban egyaránt, bár ez utóbbi országonként változik. Például az Amerikai Élelmiszer-, és Gyógyszer Ellenőrző Hatóság (FDA) nem járul hozzá a bróm bármely betegség kezelésére való használatához és 1975-ben eltávolították a vény-nélkül kapható nyugtatókból.[47]
A brómtartalmú vegyületek egyéb alkalmazási területeit jelentik a nagysűrűségű fúróemulziók, festékek (például a türoszi bíbor, vagy a sav-bázis indikátor brómtimolkék) és gyógyszerek. A brómot és néhány vegyületét alkalmazzák a víz fertőtlenítésére, valamint számos szervetlen vegyület szintézisére, ilyen például a fényképészetben használt ezüst-bromid.[38]
Biológiai szerep[szerkesztés]


A halogéncsoportban lévő szomszédjaival, a klórral és a jóddal ellentétben a brómnak nincs ismert biológiai szerepe az emberben. Egyetlen 2014-es tanulmány vetette fel, hogy a bróm szükséges katalizátor lehet a IV. típusú kollagén előállításához, ami létfontosságú az alaphártya kialakításában és a szövetfejlődésben, de ezek a felfedezések nem nyertek bizonyítást.[48] Ezen kívül a bróm nyomelemi szerepére csak közvetett bizonyítékként szolgálhatnak a brómhiány feltételezett tünetei.[49]
Mindenesetre, ha a bróm nem is esszenciális elem, gyógyászati célra hasznos lehet. Például az eozinofil hatására képződő hidrogén-peroxid és klorid-, vagy bromidionok jelenlétében az eozinofil peroxidáz egy hatásos mechanizmust kínál, mely által az eozinofilek elpusztítják a többsejtű parazitákat, például a fonálférgeket és egyes baktériumokat (például a tuberkulózis baktériumokat). Az eozinofil peroxidáz egy halo-peroxidáz enzim, mely erre a célra inkább bromidot használ klorid helyett hipobromidot (hipobrómossavat) termelve, bár a klorid használata is lehetséges.[50]
A tengeri organizmusok a szerves brómvegyületek fő forrásai és ezekben az élőlényekben a bróm esszencialitása sokkal bizonyosabb. 1999-ig több, mint 1600 ilyen szerves brómvegyületet azonosítottak. A leggyakoribb közülük a metil-bromid (CH3Br), melyből a tengeri algák becslések szerint 56 000 tonnányit termelnek évente.[51] A hawaii alga, az Asparagopsis taxiformis illóolaja 80%-ban bromoformot tartalmaz.[52] A legtöbb ilyen brómvegyület a tengerben a vanádium-bromoperoxidáz enzim hatására képződik az algákban.[53] Jelentős gyakorlati haszna volt az ókorban a textilfestésre használt 6,6’-dibróm-indigónak, melyet a bíborcsigából (Murex brandaris) vontak ki.[8]
Biztonság[szerkesztés]
A bromidion nem nagyon mérgező, normál napi bevitele 2–8 milligramm.[49] A bromid túl magas szintje viszont krónikusan károsíthatja az idegsejtek membránját, mely fokozatosan károsítja az ingerületátvitelt, bromid-intoxikációhoz, vagy más néven bromizmushoz vezetve. A bromid biológiai felezési ideje 9–12 nap, így a szervezetben nagy mértékben felhalmozódhat. Napi 0,5–1 grammnyi bromid bevitele már bromizmushoz vezethet. Régen a bromid terápiás dózisa 3–5 gramm volt, ez megmagyarázza miért volt egykor a bromizmus olyan gyakori. Míg a bromizmus jelentős és esetenként komoly neurológiai, pszichiátriai, dermatológiai vagy gasztrointesztinális zavarokat okozhat, halálhoz ritkán vezet.[54] A bromizmust az agyra gyakorolt neurotoxikus hatások okozzák, melyek aluszékonysághoz, pszichózishoz, epilepsziás rohamokhoz, illetve delíriumhoz vezethetnek.[55]
Az elemi bróm mérgező és súlyos égési sérüléseket okozhat. Belélegezve a légutak irritációját okozhatja, köhögéshez, torokfájáshoz és légszomjhoz vezethet, nagyobb mennyiségben belélegezve pedig halálhoz. A tartós kitettség gyakori hőrgő-fertőzéseket és az egészség általános romlását okozhatja. A bróm erős oxidálószer, hevesen reagál gyúlékony és redukáló anyagokkal. Az anyag a legtöbb szerves és szervetlen anyaggal reakcióba lép, tűz- és robbanásveszélyt okozva. Megtámadja a fémet, a gumi egyes formáit, a műanyagot és a bevonatokat.[56] A bróm szállítása elővigyázatosságot igényel: legtöbbször ólommal bélelt, erős fémvázzal megerősített acéltartályokban szállítják.[38]
Források[szerkesztés]
- Makkay Ferenc: Kémiai kislexikon. Kriterion Könyvkiadó
Jegyzetek[szerkesztés]
- ↑ Current Table of Standard Atomic Weights in Order of Atomic Number. Commission on Isotopic Abundances and Atomic Weights – Commission II.I of the International Union of Pure and Applied Chemistry, 2013. (Hozzáférés: 2013. október 13.)
- ↑ Magnetic susceptibility of the elements and inorganic compounds, Handbook of Chemistry and Physics 81st edition, CRC press.
- ↑ Löwig, Carl Jacob (1829. április 25.). „Das Brom und seine chemischen Verhältnisse” (német nyelven), Kiadó: Carl Winter.
- ↑ Balard, A. J. (1826. április 25.). „Mémoire sur une substance particulière contenue dans l'eau de la mer” (francia nyelven). Annales de Chimie et de Physique 32, 337–381. o.
- ↑ a b Balard, Antoine (1826. április 25.). „Memoir on a peculiar Substance contained in Sea Water”. Annals of Philosophy 28, 381–387 and 411–426. o.
- ↑ Weeks, Mary Elvira (1932. április 25.). „The discovery of the elements: XVII. The halogen family”. Journal of Chemical Education 9 (11), 1915. o. DOI:10.1021/ed009p1915.
- ↑ Landolt, Hans Heinrich (1890. április 25.). „Nekrolog: Carl Löwig”. Berichte der deutschen chemischen Gesellschaft 23 (3), 905. o. DOI:10.1002/cber.18900230395.
- ↑ a b c Greenwood and Earnshaw, p. 790
- ↑ Barger, M. Susan. Technological Practice of Daguerreotypy, The Daguerreotype: Nineteenth-century Technology and Modern Science. JHU Press, 31–35. o. (2000. április 25.). ISBN 978-0-8018-6458-2
- ↑ Shorter, Edward. A History of Psychiatry: From the Era of the Asylum to the Age of Prozac. John Wiley and Sons, 200. o. (1997. április 25.). ISBN 978-0-471-24531-5
- ↑ Chapter 2: History of Chemical Warfare (pdf), Medical Aspects of Chemical Warfare. Borden Institute, 12–14. o. (2008). Hozzáférés ideje: 2017. március 18.
- ↑ a b c d e f g h Greenwood and Earnshaw, pp. 800–4
- ↑ Johann Wolfgang Dobereiner. Purdue University. [2014. november 14-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. március 8.)
- ↑ A Historic Overview: Mendeleev and the Periodic Table. NASA. (Hozzáférés: 2008. március 8.)
- ↑ a b c Greenwood and Earnshaw, pp. 804–9
- ↑ Duan, Defang (2007. szeptember 26.). „Ab initio studies of solid bromine under high pressure”. Physical Review B 76 (10), 104113. o. DOI:10.1103/PhysRevB.76.104113.
- ↑ (2003. április 25.) „The NUBASE evaluation of nuclear and decay properties”. Nuclear Physics A 729, 3–128. o. [2011. július 20-i dátummal az eredetiből archiválva]. DOI:10.1016/j.nuclphysa.2003.11.001. (Hozzáférés: 2010. július 5.)
- ↑ a b Greenwood and Earnshaw, pp. 809–12
- ↑ a b Greenwood and Earnshaw, pp. 812–6
- ↑ a b c d e f g h Greenwood and Earnshaw, pp. 821–4
- ↑ a b Greenwood and Earnshaw, pp. 824–8
- ↑ Greenwood and Earnshaw, pp. 828–31
- ↑ Greenwood and Earnshaw, pp. 832–5
- ↑ Greenwood and Earnshaw, pp. 842–4
- ↑ a b c Greenwood and Earnshaw, pp. 853–9
- ↑ Perry, Dale L. & Phillips, Sidney L. (1995), Handbook of Inorganic Compounds, CRC Press, pp. 74, ISBN 0-8493-8671-3, <https://books.google.com/books?id=0fT4wfhF1AsC&pg=PA74&dq=%22Bromine+dioxide%22>. Hozzáférés ideje: 25 August 2015
- ↑ a b Greenwood and Earnshaw, pp. 850–1
- ↑ a b Greenwood and Earnshaw, pp. 862–5
- ↑ Greenwood and Earnshaw, pp. 871–2
- ↑ a b Ioffe, David and Kampf, Arieh (2002) “Bromine, Organic Compounds” in Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons. doi:10.1002/0471238961.0218151325150606.a01.
- ↑ (2004) „Vanadium Bromoperoxidase-Catalyzed Biosynthesis of Halogenated Marine Natural Products”. Journal of the American Chemical Society 126 (46), 15060. o. DOI:10.1021/ja047925p. PMID 15548002.
- ↑ (1999) „The diversity of naturally occurring organobromine compounds”. Chemical Society Reviews 28 (5), 335. o. DOI:10.1039/a900201d.
- ↑ Organic Chemistry, 2nd, Oxford University Press, 427–9. o. (2012. április 25.). ISBN 978-0-19-927029-3
- ↑ Greenwood and Earnshaw, pp. 795–6
- ↑ Tallmadge, John A. (1964. április 25.). „Minerals From Sea Salt”. Ind. Eng. Chem. 56 (7), 44. o. DOI:10.1021/ie50655a008.
- ↑ Oumeish, Oumeish Youssef (1996. április 25.). „Climatotherapy at the Dead Sea in Jordan”. Clinics in Dermatology 14 (6), 659. o. DOI:10.1016/S0738-081X(96)00101-0.
- ↑ Al-Weshah, Radwan A. (2008. április 25.). „The water balance of the Dead Sea: an integrated approach”. Hydrological Processes 14, 145. o. DOI:<145::AID-HYP916>3.0.CO;2-N 10.1002/(SICI)1099-1085(200001)14:1<145::AID-HYP916>3.0.CO;2-N.
- ↑ a b c Greenwood and Earnshaw, pp. 798–9
- ↑ Mills, Jack F.. Bromine: in Ullmann's Encyclopedia of Chemical Technology. Weinheim: Wiley-VCH Verlag. DOI: 10.1002/14356007.a04_391 (2002. április 25.)
- ↑ Green, Joseph (1996. április 25.). „Mechanisms for Flame Retardancy and Smoke suppression – A Review”. Journal of Fire Sciences 14 (6), 426. o. DOI:10.1177/073490419601400602.
- ↑ Kaspersma, Jelle (2002. április 25.). „Fire retardant mechanism of aliphatic bromine compounds in polystyrene and polypropylene”. Polymer Degradation and Stability 77 (2), 325. o. DOI:10.1016/S0141-3910(02)00067-8.
- ↑ Weil, Edward D. (2004. április 25.). „A Review of Current Flame Retardant Systems for Epoxy Resins”. Journal of Fire Sciences 22, 25. o. DOI:10.1177/0734904104038107.
- ↑ Günter Siegemund, Werner Schwertfeger, Andrew Feiring, Bruce Smart, Fred Behr, Herward Vogel, Blaine McKusick “Fluorine Compounds, Organic” Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2002. doi:10.1002/14356007.a11_349
- ↑ Alaeea, Mehran (2003. április 25.). „An overview of commercially used brominated flame retardants, their applications, their use patterns in different countries/regions and possible modes of release”. Environment International 29 (6), 683–9. o. DOI:10.1016/S0160-4120(03)00121-1. PMID 12850087.
- ↑ Messenger, Belinda: Alternatives to Methyl Bromide for the Control of Soil-Borne Diseases and Pests in California. Pest Management Analysis and Planning Program, 2000 [2010. április 21-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. november 17.)
- ↑ Decanio, Stephen J. (2008. április 25.). „Economics of the "Critical Use" of Methyl bromide under the Montreal Protocol”. Contemporary Economic Policy 23 (3), 376. o. DOI:10.1093/cep/byi028.
- ↑ Samuel Hopkins Adams. The Great American fraud. Press of the American Medical Association (1905. április 25.). Hozzáférés ideje: 2011. június 25.
- ↑ McCall AS (2014. április 25.). „Bromine Is an Essential Trace Element for Assembly of Collagen IV Scaffolds in Tissue Development and Architecture”. Cell 157 (6), 1380–92. o. DOI:10.1016/j.cell.2014.05.009. PMID 24906154.
- ↑ a b (2000) „Possibly Essential Trace Elements”, 11–36. o. DOI:10.1007/978-1-59259-040-7_2.
- ↑ Mayeno AN (1989. április 25.). „Eosinophils preferentially use bromide to generate halogenating agents”. J. Biol. Chem. 264 (10), 5660–8. o. PMID 2538427.
- ↑ Gribble, Gordon W. (1999. április 25.). „The diversity of naturally occurring organobromine compounds”. Chemical Society Reviews 28 (5), 335. o. DOI:10.1039/a900201d.
- ↑ Burreson, B. Jay (1976. április 25.). „Volatile halogen compounds in the alga Asparagopsis taxiformis (Rhodophyta)”. Journal of Agricultural and Food Chemistry 24 (4), 856. o. DOI:10.1021/jf60206a040.
- ↑ Butler, Alison (2004. április 25.). „The role of vanadium bromoperoxidase in the biosynthesis of halogenated marine natural products”. Natural Product Reports 21 (1), 180–8. o. DOI:10.1039/b302337k. PMID 15039842.
- ↑ Poisoning & drug overdose, 4th, Appleton & Lange, 140–141. o. (2003. november 1.). ISBN 978-0-8385-8172-8
- ↑ The American Psychiatric Publishing Textbook of Substance Abuse Treatment, 4th, United States of America: American Psychiatric Publishing Inc, 217. o. (2008. július 1.). ISBN 978-1-58562-276-4
- ↑ Science Lab.com: Material Safety Data Sheet: Bromine MSDS. sciencelab.com . [2017. november 15-i dátummal az eredetiből archiválva]. (Hozzáférés: 2017. március 24.)
Bibliográfia[szerkesztés]
- Greenwood, Norman N., Earnshaw, Alan. Chemistry of the Elements, 2nd, Butterworth-Heinemann (1997). ISBN 0-08-037941-9
Fordítás[szerkesztés]
- Ez a szócikk részben vagy egészben a Bromine című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.



