Aromás szénhidrogének

Az aromás szénhidrogének (vagy ritkán használatos megnevezéssel arének) olyan gyűrűs, telítetlen szénhidrogének, amelyek molekulájában egy vagy több benzolgyűrű, vagy ahhoz hasonló gyűrűrendszer található. Bennük formálisan konjugált kettős kötés-rendszer található, így a cikloalkénekkel megegyező szerkezetűek lennének. A formai hasonlóság ellenére mégis szükséges őket külön tárgyalni, mert – a cikloalkénektől eltérően – reakcióik többségében nem telítetlen kötésrendszerként viselkednek. Ennek oka az, hogy az aromás szénhidrogének sajátos, hat π-elektronból álló, zárt konjugációt (π-elektronszextettet) hoznak létre. Az ezáltal különlegesen stabilissá váló szerkezeten pedig addíciós reakciók helyett már inkább szubsztitúciós reakciók játszódnak le, vagyis az aromás szénhidrogének kémiája alapvetően eltér az alkének kémiájától. Az aromás elnevezés onnan származik, hogy az először vizsgált aromás vegyületeket növényekből vonták ki, és ezeknek jellegzetes illatuk volt (benzil-alkohol, benzaldehid, toluol).
Az aromás szénhidrogének lehetnek monociklusosak és policiklusosak. Legegyszerűbb képviselőjük, mintegy „alapvegyületük” a benzol (C6H6).[1] Monociklusos (egy aromás gyűrűt tartalmazó) vegyületeik a benzol származékainak tekinthetők, a benzol utáni legegyszerűbb képviselőjük a toluol, melyben a benzol egyik hidrogénatomját egy metilcsoport helyettesíti.
Osztályozás és elnevezés[szerkesztés]
A vegyületben található aromás gyűrűk száma alapján megkülönböztetünk mono-, illetve policiklusos aromás szénhidrogéneket. Több gyűrű esetén a gyűrűk egymáshoz viszonyított helyzete alapján a szénhidrogén lehet izolált és kondenzált.
Monociklusos aromás szénhidrogének[szerkesztés]
Monociklusos aromás szénhidrogéneknek nevezzük az egyetlen aromás gyűrűt tartalmazó vegyületeket. Legegyszerűbb képviselőjük a benzol, de idetartoznak a benzol telített és telítetlen oldalláncú származékai is. Nómenklatúrájukat a következő példák szemléltetik:
-
metilbenzol (toluol) -
etilbenzol -
vinil-benzol (sztirol) -
izopropilbenzol (kumol)
Néhány benzolszármazéknál elterjedt a triviális nevük használata, ezek zárójelben szerepelnek.
Ha a gyűrűhöz több oldallánc is kapcsolódik, a gyűrűszénatomok számozása szükséges. A két szubsztituens háromféle módon csatlakozhat a benzolgyűrűhöz: 1,2-, 1,3- és 1,4-helyzetben. A számozás helyett az orto-, para-, vagy meta-elnevezést is szokás használni.
-
1,2-dimetilbenzol (orto-xilol) -
1,3-dimetilbenzol (meta-xilol) -
1,4-dimetilbenzol (para-xilol)
Három, vagy négy hidrogénatom azonos csoportokkal való helyettesítésekor szintén három izomer lehetséges. Ha a gyűrűhöz több, nem azonos oldallánc kapcsolódik, a láncok egymáshoz viszonyított helyzetét számozással adjuk meg úgy, hogy lehetőleg minél kisebbek legyenek a számok, és a kapcsolódó csoportokat ABC-rendben soroljuk fel. Például: 1-etil-3-metilbenzol. Az aromás szénhidrogénekből származtatható, egyértékű csoportot arilcsoportnak, a kétértékű csoportot ariléncsoportnak nevezzük. Így például a benzolból egy hidrogén elvételével fenilcsoport, két hidrogén elvételével pedig orto-, meta- vagy para-feniléncsoport vezethető le. A legfontosabb arilcsoportok:
-
fenilcsoport -
benzilcsoport -
p-feniléncsoport
Izolált policiklusos aromás szénhidrogének[szerkesztés]
Azok a többgyűrűs vegyületek tartoznak ebbe a csoportba, melyekben a gyűrűk nem tartalmaznak közös szénatomot, azaz izolálva (elválasztva) vannak egymástól. A molekulában az aromás gyűrű egy vagy több hidrogénatomját helyettesítheti arilcsoport, de nyíltláncú szénhidrogénhez is kapcsolódhat kettő vagy több arilcsoport. Például:
-
bifenil -
difenilmetán -
trifenilmetán
Kondenzált policiklusos aromás szénhidrogének[szerkesztés]
A kondenzált gyűrűs policiklusos szénhidrogénekben bármely két szomszédos gyűrű úgy kapcsolódik egymáshoz, hogy két közös szénatomjuk van. Ha a molekulában nem található olyan gyűrű, melynek kettőnél több szomszédja van, orto-kondenzált, viszont ha egyes gyűrűknek kettőnél több közvetlen szomszédjuk van, peri-kondenzált gyűrűrendszerről beszélünk.[2] Három vagy több orto-kondenzált gyűrű egymáshoz való illeszkedése lehet lineáris vagy anguláris, azaz szöget bezáró. Három benzolgyűrű lineáris kondenzálódása az antracén, anguláris kapcsolódása pedig a fenantrén szerkezetéhez vezet.
| Vegyület neve | Képlet | Vegyület neve | Képlet |
|---|---|---|---|
| Antracén |  |
Benzo[a]pirén | 
|
| Krizén |  |
Koronén | 
|
| Korannulén |  |
Tetracén | |
| Naftalin |  |
Pentacén | |
| Fenantrén |  |
Pirén | 
|
| Trifenilén |  |
Ovalén | 
|
Fizikai tulajdonságok[szerkesztés]

Az aromás szénhidrogének egy része kellemes illatú vegyület, innen ered a nevük is. Kormozó lánggal égnek, ennek magyarázata a molekulákban lévő szén nagy aránya a hidrogénhez képest. A benzol és kisebb szénatomszámú homológjai szobahőmérsékleten folyékonyak, a kondenzált gyűrűs vegyületek szilárd, kristályos anyagok. Olvadás és forráspontjuk magasabb, mint a megfelelő nyíltláncú szénhidrogéneknek.[3] A benzol forráspontja 80 °C, mely magasabb, mint a neki megfelelő szénatomszámú nyílt láncú hexánnak. Ennek oka valószínűleg az, hogy a delokalizált elektronjai miatt ideiglenesen polarizálódhat.[4] A toluol 111 °C-on forr. Mivel a toluolmolekulák mérete nagyobb, mint a benzolé, ezért a köztük létrejövő van der Waals-erők is erősebbek lesznek. A toluolnak emellett van egy nagyon gyenge dipólusmomentuma, mely szintén hozzájárul a molekulák közti kölcsönhatásokhoz. A nem túl magas szénatomszámú benzolszármazékok olvadáspontja jelentősen alacsonyabb a benzolénál (benzol: 5,5 °C, toluol: −95 °C). Sűrűségük kisebb, mint a vízé. Vízben nem, de szerves oldószerekben kitűnően oldódnak. Mérgezőek, egyes képviselőik, főként a polikondenzált gyűrűs vegyületek – de például a benzol is – rákkeltő hatásúak.
| Vegyület | CnHm | Forráspont °C |
Sűrűség g/cm³ |
ΔHk kJ/mol |
S0 kJ/(mol*K) |
ΔGk0 |
|---|---|---|---|---|---|---|
| Benzol | C6H6 | 80 | 0,879 | 83 | 0,269 | 124 |
| Toluol | C7H8 | 111 | 0,866 | 50 | 0,321 | 122 |
| P-xilol | C8H10 | 138 | 0,861 | 18 | 0,352 | 121 |
| Etilbenzol | C8H10 | 136 | 0,867 | 30 | 0,361 | 131 |
| Propilbenzol | C9H12 | 159 | 0,862 | 8 | 0,401 | 137 |
| Izopropilbenzol | C9H12 | 152 | 0,862 | 4 | 0,389 | 136 |
| Sztirol | C8H8 | 145 | 0,906 | 147 | 0,345 | 214 |
| Naftalin | C10H8 | 218 | 1,025 | 151 | 0,336 | 224 |
| Azulén | C10H8 | 242 | 1,037 | 280 | 0,338 | 352 |
A kisebb szénatomszámú aromás szénhidrogének színtelenek, de a kondenzált policiklusos vegyületek színe a konjugáció kiterjedésével fokozatosan elmélyül – a színeltolódás oka a kötő és lazító molekulapályák közti energiakülönbség fokozatos csökkenésére vezethető vissza:

|

|

|
| Antracén | Tetracén | Pentacén |
Kémiai tulajdonságok[szerkesztés]
Addíciós reakciók[szerkesztés]
Nincs.
Szubsztitúciós reakciók[szerkesztés]
Az aromás szénhidrogének legjellegzetesebb reakciója az elektrofil szubsztitúció. A reakcióban az aromás vegyület valamely atomját – többnyire egy hidrogénatomot – egy elektrofil atom vagy csoport helyettesít, melléktermék képződése mellett. A reakció során a poláris, vagy polarizálható reagens elektrofil része kation formában támad az aromás gyűrű elektrondús helyén, majd az átmenetileg keletkező karbokation protonvesztéssel stabilizálódik.
Reakciómechanizmus[szerkesztés]
Az első lépésben az elektronban gazdag aromás gyűrű – a legegyszerűbb esetben benzol – megtámadja az A elektrofilt. Ennek során az A addícionálódik a gyűrű egy szénatomjára. A σ-kötést létesítő elektronpár a benzol π-elektronszextettjéről származik, tehát a reakcióban a benzol a nukleofil reagens. A folyamatban pozitív töltésű ciklohexadienil kation, más néven aréniumion keletkezik. Ez a karbokation instabil, egyrészt a molekula pozitív töltése miatt, másrészt az aromás jelleg ideiglenes megszűnésének következtében. A ciklohexadienil kationt azonban részben stabilizálja a mezoméria, melynek révén a pozitív töltés három szénatom között oszlik el.
A reakció második lépésében a B Lewis-bázis elektront ad át az elektrofil támadás helyén lévő hidrogénatomnak, és a hidrogén kötő elektronpárja a pi-rendszerbe visszakerülve helyreállítja az aromás rendszert.
A benzolon bekövetkező elektrofil szubsztitúciós reakció nem mindig monoszubsztituált terméket eredményez. Bár az elektrofil szubsztituensek többnyire elszívják az elektronokat az aromás gyűrűből, és így a további reakciókkal szemben dezaktiválják azt, a kellően erős elektrofilek második vagy akár harmadik szubsztitúciót is okozhatnak. Ez különösen igaz abban az esetben, ha katalizátor is jelen van.
Szubsztituensek hatása[szerkesztés]
Az aromás gyűrűn lévő szubsztituensek kétféleképpen befolyásolhatják a reakciót. Egyrészt fokozhatják vagy csökkenthetik a reakció sebességét – amit a benzolra vonatkoztatott relatív sebességi állandóval lehet jellemezni –, másrészt irányító hatást fejthetnek ki. Azokat a szubsztituenseket, melyek növelik a reakciósebességet, aktiváló, azokat, melyek csökkentik a reakciósebességet, dezaktiváló szubsztituenseknek nevezzük. Az első csoportba azok a szubsztituensek tartoznak, amelyek általános elektrondonor tulajdonságuk következtében megnövelik az aromás gyűrű elektronsűrűségét. Mivel elektrofil szubsztitúció folyamán a támadó elektrofil csoport annál könnyebben lép reakcióba, minél nagyobb az elektronsűrűség a gyűrűben, így az elektrondonor tulajdonságú szubsztituensek hatására a szubsztitúciós reakció sebessége nagyobb lesz, mint a benzol esetében, elektronakceptor csoportok pedig csökkentik a gyűrű reakciókészségét, így dezaktiváló hatást fejtve ki. Aktiváló szubsztituensre példa a fenolos hidroxilcsoport, dezaktiválóra pedig a nitro- és nitrilcsoport. Az aromás gyűrűhöz kapcsolódó szubsztituensek másik csoportosítása abból a régóta ismert kísérleti tényből indul ki, hogy szubsztituált benzolszármazékok reakciójában a második szubsztituens nem egyforma valószínűséggel kapcsolódik a gyűrű szabadon maradt szénatomjaihoz: az első szubsztituens irányítja a második csoport belépését. Az irányító hatás szempontjából kétféle szubsztituenscsoportot különböztetünk meg. Az egyik csoportba tartozó szubsztituensek főleg orto- és para-helyzetbe, a másik csoport tagjai pedig elsősorban meta-helyzetbe irányítják a belépő csoportot. A különböző szubsztituensek csoportosítását az alábbi táblázat mutatja be:
| orto- és para-irányítók | meta-irányítók | |
|---|---|---|
| elektrondonorok | elektronakceptorok | elektronakceptorok |
| alkilcsoportok | −Cl | −CHO, −C(O)R |
| −OH, −OR | −Br | −COOH, −COOR |
| −SH, −SR | −I | −CN |
| −NH2 −NHR, −NR2 | −CCl3, −CF3 | |
Az aktiváló csoportok mind orto- vagy para-irányítók, ennek magyarázata az, hogy a szubsztituensek által a gyűrűbe juttatott elektronsűrűség-többlet nem egyenlő mértékben oszlik meg a teljes gyűrűn belül, hanem a 2-es, 4-es és 6-os számú atomon (azaz orto és para pozícióban) koncentrálódik. Emiatt az elektronban szegény elektrofillel ezek a helyek reagálnak a leggyorsabban. A legnagyobb elektronsűrűség a két orto és a para pozícióban jelentkezik, de ezt a fokozott reaktivitást ellensúlyozhatja a szubsztituensek és az elektrofil közötti sztérikus gátlás. Az aromás elektrofil szubsztitúció termékét így nem mindig könnyű előre megmondani, és azt rendszerint úgy állapítják meg, hogy végrehajtják az adott reakciót és meghatározzák az orto és para szubsztituált termékek arányát. A fentiekkel szemben a dezaktiváló csoportok destabilizálják a kationos intermemdiert, és így csökkentik a reakciósebességet. Mindezt azáltal, hogy csökkentik az aromás gyűrű elektronsűrűségét, és ez a hatás is az orto és para pozíciókban jelentkezik leginkább. Ez azt jelenti, hogy a legreakcióképesebb (vagy legkevésbé reakcióképtelen) helyzet a meta pozíció lesz (3-as és 5-ös atom). Dezaktivált aromás gyűrűk például a nitrobenzol, a benzaldehid vagy a trifluormetil-benzol.
A halogének orto/para irányítók, mivel ugyanúgy rendelkeznek nemkötő elektronpárral, mint a nitrogén. Az ezáltal okozott stabilitásnövekedést azonban ellensúlyozza az a tény, hogy a halogének a szénnél jóval elektronegatívabbak, így a pi-rendszer elektronsűrűségét csökkentik. Ez csökkenti a kationos köztitermék stabilitását, így az elektrofil szubsztitúció nehezebben megy végbe. A halogének tehát dezaktiváló csoportok.
Halogénezés[szerkesztés]
A bróm a benzollal először úgynevezett π-komplexet képez, melyben a Br−Br kötés merőleges a benzolgyűrűre. Ez alakul tovább σ-komplexen keresztül brómbenzollá. A reakció nagyon lassú (tíz nagyságrenddel lassabb, mint az etilén brómozása), ezért a brómmolekula heterolízisét elősegítő katalizátorokat, például vas(III)-bromidot alkalmaznak. A benzol klórozásának reakciómechanizmusa ugyanaz, mint a brómozásé. A vas(III)-bromid és -klorid vízzel, vagy akár a levegő nedvességtartalmával érintkezve hatástalanná válik, ezért ezeket úgy állítják elő, hogy vasreszeléket adnak a brómhoz vagy klórhoz. A reakció mechanizmusa az alábbi:
A klór- és brómbenzol reaktivitása kisebb a benzolénál, ezért a benzolt feleslegben alkalmazva elkerülhető a diszubsztituált, vagy poliszubsztituált termékek számottevő mennyiségben való képződése.
A jódozás mechanizmusa némileg eltérő: jódot (I2) oxidálószerrel, például salétromsavval reagáltatnak, így kapják az elektrofil jód kationt (2 I+). A többi halogéntől eltérően a jód nem viselkedik bázisként, mivel pozitív töltésű. Egy tanulmányban jódozó reagensként jód és jódsav keverékét használták.[5]
Egy másik vizsgálatsorozatban jód és tömény kénsavban oldott kálium-jodát keverékéből álló erős reagenst használtak. Ebben az esetben a jódozó ágens a I3+ trijodidion, míg a bázis a HSO4−. A reakció kinetikáját és az erősen deaktivált vegyületek, mint a benzoesav és a 3 -nitrobenzotrifluorid jódozásának preparatív körülményeit vizsgálták.[6][7]
Az aromás vegyületek halogénezése eltér az alkénekétől, melyek nem igényelnek Lewis-sav katalizátort. Az aréniumion keletkezése az aromás jelleg ideiglenes megszűnésével jár, így nagyobb aktiválási energiát igényel, mint az alkének esetén a karbokationok képződése. Más szavakkal az alkének reaktivitása nagyobb, és reakciójukhoz nincs szükség a Br−Br vagy Cl−Cl kötés meggyengítésére.

Nitrálás[szerkesztés]
Az aromás szénhidrogének nitrálása nitrálóeleggyel történik, amely HNO3 és H2SO4 1:2 arányú keveréke. A reakcióban a protonálódott salétromsav disszociációjakor keletkezett nitrilkation az elektrofil.
Ha egyszerűen csak benzollal reagáltatjuk a salétromsavat, akkor a nitrocsoport 1-es helyzetbe fog kerülni, ha pedig izomerével (pl. toluol) reagáltatjuk, akkor a már ott lévő szubsztituens határozza meg azt, hogy a nitrocsoport hová kerül. A reakció során víz is keletkezik:

A keletkezett nitrobenzol sokkal kevésbé reakcióképes, mint a benzol, ezért dinitro- és trinitro-származékok előállítása csak erélyesebb reakciókörülmények között (füstölgő salétromsavval, hevítés mellett) valósulhat meg.
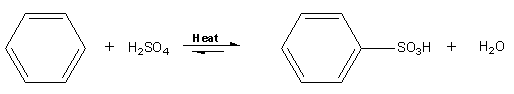
Szulfonálás[szerkesztés]
Az aromás szénhidrogének szulfonálási reakciójában a kén-trioxid az elektrofil részecske, melyet tömény kénsavból (vagy füstölgő kénsavból) melegítéssel állítanak elő. Benzol szubsztrátum esetén a reakció terméke benzolszulfonsav.

Az aromás nitrálással és más aromás elektrofil szubsztitúciós reakciókkal ellentétben ez a reakció megfordítható. Tömény savas oldatban szulfonálás megy végbe, míg forró, híg vizes oldatban deszulfonálás történik. Ez a reverzibilitás hasznos eszköz az aromás rendszer védelmére.
Friedel–Crafts-reakció[szerkesztés]
A Friedel–Crafts-szintézis segítségével az aromás gyűrű valamely hidrogénatomja alkil-, vagy acilcsoporttal helyettesíthető. A reakcióban Lewis-sav típusú katalizátor jelenlétében az aromás szénhidrogén reagál az elektrofil reagenssel. A reakciónak két típusát különböztetjük meg az elektrofil reagens jellege szerint: alkilezés játszódik le, ha alkénből, vagy alkil-halogenidből képződött karbéniumion az elektrofil reagens, illetve acilezés történik, ha savhalogenidek vagy savanhidridek reagálnak. A reakcióban legtöbbször használt katalizátor a vízmentes alumínium-klorid, de használható vas(III)-klorid, cink-klorid, bór-trifluorid, foszforsav vagy kénsav, illetve a legújabb, korszerű technológiáknál vízmentes hidrogén-fluorid is alkalmazható.
Alkilezés[szerkesztés]
Lewis-sav típusú katalizátor jelenlétében az alkil-halogenidek elektrofil szubsztitúciós reakcióba lépnek a benzollal, és új C−C kötés létrejötte közben a benzol alkilezett származékai keletkeznek. Például a benzol metil-kloriddal vízmentes AlCl3 jelenlétében metilbenzolt ad:

A reakció mechanizmusát a következő ábra szemlélteti. A Lewis-sav hatására az alkil-kloridban a szén és a klóratom közti kötés heterolitikusan felszakad (2), majd a képződött karbéniumion (3) elektrofil reakcióba lép a benzolgyűrűvel. Az így keletkező σ-komplex protont ad le, mely az AlCl4-el komplex savat alkot. Ez elbomlik hidrogén-kloridra és AlCl3-ra.

A mechanizmusból következik, hogy például propilcsoport nem vihető be a molekulába. Ugyanis a propil-kloridból elsődlegesen képződő 1-propilkation spontán átrendeződik a stabilabb 2-propilkationná, így a reakció végeredménye izopropil-származék lesz.
Az alkilezés más úton, például alkénekből – kevés alkil-halogenid jelenlétében – potonaddícióval képződő karbéniumionokkal is lehetséges. A reakcióban először az alkil-halogenid alkilezi az aromás vegyületet, majd a reakcióban keletkező HX az AlCl3-dal a H[AlCl3X] erős, komplex savat képzi, mely képes az alként protonálva karbéniumionná alakítani.
Mivel az alkilezés során keletkező alkil-benzol reakcióképessége mindig nagyobb, mint a kiindulási benzolé, ezért a monoalkilezett termék mellett képződnek polialkilezett származékok is. Ezt el lehet kerülni a benzol feleslegben való alkalmazásával. A Friedel–Crafts alkilezés, különösen nagyobb mennyiségű katalizátor jelenlétében reverzibilis folyamat, így az elsődlegesen keletkező termékek átizomerizálódhatnak termodinamikai szempontból stabilabb másodlagos termékekké.
Acilezés[szerkesztés]
Katalizátor jelenlétében a benzol és más aromás szénhidrogének savhalogenidekkel is reagálnak, például acetil-kloriddal:

A reakció savanhidridekkel is végbemegy.
A Ludwig Gattermann és Julius Arnold Koch német kémikusokról elnevezett Gattermann–Koch-szintézis[8] olyan Friedel–Crafts acilezési reakció, melynek során benzolszármazékból szén-monoxid és sósav hatására AlCl3 katalizátor mellett egy lépésben benzaldehidszármazék keletkezik.[9] Benzaldehid és számos más aromás aldehid is kényelmesen előállítható ezzel a reakcióval. Nyomnyi mennyiségű réz(I)-klorid és cink-klorid jelenléte is szükséges a reakció végbemeneteléhez.

A reakcióra példa a toluol p-tolualdehiddé történő átalakítása.[10]
Kondenzált policiklusos aromás szénhidrogének elektrofil szubsztitúciója[szerkesztés]
A kondenzált policiklusos aromás szénhidrogének reakcióképessége a benzol, naftalin, antracén sorrendben növekszik. Ennek oka az, hogy az elektrofil kation addíciójakor keletkező σ-komplexben megszűnik az aromás jelleg azon a gyűrűn, amelyhez az addícionálódott kation csatlakozik, azonban a naftalinban és az antracénban a benzollal ellentétben egyes szénatomok több gyűrűhöz is tartoznak így ezek a szénatomok megőrzik aromás kötésállapotukat. Minél több szénatom őrzi meg az aromás jellegét, annál nagyobb lesz a σ-komplex stabilitása és annál nagyobb lesz a kiindulási szénhidrogén reaktivitása. A naftalin klórozható, brómozható, nitrálható és szulfonálható. Brómozása százezerszer gyorsabb, mint a benzol brómozása, és nem feltétlenül igényel katalizátort. A reakcióban irányító hatás érvényesül, mely abban nyilvánul meg, hogy a kétféle lehetséges izomer közül szinte kizárólag 1-bróm-naftalin képződik, 2-bróm-naftalin csak elenyésző mennyiségben. Ez arra vezethető vissza, hogy az első reakcióúton keletkező σ-komplexben a kétszeres kötés a szomszédos gyűrű megbolygatása nélkül is delokalizálódhat, ezért kisebb az aktiválási gát és nagyobb a reakciósebesség. Szulfonáláskor az arány a hőmérséklettől függ: 1-naftalinszulfonsav 25 °C-on képződik legnagyobb arányban , míg a 2-naftalinszulfonsav 160 °C-on. Az antracén és a fenantrén klórral és brómmal addíciós reakcióba lép. A termék hevítve hidrogén-kloridot, vagy hidrogén-bromidot veszít és szubsztituált származékká alakul át.
Fontosabb aromás szénhidrogének[szerkesztés]
Benzol: A legegyszerűbb aromás szénhidrogén. Vízben nem oldódó jellegzetes szagú, színtelen folyadék. Gyanták és zsírok kitűnő oldószere ezenkívül a jódot, a ként és a foszfort is feloldja. A benzolt kőszénkátrányból állítják elő. Erősen mérgező, rákkeltő hatású vegyület, belélegezve eszméletvesztést, nagyobb mennyiségben halált okoz. A benzolt nagy mennyiségben használja fel a vegyipar oldószerek, gyógyszerek, festékek, robbanóanyagok és növényvédő szerek előállítására.
Toluol: A legegyszerűbb olyan aromás szénhidrogén, melyben a benzolgyűrűhöz egy alkilcsoport kapcsolódik. A benzolhoz hasonló szagú, vízzel nem elegyedő, mérgező, gyúlékony folyadék. Előállítható kőszénkátrányból frakcionált kondenzációval,[11] vagy benzol Friedel-Crafts alkilezésével. Az iparban festékek, lakkok oldószereként alkalmazzák, a trinitro-toluol (TNT) gyártásának egyik alapanyaga. Szerves szintézisek kiindulóanyagaként is hasznosítják.
Xilol: A benzol dimetilszármazékai, háromféle konstitúciós izomerben léteznek. Színtelen, jellegzetes illatú folyadékok. Vízben oldhatatlanok, de korlátlanul elegyednek szerves oldószerekkel, például éterrel és szén-diszulfiddal. A xilolokat elsősorban oldószerként használják, de lakkok, festékek, ragasztók rovarirtószerek készítésekor is alkalmazzák őket.[12]
Sztirol: A sztirol vagy vinilbenzol egy színtelen, kellemes szagú, erősen fénytörő folyadék. Többnyire műanyagok, főként polisztirol gyártására használják
Naftalin: A legegyszerűbb policiklusos aromás szénhidrogén, melyben a két benzolgyűrű kondenzáltan – azaz két szénatomnál csatlakozva – helyezkedik el. Előállítása kőszénkátrány kondenzációjával történik. A naftalint az iparban különféle festékanyagok készítéséhez, a világítógáz karburálásához, a háztartásban pedig különösen a ruhaneműk védelmében a molyok kipusztításához használják
Jegyzetek[szerkesztés]
- ↑ A benzolt elsőként Faraday különítette el 1825-ben, a benzol nevet Liebig javaslatára fogadták el. A ma érvényes IUPAC nómenklatúrával ez a név nincs összhangban, mivel az -ol végződés az alkoholok elnevezésére van fenntartva. A magyar szakirodalomban német hatásra terjedt el. Az angolszász irodalom a vegyületre - tekintettel alkénes jellegű telítetlenségére - a 'benzene' elnevezést használja. Ez az elnevezés (Benzen) ma már a német nyelvterületen is terjed.
- ↑ Furka Árpád. Szerves kémia. Tankönyvkiadó (1988). ISBN 9631812588
- ↑ A naftalin szublimál
- ↑ http://www.chemguide.co.uk/organicprops/arenes/background.html#top
- ↑ Regioselective iodination of hydroxylated aromatic ketones Bhagwan R. Patila, Sudhakar R. Bhusarec, Rajendra P. Pawara, and Yeshwant B. Vibhute b Arkivoc 2006 (i) 104-108. Online Article[halott link]
- ↑ The kinetics of aromatic iodination by means of the tri-iodine cation, J. Arotsky, A. C. Darby and J. B. A. Hamilton, J. Chem. Soc. B, 1968, 739 - 742
- ↑ Iodination and iodo-compounds Part IV, Judah Arotsky, A. Carl Darby and John B. A. Hamilton, J. Chem. Soc., Perkin Trans. 2, 1973, 595 - 599
- ↑ Gattermann, L.; Koch, J. A. (1897). „Eine Synthese aromatischer Aldehyde”. Ber. 30, 1622. o. DOI:10.1002/cber.18970300288.
- ↑ LI Jie Jack. Name Reactions: A Collection of Detailed Reaction Mechanisms (available on Google Books), 2nd, Springer, 157. o. (2003). ISBN 3-540-40203-9
- ↑ G. H. Coleman, David Craig (1943). „p-Tolualdehyde”. Org. Synth.. ; Coll. Vol. 2: 583
- ↑ Bruckner Győző. Szerves kémia, II-1 kötet. Budapest: Tankönyvkiadó (1979). ISBN 963 17 3779 9
- ↑ Xilol (a három izomer keveréke) (BGIA GESTIS)[halott link] (németül)










