Kén-trioxid
| Kén-trioxid | |
 |

|
| Kémiai azonosítók | |
|---|---|
| CAS-szám | 7446-11-9 |
| Kémiai és fizikai tulajdonságok | |
| Kémiai képlet | SO3 |
| Moláris tömeg | 80,06 g/mol |
| Sűrűség | 1,92 g/cm³ (folyadék) |
| Olvadáspont | 16,9 °C, 62,4 °F |
| Forráspont | 45 °C, 113 °F |
| Oldhatóság (vízben) | kénsavvá alakul |
| Kristályszerkezet | |
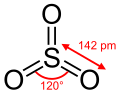
| Molekulaforma | Síkháromszög |
| Termokémia | |
| Std. képződési entalpia ΔfH |
−397,77 kJ/mol |
| Standard moláris entrópia S |
256,77 J.K−1.mol |
| Veszélyek | |
| EU osztályozás | Maró (C)[1] |
| R mondatok | R14, R34[1] |
| S mondatok | S8, S25, S36/37/39, S45[1] |
| Rokon vegyületek | |
| Rokon vegyületek | SO2 H2SO4 SO2Cl2 |
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |
A kén-trioxid (SO3) higroszkópos folyadék, szervetlen vegyület. Szobahőmérsékleten cseppfolyós, kissé lehűtve fehér kristályokat alkot. A kén-trioxid erős roncsoló, maró hatással bír az élő szervezetekre, nagyon mérgező, erőteljes nedvszívó tulajdonságú. Légnemű állapotban jelentős szennyezőanyag, a savas eső fő okozója.[2] A kén egyik oxidja, amelyben egy központi kénatomhoz kapcsolódik 3 oxigénatom. Benne a kén oxidációs száma +6, az oxigénatomoké -2. Ezen kívül a kén-trioxid a kénsav savanhidridje is.
Szerkezete, tulajdonságai[szerkesztés]

Az SO3 képletű oxid szobahőmérsékleten színtelen, folyadék halmazállapotú.[3] Polimerizálódik S3O9 összetételű gyűrű keletkezése közben. Polimerizálódhat lineáris (SO3)n makromolekulákká is. A makromolekuláris szerkezetű kén-trioxid szilárd halmazállapotú, külseje az azbeszthez hasonlít. Mindkét esetben stabilabb, tetraéderes szerkezet alakul ki.[3]
Előállítása[szerkesztés]
Kén-dioxid tovább oxidálásával állítják elő, vanádium-pentoxid jelenlétében:
Keletkezhet piroszulfátok bomlása során is, magas hőmérsékleten:
Laboratóriumban tömény kénsavból állítható elő foszfor-pentoxiddal:[3]
Felhasználása[szerkesztés]
Vízzel kénsavvá egyesül:
A fenti reakció azonban oly heves, hogy együtt kénsavködöt képeznek, ez nehezen cseppfolyósítható. Ezért a kénsavgyártásban a kén-trioxidot tömény kénsavban nyeletik el, ez óleumot (dikénsavat) eredményez, ezt vízzel hígítják, így kapnak kénsavat.
Források[szerkesztés]
- ↑ a b c A kén-trioxid vegyülethez tartozó bejegyzés az IFA GESTIS adatbázisából. A hozzáférés dátuma: 2010. augusztus 23. (JavaScript szükséges) (angolul)
- ↑ (2000) „Toward elimination of descrepancies between theory and experiment: The rate constant of the atmospheric conversion of SO3 to H2SO4”. Proceedings of the National Academy of Sciences of the United States of America 97 (16), 8874–8878. o. DOI:10.1073/pnas.97.16.8874. PMID 10922048.
- ↑ a b c Nyilasi János. Szervetlen kémia. Budapest: Gondolat Kiadó, 175-176 o.. o. (1975)






