Policiklusos aromás szénhidrogének

A policiklusos aromás szénhidrogének (PAH) olyan kémiai vegyületek, amelyek összekapcsolódó (kondenzált) aromás gyűrűkből állnak, és nem tartalmaznak heteroatomot vagy szubsztituenseket.[1][2] A policiklusos aromás szénhidrogének előfordulnak az olaj, kőszén- és a kátrányüledékekben, valamint az üzemanyagok (mind a fosszilis, mind a biomassza eredetűek) égetése során is melléktermékként keletkeznek. Környezetszennyező anyagok, mivel ezen vegyületek egy része bizonyított karcinogén, mutagén és teratogén hatással rendelkezik.
Megtalálhatók a csillagközi térben, üstökösökben és meteoritokban is. A policiklusos aromás szénhidrogének a legegyszerűbb életformák alapjául szolgáló molekulák lehetséges jelöltjei.
Előfordulásuk[szerkesztés]
A policiklusos aromás szénhidrogének lipofilek, ami azt jelenti, hogy könnyebben elegyednek olajjal mint vízzel. A nagyobb molekulájú vegyületek kevésbé vízoldhatóak és kevésbé illékonyak (azaz kevésbé hajlamosak elpárologni). Ezen tulajdonságok miatt a PAH-k elsősorban a talajban, üledékekben és olajos anyagokban fordul elő, nem pedig vízben vagy a levegőben. Mindemellett a levegőben terjedő finomszemcsés anyagoknak is egyik figyelmet érdemlő összetevője.
A természetes kőolaj és kőszén lelőhelyek nagy mennyiségű PAH-t tartalmaznak, melyek a természetes molekulák, például szteroidok aromás szénhidrogénekké történő kémiai átalakulása során keletkeztek. Megtalálhatók a feldolgozott fosszilis tüzelőanyagokban, a kátrányban és különböző étolajokban is.[forrás?]
Kémiájuk[szerkesztés]
A legegyszerűbb PAH-k a IUPAC definíciója szerint (G.P Moss, IUPAC nomenclature for fused-ring systems) a fenantrén és az antracén – mindkét vegyület három kondenzált aromás gyűrűből áll. A kisebb molekulák, mint például a benzol, nem tartoznak a PAH-k közé.
A PAH-k tartalmazhatnak négy-, öt-, hat- vagy hétatomos gyűrűket, de az öt vagy hat atomból állók a leggyakoribbak.
A PAH-k jellemző ultraibolya abszorpciós spektrummal rendelkeznek. A spektrumban általában több abszorpciós sáv is található, melyek jellemzőek az adott gyűrűszerkezetre. Egy adott összegképlethez tartozó izomerek között az egyes izomereknek is a többitől eltérő spektruma van, ami különösen jól használható a PAH-k azonosítására. A legtöbb PAH emellett fluoreszkál is, azaz gerjesztés hatására jellemző hullámhosszú sugárzást bocsát ki. Ezek a spektrumok a kiterjedt π-elektron rendszernek köszönhetők, és ez okozza egyes nagy molekulájú PAH-k félvezető és egyéb tulajdonságait is.
A PAH-k vízoldhatósága hozzávetőlegesen egy nagyságrenddel csökken minden egyes további gyűrű hozzáadásával.
PAH vegyületek[szerkesztés]
| Vegyület neve | Vegyület neve | ||
|---|---|---|---|
| Antracén | Benzo(a)pirén | 
| |
| Krizén | 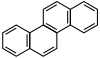 |
Koronén | 
|
| Korannulén | 
|
Naftacén | |
| Naftalin | Pentacén | ||
| Fenantrén | Pirén | 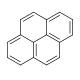
| |
| Trifenilén | 
|
Ovalén | 
|
Aromás jelleg[szerkesztés]
Bár a PAH-k egyértelműen aromás vegyületek, az aromaticitás mértéke eltérhet az egyes gyűrűk esetén. A Clar-szabály szerint (melyet Eric Clar fogalmazott meg 1964-ben) a PAH-k esetén a legtöbb, elkülönült п-szextettet – azaz benzolszerű molekularészt – tartalmazó rezonanciaszerkezet a legjelentősebb a tulajdonságok leírása szempontjából.[3]
Jegyzetek[szerkesztés]
- ↑ Fetzer, J. C.. The Chemistry and Analysis of the Large Polycyclic Aromatic Hydrocarbons. New York: Wiley (2000)
- ↑ A szubsztiuens a szerves kémiában hidrogént helyettesítő atomot vagy atomcsoportot jelent a szénláncon.
- ↑ Assessment of Clar's aromatic -sextet rule by means of PDI, NICS and HOMA indicators of local aromaticity Guillem Portella , Jordi Poater, Miquel Solà J. Phys. Org. Chem. 2005; 18: 785–791 doi:10.1002/poc.938

