Lisztérzékenység
| Lisztérzékenység | |
 | |
| Szinonimák | Cöliákia, gluténszenzitív enteropátia, nem trópusi sprue |
| Angolul | Coeliac disease, celiac sprue |
| Osztályozás | |
| BNO-10 | K90.0 |
| BNO-9 | 579.0 |
| Főbb tünetek |
|
| Adatbázisok | |
| OMIM | 212750 |
| DiseasesDB | 2922 |
| MedlinePlus | 000233 |
| eMedicine | med/308 |
| MeSH ID | D002446 |
A Wikimédia Commons tartalmaz Lisztérzékenység témájú médiaállományokat. | |
A lisztérzékenység (más néven cöliákia, gluténszenzitív enteropátia vagy nem trópusi sprue) egy, elsősorban a vékonybelet érintő autoimmun betegség, amely nem gyógyítható, de diétával jól kezelhető.[1][2] A lisztérzékenység név némiképp félrevezető, mert az érzékenységet okozó anyag, a glutén nem kizárólag a búzalisztben fordul elő. Továbbá a beteg nem minden lisztre érzékeny; és az érintett gabonákat más formákban sem fogyaszthatja. A kórkép továbbá nem tévesztendő össze a búzával szembeni allergiával, mely a búzafehérjékre adott akut reakció, ami súlyos esetben anafilaxiához vezethet.[3]
A cöliákiát az egyes prolamin fehérjékkel szembeni immunológiai intolerancia okozza az arra genetikailag hajlamos egyénekben.[4] Ezek közé tartozik a búzában található gliadin, a rozsban előforduló szekalin, vagy az árpában jelen lévő hordein, amelyek a glutén alkotóelemei. Ezek a fehérjék ellenállnak az emésztőenzimeknek,[5] majd a bélbe jutva a szöveti transzglutamináz enzim módosítja őket és az immunrendszer aktiválásán keresztül helyi gyulladásos reakciót okoznak, ami hosszú távon a bélnyálkahártya károsodásához, a bélbolyhok eltűnéséhez vezet, ezáltal csökken a felszíváshoz rendelkezésre álló nyálkahártya felület.[6] A tápanyagok, vitaminok, ásványi anyagok felszívódása zavart szenved, és hiánybetegségek alakulnak ki.[7]
Elsősorban a vékonybél kezdeti szakasza sérül, de lehet az elváltozás kiterjedtebb is. A jellemző tünetek közé különböző emésztőszervi panaszok tartoznak, pl. hasmenés, vagy épp székrekedés, puffadás. Felnőttekben a testsúly csökkenése, míg gyermekkorban a súlygyarapodás elmaradása is felhívhatja a figyelmet a kórképre. A betegség ezek mellett egyéb általános tünetekkel is járhat (pl. fáradékonyság, rossz közérzet stb.), de lehet teljesen tünetmentes is.[6] Kezeletlen betegség esetén fokozódik a vékonybélben előforduló rosszindulatú tumorok kockázata is.[8]
A lisztérzékenység jelenleg nem gyógyítható, az egyedüli hatásos kezelés az életen át tartó gluténmentes diéta, mellyel a beteg tünetmentessé tehető, illetve az idejében kezdett diétával jelentősen csökkenthető a kórképpel járó egyéb szövődmények kockázata is (pl. meddőség, tumorok).[9][10]
A lisztérzékenység előfordulása az egyes földrajzi régiókban jelentős különbségeket mutat, becslések szerint a világ népességének kb. egy százalékát érinti.[11] Világnapja május harmadik vasárnapja (2015-ben május 17-re, 2016-ban május 15-re esett, 2017-ben május 21-én volt.).
Tünetei[szerkesztés]

A lisztérzékenység a bélben zajló kóros immunreakció miatt leggyakrabban emésztőrendszeri panaszokkal jár, azonban a betegség tünetei nem specifikusak, más kórállapotokban is előfordulnak. Gyakori tünet a zsírszékelés (steatorrhoea) és az étkezéseket követő puffadás, hasmenés vagy székrekedés, esetleg alhasi diszkomfort vagy fájdalom. A felszívódási zavarok miatt mindez fogyással társulhat, illetve gyermekkori betegség esetén nem kellő mértékű a gyermek súlyfejlődése. Enyhébb formában a betegség esetleg csak általános panaszokkal járhat, vagy csak a tartósan fennálló vérszegénység (anaemia) utal a jelenlétére. A felnőttkori lisztérzékeny betegek 50 százaléka elsősorban nem emésztőszervi panaszokkal jelentkezik az orvosánál, ami a bélen kívüli (extraintestinális) tünetek jelentőségére hívja fel a figyelmet.[12]
A 2011-es oslói Cöliákia Szimpóziumon a jelentkező tünetek alapján egységesítették a nevezéktant, így a korábban is jellemzett emésztőszervi panaszokkal és felszívódási zavarokkal járó ún. klasszikus cöliákia mellett megkülönböztetnek nem-klasszikus, szubklinikai, tünetmentes (aszimptomatikus) és refrakter betegségformákat is.[13]
A szűrővizsgálatok elterjedésével egyre több teljesen tünetmentes eset is felismerésre kerül. A gyermekkori forma egyéves kor körül kezdődik a liszttartalmú élelmiszerek bevezetésével. A gyermekek hasi fájdalomról panaszkodnak, szomorú arckifejezésűek, a fejlődésben visszamaradnak, a nemi érés késik. A felnőttkori esetek sokáig felfedezetlenek maradnak, hiszen nem járnak ilyen tipikus tünetekkel, és hirtelen rendkívüli elváltozásokkal. Nőknél a betegség meddőség, menstruációs zavarok, gyakori vetélés, halva szülés, magzati fejlődés rendellenességek formájában is jelentkezhet.[14][15]
A glutén iránti érzékenység és a tünetek erőssége egyénenként változó. Van, aki a legkisebb gluténnyomokra is erős tünetekkel reagál, míg más csak nagy mennyiségű gluténtartalmú élelmiszerre reagál hasfájással és székrekedéssel.
| A cöliákia formáival kapcsolatos főbb elnevezések a 2011-es oslói Cöliákia Szimpózium alapján:[13] | |
|---|---|
| Definíciók | Jellemzők |
| Klasszikus cöliákia | Felszívódási zavarral (malabszorpció) jelentkező betegség. Hasmenés, zsírszéklet, fogyás, vagy gyermekeknél a súlygyarapodás elmaradása a kritériuma. |
| Nem-klasszikus cöliákia | Malabszorpcióval nem járó betegség. Jellemzően egyéb tünettel (pl. hasi fájdalom, székrekedés) jelentkezik. |
| Szubklinikai cöliákia | Klinikailag nem kimutatható betegség. (Pl. a beteg panasz-, és/vagy tünetmentes, így nem kerül cöliákia irányába kivizsgálásra) |
| Refrakter cöliákia | 12 hónapnyi szigorú gluténmentes diéta ellenére fennálló vagy visszatérő malabszorpcióval és vékonybélatrófiával járó forma. |
| Potenciális cöliákia | A beteg tünet-, és panaszmentes, szövettanilag normális a bélnyálkahártya, azonban a szerológiai tesztek pozitív eredményt adnak. |
| Cöliákia: krónikus, immun-mediált vékonybélkárosodás, melyet az étkezéssel bevitt glutén vált ki az arra genetikailag hajlamos egyénekben. | |
A cöliákián és búzaallergián túl létezik az ún. nem-cöliákiás gluténérzékenység (NCGS, Non-Celiac Gluten Sensitivity). Az autoimmun cöliákiához hasonló (de enyhébb) tünetek jelentkeznek. Egyelőre ismeretlen, hogy mi váltja ki.
Emésztőszervi tünetek[szerkesztés]
A lisztérzékenység klasszikusan hasmenéssel, puffadással és zsírszékeléssel jár; a széklet ilyenkor fényes, fakó, nagyobb tömegű és a szokásosnál bűzösebb. A bélnyálkahártya sérülése miatt gyakran társul a betegséghez laktóz intolerancia, mivel csökken a bélben a tejcukrot bontó laktáz enzim mennyisége. Hasmenés helyett székrekedéssel is járhat a betegség, illetve társulhatnak hozzá egyéb emésztőszervi tünetek is, a betegek egy részében pl. visszatérő, fájdalmas szájnyálkahártya fekélyek, afták jelentkeznek.[16] A bizonytalan hasi panaszok miatt eleinte gyakran irritábilisbél-szindróma (IBS) merül fel és csak a későbbi vizsgálatok igazolják a cöliákiát.[17] Súlyosabb esetben a vékonybélben is kifekélyesedő gyulladás (ulceratív jejunitis) jelentkezhet, illetve hosszú távon a hegesedés miatt bélszűkületek alakulhatnak ki, ezek a komplikációk elsősorban a betegség diétára nem reagáló, ún. refrakter formájában fordulnak elő.[18]
A lisztérzékenység növeli az egyébként ritkának számító vékonybél daganatok kialakulásának valószínűségét.[8] A vékonybél adenokarcinóma mellett leginkább különböző non-Hodgkin limfómák alakulhatnak ki (pl. enteropátia-asszociált T-sejtes limfóma, EATL) a bélben található limfociták tartós stimulációja következtében.[19] Limfómák gyakrabban jelentkeznek azokban a betegekben, akiknél csak idősebb életkorban diagnosztizálják a betegséget.[8] A vékonybél mellett ritkábban a vastagbélben, a gyomorban, vagy a nyelőcsőben is kialakulhatnak rosszindulatú daganatok.[20]
Hiánytünetek[szerkesztés]
A vékonybél-nyálkahártya károsodása miatt a betegség felszívódási zavarokkal (malabszorpció) járhat. A különböző tápanyagok, vitaminok, ásványi anyagok malabszorpciója más-más hiányállapotokhoz vezethetnek. A szénhidrátok és a zsírsavak csökkent felszívása miatt energiahiány alakul ki a szervezetben, a beteg testsúlya csökken, illetve tartósan alultáplált marad és fáradékonyság lép fel. A cöliákiában meglehetősen gyakori vérszegénység (anémia) többféleképpen is kialakulhat a betegben, így okozhatja vashiány a táplálékkal bevitt vas nem megfelelő felszívódása miatt, de állhat mögötte folsav vagy B12-vitamin hiány is, utóbbiak esetén megaloblasztos anémia alakul ki, vagyis a vörösvérsejtek száma csökkent, de a méretük a normálisnál nagyobb.[21] Hosszútávon a betegség a kalcium és a D-vitamin csökkent felszívása miatt csontfájdalmakat okozhat, csökkenhet a csontok ásványi anyag tartalma (osteopenia) és csontritkulás is jelentkezhet, ezáltal megnő a kóros csonttörések kockázata.[22][23] Az A-vitamin hiánya miatt megnő a fertőzésekre való hajlam, a K-vitamin hiánya pedig vérzékenységgel járhat.
Extraintesztinális tünetek[szerkesztés]
A betegség sokszor nem is elsődlegesen emésztőszervi tünettel jelentkezik, hanem a felszívódási zavar következtében kialakuló valamilyen hiánybetegségként, utóbbiak egymással kombinálódhatnak is.[24] Ezek változatos tüneteket okozhatnak (pl. általános rossz közérzet, fáradékonyság, fejfájás, pszichés problémák, hajhullás stb.). A lisztérzékeny betegekben az átlagnépességhez képest jelentősen gyakrabban alakulnak ki egyéb autoimmun betegségek is.[2][25]
Társuló betegségek[szerkesztés]
A lisztérzékenység sokszor egyéb betegségekkel együttesen fordul elő, ezek többsége szintén autoimmun természetű. Ismeretük több szempontból is fontos; egyrészt lehetséges, hogy ezek hívják fel a figyelmet az addig nem diagnosztizált lisztérzékenységre, másrészt ezek további kellemetlenségeket, panaszokat és szövődményeket okozhatnak, harmadrészt pedig a gluténmentes diéta jótékonyan hathat a lisztérzékenységhez társuló kórképekre is.[2]
1-es típusú cukorbetegség[szerkesztés]
Az 1-es típusú cukorbetegség (IDDM, vagy T1DM) és a lisztérzékenység kapcsolata régóta jól ismert. Rendszerint a cukorbetegség jelentkezik előbb és később társul hozzá a cöliákia. Az IDDM-ben szenvedő betegek kb. 8 százalékában fordul elő lisztérzékenység,[26] ennek valószínűsége nagyobb, ha a cukorbetegség korán (<4 éves kor előtt) alakul ki.[27] A kapcsolat fordítva is igaz, a gyermekkorban felismert cöliákia esetén 20 éves korig fokozott az IDDM kockázata.[25] Mivel az IDDM-hez társuló cöliákia sokszor tünetszegény, ezért az IDDM diagnózisával egy időben ajánlott a betegek szűrése cöliákiára, amelyre az autoantitestek kimutatása alkalmas, elsősorban a szöveti transzglutamináz (tTG) és az endomízium elleni IgA, valamint a deamidált gliadin peptid (DGP) elleni IgA és IgG meghatározása.[26]
A két betegség közös hajlamosító génekkel rendelkezik, nevezetesen az antigén bemutatásban fontos MHC II molekulákat kódoló HLA-DQ2 és DQ8 génváltozatok mindkét betegségben gyakoriak, a HLA-DQ2 a lisztérzékeny betegek 95, míg az IDDM-ben szenvedő egyének 55 százalékában jelen van, ugyanez a HLA-DQ8 vonatkozásában 10 és 70 százalék.[26] A HLA-DQ2-re homozigóta cukorbetegek 33 százalékában kimutathatóak tTG elleni antitestek, ez az arány a DQ2 és DQ8 negatív cukorbetegek körében mindössze két százalék.[26] A HLA gének mellett egyéb, nem-HLA génváltozatok is közös hajlamosító tényezői a két betegségnek.[28]
A cukorbetegségre rakódó lisztérzékenység további nehézségeket jelent a betegnek, hiszen a két kórkép együttes előfordulása esetén lényegesen szűkül az általa fogyasztható élelmiszerek köre, ami jelentősen rontja az életminőséget.[29]
Autoimmun pajzsmirigy betegségek[szerkesztés]
Az autoimmun pajzsmirigybetegségekben (pl. Graves-Basedow-kór és Hashimoto-thyreoiditis) szenvedő betegek kb. 2-7 százalékában jelenik meg cöliákia, míg a primeren lisztérzékenységgel diagnosztizált betegek kb. negyedében mutathatók ki pajzsmirigyellenes autoantitestek és kb. 10 százalékukban zavart is a pajzsmirigy működése.[25] Ellentmondásos az irodalom a tekintetben, hogy a gluténmentes diétával megelőzhetők vagy enyhíthetők-e a társuló pajzsmirigy betegségek, ugyanakkor a diéta jótékonyan hat a pajzsmirigyzavarokra adott gyógyszerek felszívódására.[30]
Dermatitis herpetiformis[szerkesztés]

A dermatitis herpetiformisra (DH) a bőrön csoportosan, sokszor visszatérő jelleggel jelentkező apró kiütések és hólyagok jellemzőek, amelyek erősen viszketnek, illetve égnek.[31] A betegség a lisztérzékeny egyének kb. negyedében fordul elő az életük folyamán, azonban a DH-s betegek 70 százalékában kimutatható a lisztérzékenységre jellemző bélboholy sorvadás, míg további 25 százalékukban csak a hámban található limfociták száma magas.[32] Ezek miatt a DH voltaképp a cöliákiát jelző állapotként fogható fel. Bár a glutén érzékenység minden DH-s betegben jelen van, klinikailag csak kb. a negyedükben jár ez malabszorpcióval.[33] Megjelenhet gyermekben és felnőttben egyaránt. A herpeszre hasonlító, viszkető elváltozások leggyakrabban szimmetrikusan, a két könyökön, a térdeken, vagy a vállakon jelentkeznek, de a test bármely pontján megjelenhetnek. Bőrbiopsziából végzett direkt immunfluoreszcens mikroszkópos vizsgálattal a betegségre a bőrben granulárisan látható IgA lerakódás jellemző. A gluténmentes diétával az állapot jól kezelhető, illetve megelőzhető. A betegség gyógyszeres kezelésére átmenetileg dapszon is adható.[34]
Májbetegségek[szerkesztés]
A lisztérzékenység többféle máj és epeúti betegséggel járhat együtt. Gyakoriak az emelkedett májenzimértékek, ezek közül a leggyakoribb, a kezeletlen cöliákiás betegek mintegy felében kimutatható hipertranszaminázémia (emelkedett transzamináz enzim szintek), mely utóbbi szövettanilag májgyulladással (hepatitis) jár együtt, ami azonban diétával visszafordítható.[35] Enyhén emelkedett aszpartát-aminotranszferáz (AST vagy GOT) és alanin-aminotranszferáz (ALT vagy GPT) értékeken kívül általában nincs lényeges eltérés, a beteg esetleg fáradékonyságra panaszkodhat, vagy teljesen tünetmentes lehet. Sárgaság, aszcitesz, vagy lépmegnagyobbodás már jellemzően előrehaladott májbetegség esetén észlelhető. A kezeletlen cöliákiás betegeknek az átlagnépességhez képest jóval nagyobb kockázatuk van későbbi májkárosodás és májzsugor kialakulására. A leírtak miatt egyrészt a frissen diagnosztizált lisztérzékeny betegnél javasolják a májfunkciók ellenőrzését, másrészt ismeretlen eredetű májbetegség vagy májzsugor hátterében állhat addig fel nem ismert lisztérzékenység is.[35] Szövettanilag a cöliákiára jellemző májgyulladás nem specifikus.
A cöliákiás hepatitisz mellett ritkábban autoimmun májbetegségek is társulhatnak a lisztérzékenységhez. A cöliákiás betegek kb. 3 százalékában primer biliáris cirrózis (PBC), míg kevesebb mint 2 százalékukban autoimmun hepatitisz alakul ki.[25]
Egyéb[szerkesztés]
A korábban említetteken kívül ritkán egyéb betegségek is együtt járhatnak a cöliákiával. Autoimmun kórképek közül a Sjögren-szindrómában, az Addison-kórban és a juvenilis idiopátiás artritiszben (JIA) szenvedőkben gyakoribb a lisztérzékenység az átlagnépességhez képest.[25] Neurológiai betegségek a lisztérzékeny betegek kb. 10 százalékában fordulnak elő, és meglehetősen változatos tünetekkel járhatnak, jelentkezhet többek között migrén, mononeuritis multiplex, vagy glutén ataxia (GA) is.[36] A betegek egy részében IgA-deficiencia van jelen, ami a csökkent IgA ellenanyag szintek miatt megnehezíti a betegség diagnózisát, mivel a laboratóriumi vizsgálatokkal kimutatott kóros autoantitestek többsége is IgA izotípusú.[37] Társulhat különböző veleszületett fejlődési rendellenességekkel és betegségekkel is,[38] pl. Down-szindrómával[39] vagy Turner-szindrómával.[40] Ritkán szívizombántalmak (pl. dilatatív kardiomiopátia) is kialakulhatnak.[41]
Okai[szerkesztés]

A betegséget a Triticeae nemzetségcsoportba tartozó gabonafélékben előforduló glutén váltja ki az arra veleszületett genetikai hajlammal rendelkező egyénekben.[4][42] Bár kétségkívül a táplálékkal bevitt glutén a fő kiváltó inger (ún. trigger hatás), számos egyéb környezeti tényező is szerepet játszhat a betegség kialakulásában, így felmerültek különböző vírus és baktérium fertőzések, illetve összefüggést találtak a korán befejezett szoptatás és a lisztérzékenység között is.[43] A genetikai meghatározottság jelentős, a betegek több mint 95 százalékánál megtalálható a HLA DQ2 és a DQ8 humán leukocita antigének (HLA) kombinációja.[4] Az említett HLA típusok, bár hajlamosítanak a betegségre, önmagukban nem elegendők annak kialakulásához, amit mi sem bizonyít jobban, minthogy a kaukázusi emberrasszban kb. 30 százalékra tehető a HLA-DQ2 gyakorisága és búzát a döntő többségük fogyaszt, ugyanakkor a betegség előfordulása csak 1:100 fő,[44] vagyis számos egyéb genetikai és környezeti hatás is fontos a betegség kialakulása szempontjából.
Prolaminok[szerkesztés]
A lisztérzékenységet a táplálékkal bevitt glutén váltja ki, amelynek pontos összetétele a gabonafajtától függ.[45] A glutén glutelinből és különböző prolamin típusú fehérjékből álló komplex, mely a Triticeae nemzetségcsoportba tartozó gabonafélék (pl. búza, árpa, rozs, zab) magjaiban található raktározó fehérje. Az immunreakciót a glutén prolamin komponensei váltják ki, ezek közé tartozik a búzában jelen lévő gliadin, az árpában található hordein, a rozsban előforduló szekalin, vagy a zabban található avenin. (Utóbbi a betegek döntő többségében nem vált ki reakciót.) A prolaminok nevüket a magas prolin és glutamin tartalmukról kapták, amely ellenállóvá teszi őket a különböző emésztőenzimekkel szemben és a bélnyálkahártyában is megtalálható szöveti transzglutamináz (tTG) enzim számára szubsztrátot jelentenek. Ez az enzim jellemzően deamidációt végez rajtuk, megváltoztatva ezzel a szerkezetüket.[46]
Korábbi vizsgálatok szerint a betegség rizikója szempontjából nem közömbös, hogy a gyermek hány hetes korban kerül először kapcsolatba gluténnel. A túl korai (3 hónapos kor alatt) vagy túl késői expozíciót (6 hónapos kor felett) egyaránt hátrányosnak találták,[47] azonban ezt nem minden tanulmány támasztotta alá.[48]
A betegséget kiváltó anyagok a glutén különböző alkotórészei. Pontos összetételük a gabonafajtól függ.
- Búza: α-/β/ω-gliadin
- Árpa: hordein
- Zab: A-, E- és F-avenin
- Rozs: szekalin
Genetika[szerkesztés]

A lisztérzékenység erős genetikai meghatározottsággal rendelkezik. Egyrészt egypetéjű ikrekben magas konkordanciát (kb. 70-80%) mutat,[49] másrészt a lisztérzékeny betegek elsőfokú rokonaiban (szülő, testvér, gyermek) is magas az előfordulása. Egy 2009-es tanulmányban például a lisztérzékeny betegek lánytestvéreiben 17,6, fiútestvéreiben 10,8, míg szüleikben 3,4 százalék volt a betegség prevalenciája.[50]
A legfőbb hajlamosító tényező az immunrendszer antigén-bemutatásában alapvető szerepet játszó MHC (angolul: Major Histocompatibility Complex) molekulákat kódoló HLA (Humán Leukocita Antigén) gének bizonyos génváltozatai, nevezetesen a HLA-DQ2 és a HLA-DQ8, melyek közül legalább az egyik a lisztérzékeny betegek kb. 98 százalékában jelen van.[50] Az immunrendszer antigén-bemutató sejtjeinek (angolul: APC, antigen presenting cell) felszínén helyet foglaló MHC II molekulák mutatják be a különböző antigéneket a CD4 pozitív helper T-limfocitáknak (Th-sejt).[51] Az MHC II molekulának több típusa létezik (HLA-DQ, DR és DP), amelyek mind megtalálhatóak a különböző antigénbemutató sejteken. Maga az MHC II egy alfa és egy béta fehérjeláncból álló ún. heterodimer, melynek láncait emberben a 6-os kromoszómán található HLA gének kódolják.[52] A lisztérzékenységgel ezek közül a HLA-DQ2 és a DQ8 mutat erős összefüggést. A HLA-DQA1 lókuszon található meg a HLA-DQ alfa láncát kódoló szakasz, míg a HLA-DQB1 a DQ típusú MHC béta láncát kódolja. Ezekből a különböző emberekben eltérő változatok fordulnak elő, és mivel a génkifejeződés kodomináns, egy adott emberben átíródik mind az anyai, mind apai kromoszómán helyet foglaló gén, vagyis egyetlen emberben 2-féle alfa és 2-féle béta lánc fejeződik ki, amik egymással kombinálódva összesen 4-féle DQ izoformát hozhatnak létre. HLA-DQ2 típusú MHC molekulát a béta láncot kódoló HLA-DQB1*0201 és DQB1*0202 allélok eredményeznek, az alfa lánc típusától függően további altípusai lehetnek (pl. DQ2.2, DQ2.3, DQ2.5). A HLA-DQ2 típusú MHC molekuláról bizonyított, hogy a többi formához képest erősebben képes megkötni a gliadint, és valószínűsíthetően ez vezet a kóros autoimmunitás kialakulásához.[53]
A legszorosabb összefüggést a HLA-DQ2.5 haplotípus vonatkozásában írták le, amely a lisztérzékeny betegek kb. 90-95 százalékában jelen van. Ez a már említett HLA-DQB1*0201 féle MHC II béta láncból és a HLA-DQA1*0501 típusú alfa láncból álló MHC II molekulát hoz létre. Az európai lisztérzékeny betegek 6 százalékában nem mutatható ki a DQ2.5 vagy a DQ8, de 4 százalékukban a DQ2.2 izoforma jelen van, míg mindössze 2 százalékukban nincs egyáltalán DQ2 vagy DQ8,[54] így ezen két típus együttes hiánya nagyon valószínűtlenné teszi a lisztérzékenység kialakulását.[55] A különböző HLA formák gyakorisága jelentős földrajzbeli különbségeket mutat.
A HLA-k mellett egyéb, nem-HLA lókuszokat is összefüggésbe hoztak a betegséggel, melyek közül többet már korábban más autoimmun betegségekkel is társítottak.[56][57] Ezek közül kiemelhető 2-es kromoszóma hosszú karjának egy meghatározott régiója (2q33), mivel ezen a helyen az immunrendszer szabályozásában fontos szerepet játszó molekulák (pl. CTLA-4, CD28) kódolódnak.[58]
Egyéb környezeti hatások[szerkesztés]
A gluténen kívül más környezeti hatások is befolyásolják a betegség kialakulását. Viszonylag sokat vizsgált a cöliákia gyakorisága és a szoptatás időtartama közötti összefüggés, a hosszabb, a glutén tartalmú táplálékok hozzászoktatásával párhuzamosan végzett anyatejes táplálás csökkenti annak valószínűségét, hogy a gyermekben később lisztérzékenység alakuljon ki.[43][59] Általánosságként elmondható, hogy a rendelkezésre álló adatok alapján a glutén tartalmú táplálékokhoz 4 és 7 hónapos kor között célszerű hozzászoktatni a csecsemőt anyatejes táplálással kiegészítve.[60]
Minthogy sok autoimmun betegséget összefüggésbe hoznak fertőzésekkel, lisztérzékenységben is intenzíven vizsgálják a különböző kórokozók szerepét. Vírusok közül említhető például az adenovírus,[61] a rotavírus,[62] vagy a hepatitisz C vírus,[63] amelyekről lehetségesnek tartják, hogy a genetikai hajlammal született egyénekben megkönnyítik a betegség kialakulását. A vírusok mellett egyéb kórokozók szerepe is felmerült (pl. Campylobacter jejuni).[64]
Az említetteken kívül lehetséges kiváltójának tartják még a stresszt, a gyomor-bél műtéteket, vagy a terhességet,[4] és meglepő módon egyes tanulmányokban lehetséges védő szerepet tulajdonítanak a dohányzásnak,[65] azonban e tekintetben nem egységes a szakirodalom.[66]
Előfordulása[szerkesztés]
A lisztérzékenység gyakorisága országonként nagy mértékben változó. A gyakoriságok aszerint is különböznek, hogy a betegséget a klinikai tünetek, vagy szérumvizsgálat alapján, szűrővizsgálattal állapítják-e meg.[15]
A szimptomatikus eseteket tekintve Dániában és az Amerikai Egyesült Államokban gyakorisága 1:10 000, míg Svédországban és Nagy-Britanniában ez az arány 1:300. A világátlag 1:3350. Szűrővizsgálattal ez az arány Németországban és Dániában 1:500, az Amerikai Egyesült Államokban és Nagy-Britanniában 1:110, világátlagban 1:270.[15] Európában az előfordulási gyakoriság 1:75.[67]
A Svédországban Észak-Dániával szemben megnövekedett esetszám a svédeknél megszokott korai hozzátáplálásra vezethető vissza.[15] A túl korai hozzátáplálás növeli a lisztérzékenységre való hajlamot.[68] A Down-szindrómásoknál szintén nagyobb a lisztérzékenység kockázata. A betegség kialakulásában különösen két korcsoport érintett: a csecsemők és a negyedik évtizedben levők. A nők között gyakoribb, mint a férfiaknál.
Patofiziológia[szerkesztés]

A betegség patogenezise minden részletében nem ismert. A glutén alkoholban oldódó frakcióját alkotó prolaminok váltják ki a bélnyálkahártya károsodását. Ezek az oligopeptidek (50-100 aminosavból álló anyagok) különösen sok prolint és glutamint tartalmaznak és a lisztérzékenyekben bonyolult kölcsönhatásba lépnek a bél nyálkahártyájával és az immunrendszerrel, azonban nem az összes prolamin fehérje okoz intoleranciát. A legjobban az alfa- és a gamma-gliadinok szerepe ismert a betegség patogenezisében.[69] A táplálékkal bevitt glutén a bélnyálkahártyában kölcsönhatásba lép az ott található szöveti transzglutamináz (tTG) enzimmel. Ez az enzim deamidációt végez a gliadin és más prolaminok glutamin oldalláncain, kisebb, már deamidált gliadin peptid szakaszok képződnek (pl. a 33 aminosav hosszúságú 33mer, mely az alfa-2 gliadinból keletkezik, annak 56-88 közötti aminosav szekvenciáját tartalmazza). A deamidált gliadin peptidet (DGP) nagy erősséggel képesek megkötni a HLA-DQ2 típusú MHC II molekulák és mint antigén bemutatásra kerül a bélben található helper T-sejtek számára, ami azok aktivációját idézi elő,[70] ezzel beindítja a különböző gyulladáskeltő anyagok termelését (pl. interferon-γ, TNF-α, interleukin-6 és interleukin-2). A bélben ezt követően egy Th1 túlsúlyú immunválasz jön létre. Emellett a módosított, toxikus gliadin peptid aktiválja a veleszületett immunrendszert is, amire a bélnyálkahártya hámsejtjei és a lamina propriában található dendritikus sejtek IL-15 termelése jellemző.[71] A termelődő interleukin-15 (IL-15) Th1 irányba tolja el a helyi immunválaszt.[72] AZ IL-15 és IL-21 szerepét központi jelentőségűnek tartják cöliákiában, az IL-15 amellett, hogy fokozott IFNγ termeléshez és ezáltal helyi citotoxikus reakciókhoz vezet, csökkenti az immunrendszer negatív szabályozásában fontos citokinek (pl. TGFβ) termelését, az IL-21 pedig csökkenti az immunválaszt szabályozó regulatórikus T-sejtek funkcióját is.[73] Az adaptív immunrendszer aktivációjának egyik következménye továbbá a kóros, saját struktúrákat felismerő ellenanyagok termelése, pl. a szöveti transzglutamináz ellenes autoantitestek megjelenése.[74] A bélhámsejtek pusztulásában fontos szerep jut a citotoxikus T-sejteknek, amelyek aktiválódása a hámsejtek elleni citotoxikus reakcióhoz, következetesen a bélbolyhok sorvadásához (atrófia) vezet. A citotoxikus T-sejtek a hámsejtekben a FAS/FAS ligand kölcsönhatáson keresztül apoptózist váltanak ki, illetve egyéb mechanizmusokkal, pl. az IL-15 indukálta granzim és perforin termeléssel,[75] vagy az NKG2D-MICA jelátviteli úton keresztül pusztítják a hámsejteket.[76] Mindezen folyamatok tehát helyi gyulladáshoz vezetnek, a bélnyálkahártyába limfociták vándorolnak, majd idővel elsorvadnak a bélbolyhok, a bélfelszín ellapul, ezzel jelentősen csökken a tápanyagok felszívására rendelkezésre álló bélfelület.
A gliadin és a bél áteresztőképessége[szerkesztés]
A glutén részét képező gliadin bizonyos részei az enzimatikus deamidációt követően számos direkt káros hatással rendelkeznek. Egyrészt a gliadin képes fokozni a bélfal permeabilitását, például a hámsejtek között található kapcsolatok (angolul: tight junction) meglazításán keresztül, aminek következtében nagyobb peptidszakaszok is átjutnak a hámon és beléphetnek a vérkeringésbe. Eddigi vizsgálatok alapján ebben a folyamatban a bélhámsejtek luminális felszínén található kemokin receptorok (pl. CXCR3) játszanak fontos szerepet, melyek képesek a gliadint megkötni, aminek hatására fokozódik a zonulinok felszabadulása és a bélfal áteresztőképessége.[77] Ezt követően már nem csak a hámsejteken keresztül, szabályozottan, hanem a sejtek között, paracellulárisan is bejutnak peptidek a nyálkahártya mélyebb rétegeibe, ahol kapcsolatba kerülnek az immunrendszerrel.
A gliadin a hámsejteken keresztül, transzcellulárisan is átjuthat a bél hámrétegén, ennek egyik ismert mechanizmusa a szekretoros IgA visszafelé zajló transzportján keresztül valósul meg. A gliadin ellenes IgA molekula megköti a gliadint, majd a hámsejtek luminális felszínén található transzferrin receptorhoz (CD71) kötődik. Ezt követően a sejt felveszi a citoplazmájába, a komplex átkerül a bazális oldalra és kijut a sejtből. Ezzel a folyamattal a gliadin molekula a bontó enzimektől védetten jut be a nyálkahártya lamina propria rétegébe, ahol aztán kiválthatja a fent leírt immunreakciót.[78]
A szöveti transzglutamináz szerepe[szerkesztés]

A lisztérzékeny betegek döntő többségében autoantitestek termelődnek a szöveti transzglutamináz (tTG) ellen.[79] A szöveti transzglutamináz a bélnyálkahártyában található enzim, amelyről ismert, hogy képes módosítani a prolaminokat. Ez az enzimatikus módosítás alapvetően kétféle lehet, deamidációt vagy transzamidációt végezhet rajtuk.[80] A deamidáció során a gliadin egyik glutamin oldalláncából glutamát képződik, míg a transzamidációnál a gliadin egyik glutamin oldallánca kovalensen kapcsolódik az enzim valamelyik lizin láncához, ami egy tartós, gliadin-tTG fehérje komplex kialakulását eredményezi.[81] Az így létrejövő komplex által feltehetően új, az immunrendszer számára addig ismeretlen epitópok jönnek létre, melyeket a perifériára kikerülő limfociták idegennek ismernek fel, ami a tTG ellenes autoantitestek termeléséhez vezet.[82]
A tTG nem csak autoantigénként szolgál, hanem a gliadin deamidációja révén alapvető szerepet játszik a betegség patogenezisében. A deamidált gliadin peptid ugyanis erős affinitást mutat a HLA-DQ2 és DQ8 típusú MHC II molekulákhoz, vagyis voltaképp az enzim alakítja át az immunrendszert hatékonyan aktiválni képes formává.[83]
Diagnosztika[szerkesztés]
A betegség diagnózisa a különböző laboratóriumi vizsgálatokon, elsősorban a betegségre jellemző autoantitestek kimutatásán, a vékonybél endoszkópos, illetve szövettani vizsgálatán alapul. A diagnózis felállításának gyorsasága sokban függ a beteg tüneteitől, amennyiben a beteg a klasszikus lisztérzékenység tüneteivel, vagy más, a betegség gyanúját erősen felvető panasszal érkezik, úgy rendszerint hamar felmerül a cöliákia, amelyre célirányosan kivizsgálják. Ebből a szempontból problémát az atípusos vagy tünetszegény, esetleg teljesen tünetmentes esetek jelentenek. Azt is fontos megemlíteni, hogy a már eleve gluténmentes diétát folytató egyénekben az említett diagnosztikai módszerek negatív eredményt adnak, a bélnyálkahártya regenerálódik és az autoantitestek szintje is drasztikusan csökken, így esetükben csak valamilyen provokációs teszttel lehet igazolni a cöliákia fennállását, ha korábban még nem diagnosztizálták őket.[84] Szintén megerősíti a betegség diagnózisát, ha a gluténmentes diétára jelentősen javul a beteg állapota,[67] ugyanakkor a betegek gluténra vagy annak megvonására adott szubjektív válasza alapján nem diagnosztizálható vagy zárható ki a betegség.[85] A cöliákia diagnosztikai kritériumaival és kezelésével kapcsolatban több társaság is tett ajánlásokat vagy fogalmazott meg szakmai protokollokat, így például az Amerikai Gasztroenterológiai Kollégium (ACG) 2013-ban,[86] vagy a Brit Gasztroenterológiai Társaság 2014-ben.[87]
| Az ACG 2013-as diagnosztikai ajánlásai:[86] | |
|---|---|
| Kiket ajánlott cöliákia szempontjából vizsgálni? | Diagnosztikus ajánlások: |
| 1. Felszívódási zavarra utaló panasszal, pl. tartós hasmenéssel és fogyással, zsírszéklettel, étkezést követő hasi fájdalommal és puffadással jelentkező beteget. | 1. Az IgA izotípusú anti-tTG ellenanyag meghatározása az első számú javasolt szerológiai vizsgálat a 2 évnél idősebb betegekben. |
| 2. Olyan tünetekkel, panaszokkal jelentkező beteget, amelyek gluténmentes diétával kezelhetők lennének, amennyiben cöliákia áll mögöttük. | 2. Ha a cöliákia mellett IgA-deficiencia gyanúja is felmerül, a cöliákia szerológiai vizsgálatával egy időben ajánlott teljes IgA szint meghatározást is végezni, vagy alternatívaként mind IgA, mind IgG típusú ellenanyagokat meghatározni (pl. anti-DPG IgG) |
| 3. Azokat, akiknek családjában van igazoltan cöliákiás beteg és maguk is a betegségre utaló panasszal, vagy laboreltéréssel rendelkeznek. | 3. Akik igazoltan IgA-deficienciában szenvednek vagy alacsony a mért IgA szint, azokban IgG alapú szerológiai teszteket kell végezni. (Pl. anti-DPG és anti-tTG IgG meghatározás) |
| 4. A lisztérzékeny betegek elsőfokú, tünetmentes rokonait. | 4. Ha nagyfokú a cöliákia gyanúja, akkor vékonybélbiopsziát célszerű végezni, abban az esetben is, ha a szerológia negatív eredményt ad. |
| 5. Emelkedett transzamináz értékekkel rendelkező beteget, amennyiben nincs más nyilvánvaló oka az eltérésnek. | 5. Mindennemű szerológiai teszt csak glutént tartalmazó étrend mellett végezhető. |
| 6. Azon I-es típusú cukorbetegségben szenvedőket, akikben bármilyen emésztési panasz, vagy lisztérzékenységre utaló egyéb eltérés, laborlelet észlelhető. | 6. A natív gliadin ellenes antitestek meghatározása nem ajánlott a betegség primer vizsgálatára. |
| 7. A kis rizikójú egyénekben az anti-tTG IgA helyett egyéb, kombinált szerológiai tesztek nem javasoltak, mert bár némiképp fokozódik a vizsgálat érzékenysége, de jelentősen csökken a specificitása. | |
| 8. A 2 évnél fiatalabb gyermekek szűrése esetén az anti-tTG IgA mellett anti-DPG IgA vagy IgG meghatározása is javasolt. | |
A lisztérzékenység diagnózisa tehát többféle vizsgálat együttes eredményén alapul, figyelembe kell venni a beteg tüneteit és kórtörténetét, a szerológiai és a vékonybél szövettani vizsgálatokat, és ezek együttes eredményei alapján állapítható meg a betegség. A laboratóriumi vizsgálatok mellett a vékonybélbiopszia továbbra is fontos részét képezi a diagnózis megerősítésének.[86]
Laborvizsgálatok[szerkesztés]
A lisztérzékenységnek lehetnek nem-specifikus, általános laborjelei, melyek a felszívódási zavarra utalnak, így a rutin laboratóriumi vizsgálat során csökkent lehet a vér hemoglobin, vas, kalcium, összfehérje, albumin, koleszterin vagy vércukor szintje.[88]
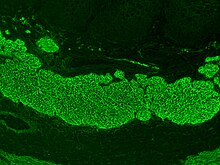
A betegségre specifikus laborvizsgálatokat a különböző szerológiai tesztek jelentik, amelyek során a beteg vérszérumában keringő, a betegségre jellemző kóros autoantitesteket mutatják ki, leggyakrabban ELISA-val. Ezek közül három emelhető ki, az egyik a szöveti transzglutamináz ellenes antitest (a-tTG), mely az ellenanyag izotípusától függően lehet IgA (tTG-IgA) vagy IgG (tTG-IgG), a másik az anti-endomízium antitest (EMA), a harmadik pedig a deamidált gliadin peptid (DGP) ellen termelődött ellenanyag (a-DGP).[2][4] Az elsőként javasolt vizsgálat az anti-tTG IgA ELISA alapú meghatározása, amelynek érzékenysége kezeletlen betegségnél a tanulmányok alapján kb. 90-95%, specificitása pedig még ennél is magasabb.[86][89][90] Az anti-tTG IgG specificitása szintén magas, szenzitivitása azonban jóval alacsonyabb, ugyanakkor mivel a lisztérzékeny betegek kb. 2-3 százaléka IgA-hiányos, esetükben kiválthatja a tTG-IgA meghatározást.[91] IgA-deficienciában emellett meghatározható még az anti-DPG IgG is, mely hasonlóan megbízható.[92]
Az ELISA-n kívül használnak még indirekt immunfluoreszcens mikroszkópiát is az antitestek meghatározására, ennek során többnyire majomból származó nyelőcső szövetet kezelnek a beteg szérumával, majd egy fluoreszcensen jelölt másodlagos antitesttel kimutatják a nyelőcsővel keresztreagáló humán ellenanyagokat (pl. EMA).[93]
Sokáig az elsődlegesen meghatározott autoantitest a natív gliadin elleni immunglobulin volt (AGA, anti-gliadin antitest), illetve kiterjedten használták az anti-retikulin antitest meghatározást is. Mára mindkettő elavultnak számít, mind specificitás, mind szenzitivitás terén elmaradnak az anti-tTG és anti-DPG vizsgálatától.[86][94] Ugyanakkor az anti-tTG és az EMA meghatározás kevésbé érzékeny a 2 évesnél fiatalabb gyermekek esetében, ebben a korcsoportban az anti-DPG kimutatása megbízhatóbb, így általában anti-tTG és anti-DPG együttes mérését javasolják.[86]
A szérumvizsgálatok a diéta ellenőrzésére is alkalmasak, hiszen a jól működő diéta esetén jelentősen csökken az autoantitestek szintje,[95] 6-12 hónappal a gluténmentes diéta bevezetését követően a betegek 80, míg 5 évvel már több mint 90 százalékában negatív eredményt adnak a szerológiai vizsgálatok.[86]
Az említett szerológiai tesztek mellett a vérből végzett HLA-DQ2 és DQ8 meghatározás is alkalmazható, bár kevéssé elterjedt.[96] A HLA vizsgálat esetén a DQ2 és DQ8 pozitivitás önmagában alkalmatlan a betegség igazolására, azonban együttes hiányuk nagyon valószínűtlenné teszi a lisztérzékenységet, így elsősorban azoknál a betegeknél ajánlott, akiknél lisztérzékenység gyanúja áll fent, mégsem reagálnak a gluténmentes diétára. Negatív eredmény esetén valószínűsíthetően más betegség áll a panaszaik hátterében.[87]
A vérvizsgálatok bevezetése óta a betegség már azoknál is felismerhető, akiknek a családjában már több lisztérzékeny is volt, de csak kevés vagy nem jellemző tünetet mutattak. A betegséggel járó felszívódási zavarok egyéb, járulékos tesztekkel is vizsgálhatók, ezek közé tartozik a hidrogén-kilégzési teszt, ami a betegség következtében kialakuló laktáz hiányt képes kimutatni,[97] illetve a D-xilóz teszt. Utóbbi során a betegnek szájon át adott D-xilóz az emésztőenzimek csökkent működése miatt nem szívódik fel, ezáltal nem kerül be a vizeletbe sem.[98]
Endoszkópia[szerkesztés]

Bár a szerológiai tesztek sokat fejlődtek, a diagnózis alappillére továbbra is az endoszkópos mintavételt követő szövettani vizsgálat, mely azokban az esetekben is képes kimutatni a betegséget, ha a szerológia álnegatív eredményt ad.[86] A tükrözéses vizsgálat lényege, hogy egy fényforrással és kamerával ellátott eszközt vezetnek a nyelőcsövön keresztül a gyomorba (gasztroszkópia) és azon át a patkóbélbe (gasztroduodenoszkópia), ezáltal a bélnyálkahártya megtekinthető, illetve mintavétel történhet szövettani vizsgálat céljából. Utóbbit rendszerint a bél több pontjából is elvégzik, hogy növeljék a szövettani vizsgálat eredményességét és elkerüljék az álnegatív eredményt. Bár lehetnek a betegségnek endoszkóppal is látható gyanújelei (pl. a nyálkahártya redőzöttsége, mozaik-szerű rajzolata, a szubmukozális erek elődomborodása stb.), ezek azonban nem specifikusak cöliákiára. Az endoszkópos vizsgálat is alkalmas lehet a boholy atrófia kimutatására, elsősorban a nagyításos, ún. magnifikációs endoszkópia alkalmazásával, különösen, ha valamilyen, a bélnyálkahártyát megfestő anyagot (pl. metilénkék) is használnak (kromoendoszkópia).[99] Ugyan az endoszkópos vizsgálatok sokat fejlődtek, jelenleg még önmagukban, szövettani vizsgálat nélkül alkalmatlanok a lisztérzékenység diagnosztizálására, illetve az újabb módszerek széleskörű felhasználását erősen limitálja, hogy a betegek többnyire nehezen tolerálják őket és eszközigényük miatt meglehetősen drágák is.[99]
Szövetvizsgálat[szerkesztés]

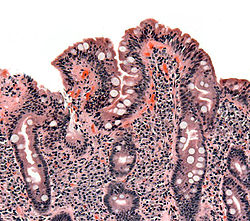
A diagnózis szempontjából leginkább döntő a patkóbélből vett minta szövettani vizsgálata, amely a negatív szerológia esetén is képes kimutatni a betegséget. Régen a betegből három alkalommal is végeztek szövettani mintavételt, a beteg első jelentkezésekor, még gluténtartalmú étrend mellett, mellyel a bélhám sorvadását mutatták ki, majd a gluténmentes diétát követően, amikor is a bélnyálkahártya regenerációját látták, végül egy ismételt, diagnosztikus glutén provokáció után, ahol a betegség reaktiválódásának jeleit keresték. Mára, a szerológiai tesztek és a HLA tipizálás fejlődésével erre már nincs szükség, az egy alkalommal végzett bélbiopszia és az abból készült szövettan az előbbiekkel együtt elegendő a diagnózishoz.[86] A biopsziát gyomortükrözés segítségével végzik, és a mintát a patkóbél nyálkahártyájából veszik, a patkóbél több különböző pontjából. A szakorvos ezután mikroszkóp alatt vizsgálja a mintát. A mintát beágyazó szakembernek külön hangsúlyt kell fektetnie a megfelelő orientációra, a bélbolyhokat a szövettanász hosszában, a metszéssel merőlegesen tudja jól értékelni. Kis nagyításnál (50-szeres) a felépítést, nagy nagyítás alatt a gyulladásos sejtek arányát nézi. A lisztérzékenység felismerésében döntő fontosságú a bél hámrétegben jelenlevő limfociták száma (IEL, intraepiteliális limfocita). Határesetben a szövetfestést követően tovább vizsgálják az immunrendszer jelenlevő sejtjeit (immunhisztológia), és meghatározzák a különféle fehérvérsejtek arányát. Az eredmény megítélésében aranyszabálynak számítanak a Marsh által 1992-ben kidolgozott szövettani kritériumok.[100] Ezeket azóta többen, többféleképpen is módosították (pl. Oberhuber, Corazza).[101][102]
| A cöliákia szövettani értékelése az Oberhuber által módosított Marsh-kritériumok alapján:[101] | |
|---|---|
| Beosztás | Jellemzők |
| Marsh 0. | Normális bélnyálkahártya. |
| Marsh 1. | A bél hámrétegében a normálisnál több intraepiteliális limfocita (IEL) látható (>40 limfocita / 100 bélhámsejt). |
| Marsh 2. | A Lieberkühn-kripták (bélmirigyek) túlburjánzása (hyperplasia) figyelhető meg. |
| Marsh 3a. | A bélbolyhok részleges sorvadása (atrophia) látható. |
| Marsh 3b. | A bélbolyhok majdnem teljes, szubtotális atrófiája látható. |
| Marsh 3c. | A bélbolyhok teljes, totális atrófiája látható. |
Fontos azt is megemlíteni, hogy boholy atrófiát és intraepiteliális limfocita szaporulatot (duodenális limfocitózis) nem csak lisztérzékenység okozhat, így a bél patológiai vizsgálata is a beteg egyéb tüneteivel és a szerológiával együttesen értékelhető.[103] Mindemellett a fertőzéses gyulladást a különböző lehetséges kórokozók utáni hiábavaló kutatás zárja ki.
Az 1990-ben megújított diagnosztikai kritériumok megkövetelik, hogy a diéta javulást hozzon a beteg számára. Az ellenőrző szövetvizsgálatot a korábbiaktól eltérően csak speciális esetekben ajánlják. Ilyenek például a diéta kétséges eredményei, vagy a kétséges diagnózis.[15]
Differenciáldiagnózis[szerkesztés]
Bár tipikus esetekben a betegségkép egyértelmű, sokszor más betegség is okozhatja még a tipikus, de nem specifikus szövetvizsgálati eredményt. Szóba jöhetnek még élelmiszerallergiák (tej- és szójafehérje),[104] különböző bélfertőzések,[105] autoimmun enteropátia,[106] az immunrendszer betegségei.[106] A tünetek mögött állhat még szervátültetés utáni kilökődés, citosztatikumok, hiányos táplálkozás, és mások. Kétes esetben próbaként bevezethető a gluténmentes diéta. Ha a tünetek enyhülnek, vagy elmúlnak, akkor a lisztérzékenység bebizonyosodott.
Egy további lehetőség a cisztás fibrózis,[104] amit az izzadság kloridtartalmának vizsgálatával lehet kizárni. Mindezeken kívül ki kell zárni az olyan veleszületett betegségeket, mint a hasnyálmirigy-elégtelenség, különféle enzimhiányok (például laktáz- vagy szacharázhiány), a Crohn-betegség és a Whipple-kór.[104]
Kezelése[szerkesztés]
A lisztérzékenységnek csak egyetlen hatékony kezelése létezik: a gluténmentes diéta, amit a legtöbb esetben élethossziglan kell tartani. Kezdetben célszerű a tejes ételek kerülése és a B12-vitamin pótlása vassal.[67] A betegség kezelése nagyon fontos, hiszen a kezeletlen betegeknél gyakrabban fordul elő a vékonybél rosszindulatú megbetegedése (pl. adenokarcinóma, limfóma). Nagyon fontos, hogy a betegek megismerjék a számukra tiltott élelmiszereket. Napjainkra a termékeken kötelező feltüntetni a gluténmentes élelmiszereken az áthúzott búzakalászt, így jelezve, hogy a termék fogyasztható a diétázó betegek számára is.
Gluténmentes diéta[szerkesztés]
A lisztérzékenység kezelésében alapvető jelentőségű az élethosszon át tartó gluténmentes diéta.[107] A glutén mint összefoglaló név nemcsak a búzában található gliadinra, hanem egyéb, a betegséget kiváltó prolaminokra is értendő, pl. a rozsban található hordeinre vagy az árpában jelen lévő szekalinra. Az élelmiszerek gluténtartalmának meghatározásánál ezeket együttesen veszik figyelembe. A diéta szigorú betartása rendkívül fontos, mivel segítségével megelőzhetők a betegség későbbi szövődményei (pl. rosszindulatú vékonybél tumorok, csontritkulás, nőknél fertilitási problémák). A gluténmentes étkezéssel kapcsolatos betegoktatás alapvető jelentőségű a kezelés sikere szempontjából, mivel a be nem tartása esetén újra aktiválódik a betegség, így frissen diagnosztizált cöliákia esetén dietetikus személyre szabott tanácsadását javasolják.[108] Fontos megemlíteni, hogy teljesen gluténmentes termék nem létezik, a csomagolásokon található „gluténmentes” megkülönböztetés a nagyon alacsony, a beteg egészsége számára nem ártalmas határérték alatti gluténtartalmat jelzi.[109] Ugyan a még tolerált glutén mennyisége betegenként változó, 10 mg/nap alatti gluténbevitelnél nagyon valószínűtlen, hogy szövettani eltérés alakuljon ki,[109] az eddigi vizsgálatok alapján a biztonságos határ valahol 10 és 100 mg napi gluténbevitel között határozható meg.[110] A betegnek nem pusztán arra kell ügyelnie, hogy gluténmentesen étkezzen, de gondoskodnia kell a vitamin, ásványi anyag és élelmi rost bevitelről is, mivel a gluténmentes ételek utóbbiakban sokszor szegények.[111] A diéta betartása nem egyszerű feladat és a betegek gyakori panasza, hogy nem széleskörűen elérhetőek a gluténmentes termékek, valamint hogy a diéta hátrányosan érinti a szociális életüket, mivel sokkal kevesebb étteremben mernek csak rendelni, illetve sokszor ismerősöknél vagy barátoknál sem mernek enni. Egy, az Egyesült Királyságban 2005-ben végzett felmérés igazolni látszik a betegek aggályait. A vizsgálatban 319 cöliákiást, 513 egészséges laikust és 322 szakácsot kérdeztek a lisztérzékenységről, amiből az derült ki, hogy az éttermekben dolgozó szakácsok sokszor kevésbé tájékozottak a betegségről és a gluténmentes táplálkozásról.[112] Szintén nehézséget jelent, hogy a kifejezetten gluténmentes termékek amellett, hogy kevésbé elterjedtek és elérhetők, rendszerint jelentősen drágábbak is, mint a búzából készült megfelelőik.[113] A gluténmentes diéta betartását lényegesen megkönnyíti, ha a beteget dietetikus vagy orvos kellően felvilágosítja, illetve ha csatlakozik valamilyen önsegítő csoporthoz.[114]
A diéta érezhetően csak azoknak javítja az életminőségét, akikben a betegség korábban valamilyen panaszt okozott, az eleve tünetmentes betegekben szubjektíven nem mérhető a hatása. Ha a betegség a diétát követően stabillá vált, és megszűntek a korábbi tünetek, akkor a beteg követése és időnkénti orvosi ellenőrzése javasolt, melynek keretében célszerű felszívódási zavarra utaló laboreltéréseket (B12-vitamin- és folsavszint, vasszint, kalcium stb.), autoimmun kórképek jeleit (pl. pajzsmirigy hormon szinteket) keresni, valamint a májfunkciókat (pl. GOT, GPT) ellenőrizni és a megfelelő diétázást igazoló szerológiai teszteket (anti-tTG, anti-EMA, anti-DPG) elvégezni. A tünetek hiánya és a negatív szerológia nem minden szerző szerint elégséges, mivel több kisebb tanulmányban is azt találták, hogy a továbbra is fennmaradt bélboholy sorvadás mellett a betegek jelentős részében (40-80%) negatív eredményt adtak a szerológiai tesztek.[115] Mindezek miatt nem egységes az álláspont abban, hogy szükséges-e a betegek követésére ismételt biopsziát végezni.[87] A pozitív szerológia már inkább informatívabb, hiszen további glutén bevitelt jelez. Emellett egyes tanulmányok alapján a csontritkulás rizikója a diéta ellenére is magasabb marad a lisztérzékeny betegekben,[116] így a betegek követése során az ez irányú vizsgálatokat (D-vitamin szint, kalcium szint, csontsűrűség mérése) is javasolják, illetve megelőzésként napi 1000 mg kalciumbevitelt tanácsolnak a betegeknek.[87]
A beteg számára tiltott élelmiszerek[szerkesztés]
Minden nagy gluténtartalmú gabonaféle tiltott. Semmilyen formában sem fogyasztható búza, rozs, árpa, ezek hibridjei, tönkölybúza, vagy annak elődjei. A zabot kis mennyiségben, orvosi ellenőrzés mellett engedik az Egyesült Királyságban és Finnországban.[117] Ennél nagyobb mennyiségben engedik a vadrizst.[118] A betegek számára tiltottak a búza, rozs, árpa, tönkölybúza eredetű élelmiszerek, így az ilyen lisztből készült pékáruk, kekszek, tészták. Ugyancsak kerülendőek a búzaliszttel készült rántott húsok, rántással vagy habarással sűrített főzelékek. A gabonapelyhek az esetek nagy részében tartalmaznak glutént (még a kukoricapelyhekhez is szoktak más, gluténtartalmú gabonát is keverni). Külön figyelmet kell fordítani a feldolgozott élelmiszerekre és késztermékekre, hogy ne tartalmazzanak gluténtartalmú összetevőt. Mivel a glutént szívesen alkalmazzák emulgeátorként, stabilizátorként, vagy aromaanyagok hordozójaként, nem könnyű ezt felismerni. Csak körültekintéssel fogyaszthatók a különböző húsipari termékek (felvágottak, kolbászok), amelyek adalékanyagai sokszor gluténtartalmúak. Ugyancsak problémát jelenthetnek a fűszerek, puding porok, fagylaltok. Az, hogy Magyarországon melyik gyártó mely termékei gluténmentesek, a Magyar Táplálékallergia és Táplálékintolerancia Adatbank honlapján megtekinthetők.[119]
Fogyasztható élelmiszerek[szerkesztés]

Nagy általánosságban fogyaszthatók a különböző húsok, halak, zöldségek, gyümölcsök, a burgonya, az álgabonák (ún. pszeudocereáliák, pl. amaránt, hajdina, azték zsálya, kinoa), a hüvelyesek (pl. borsó, lencse), néhány valódi gabonaféle (pl. rizs, kukorica, cirok, teff). Szintén nem tartalmaz glutént a köles. Ezek, és a belőlük előállított termékek gluténmentesnek tekinthetők, amennyiben külső gluténforrással nem szennyezettek. A csomagolásokon feltüntetett összetevők közül kiemelhető még a maltodextrin, amely bár sokszor búzakeményítőből származik, az ipari előállítása során eltávolításra kerül belőle a glutén, így nem jelent kockázatot.[120][121] Ugyanez érvényes a glükóz szirupra és a dextrózra is, melyek fehérjetartalom hiányában hivatalosan nem számítanak allergéneknek.[121] A módosított keményítő esetében, amennyiben az glutént tartalmazó gabonából készül, úgy a gyártó azt köteles feltüntetni, így ha ez külön nem szerepel a csomagoláson, szintén gluténmentesnek tekinthető.[122] A szójabab önmagában nem tartalmaz glutént, azonban sokszor külső forrásból szennyezett, így kockázatot jelenthet, a kínai konyhában előszeretettel használt szójaszósz pedig gyakran tartalmaz glutént, így általában kerülendő.[123] Léteznek azonban kifejezetten gluténmentes szójaszószok is.[124]
Sok kész termék csomagolásán szerepel a „nyomokban glutén tartalmazhat” felirat, melyet a gyártók elővigyázatosságból helyeznek el azon termékek esetében, amelyek bár önmagukban nem tartalmaznának glutént, azonban glutént is felhasználó üzemben készültek, így nem zárható ki a szennyeződés.
A lepárlással előállított röviditalok, még ha gluténtartalmú gabonából készültek is, a legtöbb szerző szerint fogyaszthatók, mivel az előállítás során csak elhanyagolható mennyiségű glutén marad bennük.[121] Ezek közé tartozik pl. a whisky vagy a gin. Ugyanakkor mások óvatosságra intenek, és a tömény italok közül inkább csak a glutént nem tartalmazó alapanyagokból előállítottakat tekintik biztonságosnak (pl. vodka, rum).[125] A sörök azonban kerülendők, belőlük csak speciális, kifejezetten a betegeknek szánt gluténmentes márkák ihatók.[126]
A diéta elején egyes betegek a bélrendszer kiterjedt károsodása miatt nem képesek feldolgozni a tejet és a tejtermékeket, ezért ezt is figyelembe kell venni. Amíg a bélbolyhok nem regenerálódnak, addig ezek a betegek a tejet, tejtermékeket szójatejjel pótolhatják.[117]
Cöliákia és a zab[szerkesztés]
Külön kiemelendő a zab, melynek fogyasztását sokáig tiltották a lisztérzékeny betegeknek, mivel kiderült, hogy szintén tartalmaz prolamin típusú vegyületet (avenin). Későbbi kutatások alapján azonban az avenin és az azt tartalmazó zab a lisztérzékeny betegekben nem vált ki immunreakciót, amennyiben tiszta, más gluténforrással nem szennyezett.[127][128] A zab magas rost- és B-vitamin-tartalma miatt fontos kiegészítője lehetne a lisztérzékeny betegek étrendjének, és bár a hosszú távú hatásai több szerző szerint is kérdésesek, az eddigi vizsgálatokban a szennyezetlen zab fogyasztását a betegek döntő többségében biztonságosnak találták.[107][129][130] Mivel a zabot általában búzával vagy más gluténtartalmú gabonával együtt termesztik és aratják, az esetek többségében gluténszennyezett, ugyanakkor egyes termelők külön odafigyelnek arra, hogy ne tartalmazzon keresztszennyezést, az ilyen zabból készült termékek is megkaphatják az Európai Unióban a „gluténmentes” jelzést, amennyiben 20 mg/kg alatti a gluténtartalmuk.[131] Az egyes termékek összetevői között feltüntetett zab esetében figyelembe kell venni a gluténszennyezés kockázatát, hacsak a termék külön nem jelöli a gluténmentességet.[131] A zab a lisztérzékeny betegek egy kis százalékában intoleranciát okozhat, így általában azt javasolják, hogy a betegek kérjék ki kezelőorvosuk véleményét, mielőtt zabbal próbálnák kiegészíteni az étrendjüket.[87][132]
Kutatások szerint a zabban található fehérje (avenin) nagyon hasonlít a tüneteket kiváltó gliadinhoz, és az érintettek egy részénél ez indíthatja el a károsító mechanizmusokat.[133]
Diétára nem reagáló betegség[szerkesztés]

A betegek egy részében (3–30%) a gluténmentes diéta bevezetését követően 6-12 hónappal is maradnak lisztérzékenységre utaló panaszok vagy laboratóriumi eltérések. Ennek sok oka lehet, a leggyakrabban azonban a nem megfelelő diéta áll mögötte, így az ilyen betegek esetében dietetikus újbóli felkeresését javasolják.[134] Emellett okozhatják egyéb betegségek, pl. irritábilisbél-szindróma, más étel-intoleranciák, a vékonybelet érintő bakteriális túlburjánzás is. A szigorú, ténylegesen gluténmentes diétára sem reagáló lisztérzékenység az ún. refrakter cöliákia (RCD), amely azonban az összes lisztérzékeny beteg kb. 1 százalékában fordul csak elő.[135] A lisztérzékenység súlyosabb szövődményei, pl. az ulceratív jejunitisz vagy az enteropátia-asszociált T-sejtes limfóma (EATL) rendszerint a refrakter betegekben fordulnak elő. A refrakter betegségnek két formáját különböztetik meg a bélhámban látható limfociták eltérései alapján (RCD1 és RCD2), a 2-es típusra (RCD2) az intraepiteliális limfociták klonális abnormalitása jellemző.[135] Utóbbi rossz prognózissal jár, az 5 éves túlélés 40-60% között mozog, a halálesetekért pedig leginkább a T-sejtes limfóma (EATL) felelős, mely meglehetősen nehezen kezelhető daganatnak számít.[136] Ha a nem megfelelő diétázást kizárták, akkor a refrakter betegség kezelése nehéz, nincsenek nagy, randomizált tanulmányok vagy ajánlások a szakemberek számára, RCD1-ben gyulladáscsökkenő szteroidokat vagy esetleg más immunszuppresszív gyógyszereket (pl. azatioprin) alkalmazhatnak, de ezek RCD2-ben nem hatékonyak.[86][87]
Egyéb, kísérleti terápiák[szerkesztés]
A gluténmentes diéta mellett a betegségnek számos egyéb kezelési lehetősége is felmerült.[137] Ezek közül az egyik a genetikailag módosított gabonák előállítása, amelyekből hiányozna a glutén, azonban a módszer alacsony társadalmi elfogadottsága és a gluténmentes búza hátrányosabb ipari tulajdonságai (pl. pékáruk rosszabb állaga) miatt nem valószínű, hogy hatékony alternatíva lehetne.[4]
Másik terápiás megközelítés a glutént bontó enzimek szájon át történő adása. Ismert, hogy a prolaminok magas prolin és glutamin tartalmuk miatt nehezen bonthatók az emberi emésztőenzimek számára. A terápia lényege az lenne, hogy a prolinban és glutaminban gazdag peptideket is hatékonyan bontó enzimeket (pl. prolil-endopeptidázt, PEP) juttatnának a beteg bélrendszerébe, melyek kisebb darabokra hasítanák a prolaminokat, megakadályozva ezzel, hogy azok autoimmun reakciót váltsanak ki. A nehézséget a vékonybél és a gyomor pH-ja közötti különbség jelenti. Emellett a glutén emésztésének sebessége is döntő, mivel a teljes gluténmennyiségnek le kell bomlania, mielőtt még a vékonybélbe ér.[138] Bár több enzimmel is folynak ilyen irányú klinikai vizsgálatok (pl. az ALV003-mal), jelenleg nem ismert sem a szükséges dózis, sem az, hogy mennyivel az étkezés előtt kellene őket alkalmazni.[137][139] Jelenleg forgalomban van több gluténbontó enzimet tartalmazó készítmény, amelyek a fentiek fényében terápiára, tehát a gluténmentes diéta kiváltására nem alkalmasak. Kiegészítő terápiaként alkalmazva azonban csökkentik a szövődmények kialakulásának esélyét, és segítik a bélnyálkahártya gyógyulását, ugyanis a gluténmentes élelmiszerekben is előfordul maradék glutén, melynek akár részleges lebontásával csökkenthető a patológiás immunválasz.[140]
A prolaminok felszívódását gátló szerekkel is folynak kutatások. Példaként említhető a larazotid-acetát, ami eredetileg a Vibrio cholerae baktériumból izolált hexapeptid, amely a bélhámsejtek közötti szoros kapcsolatok (latinul zonula occludens, angolul tight junction) fellazulását blokkolja, ezáltal meggátolja a gliadin sejtek közötti transzportját. A larazotiddal több kisebb klinikai vizsgálat is készült, melyek előrevetítik esetleges későbbi terápiás felhasználását.[141]
Szintén vizsgálják a szöveti transzglutamináz (tTG) enzim gátlásának lehetőségeit is, amely a gliadin deamidációjával központi szerepet játszik a betegség patogenezisében, azonban még nem találtak az emberi tTG-t szelektíven blokkolni képes vegyületet.[137]
EU-szabályozás[szerkesztés]
A lisztérzékenységben szenvedőknek szánt élelmiszerek összetételéről és címkézéséről szóló, 2009. január 20-i 41/2009/EK rendelet lisztérzékeny szempontok szerint foglalkozik az élelmiszerek, kivéve a csecsemőtápszerek összetételével és megjelölésével.[131] A rendelet határértékeket ad meg a gluténra, mivel nagyon nehéz teljesen gluténmentes élelmiszereket előállítani. A lisztérzékenyeknek ajánlott élelmiszerek lehetséges fokozatai:
- „rendkívül kis gluténtartalmú”: egy kilogramm élelmiszerben legfeljebb 100 mg glutén lehet
- „gluténmentes”: a glutén aránya legfeljebb 20 mg/kg
- „zabbal készült”: a glutén aránya legfeljebb 20 mg/kg, és a zab nem érintkezett búzával, rozzsal, árpával, vagy ezek hibridjeivel.[131]
A rendeletet 2012. január 1-jétől kell alkalmazni.[131]
Kulturális vonatkozásai[szerkesztés]
A kereszténység és az úrvacsora[szerkesztés]
Az úrvacsora egy keresztény szertartás, melynek során a hívek búzából készült ostyát esznek. Az ostyák a lisztérzékeny beteg számára ártalmas mennyiségű glutént tartalmaznak. Számos keresztény egyház és közösség, köztük az Anglikán Közösség, az Egyesült Metodista Egyház vagy az evangélikusok lehetővé teszik a híveiknek, hogy gluténmentes alapanyagokból (pl. rizsből) készült ostyát használjanak.
A római katolikus egyház azonban nem engedélyezi a teljesen gluténmentes ostyák használatát áldozáshoz, álláspontjuk szerint az ostyát vízből és búzalisztből kell készíteni. Az egyik lehetőség, hogy a lisztérzékeny beteg az áldozás során csak a borból fogyaszt, azonban mivel a katolikus doktrína szerint Krisztus egésze egyetlen csepp vérében is benne foglaltatik, a bor ivásával is teljes értékűnek tekinthető a szertartás.[142] Nehezebb a papok helyzete, akiknek két szín alatt kell áldozniuk a misén, ezért egy 2003. július 24-ei határozat szerint külön gonddal kell eljárni azoknak a jelölteknek a felszentelésénél, akiknek problémájuk van az alkohollal vagy a búzaliszttel.[143] Másik lehetőség a csökkentett gluténtartalmú ostyák használata, amelyeket már több országban is használnak a katolikus lisztérzékeny betegek, pl. az Egyesült Államokban és Olaszországban.[144]
Zsidó vallás[szerkesztés]
A zsidó pészach ünnepén kovásztalan kenyeret kell fogyasztani. Készülhet búzából, tönkölybúzából, árpából, rizsből, vagy zabból. Ez kizár több olyan gabonát, amiket a lisztérzékenyek fogyaszthatnának, különösen az askenázi zsidóknál, akik idegenkednek a rizstől. Azonban a zsidó vallási törvények szerint nem szabad életet kockáztatni a törvény betartása érdekében. Így egy súlyosan lisztérzékeny zsidónak nem kell fogyasztania más kovásztalan kenyérből, mint a gluténmentesből. A legtöbb kovásztalan kenyér zabból készül.[145]
Világnap[szerkesztés]
2002 óta május harmadik vasárnapja a lisztérzékenység és a gluténmentes táplálkozás világnapja.[146] Az európai lisztérzékeny szövetségek közös szervezete hozta létre. Ezen a napon különféle rendezvényekkel hívják fel a nagyközönség figyelmét a lisztérzékenységre, és erősítik a lisztérzékenyek összetartását.
Története[szerkesztés]
A lisztérzékenység nem új keletű betegség, a görög Aretaiosz már a Kr. u. második században leírt egy malabszorpcióval, halványabb, hígabb és bűzösebb széklettel, fogyással és sápadtsággal járó kórképet.[147] A betegség felfedezőjének egy angol gyermekgyógyászt, Samuel Gee-t tartják, aki 1888-ban írta le az általa „coeliac affection”-nek nevezett betegséget, amin egy főleg kisgyermekeket érintő emésztési zavart értett. A név még Aretaiosztól eredeztethető, az ógörög κοιλία, koilia (has, alsótest) szóból.[147] Bár Gee a betegséget egyértelműen a táplálkozással hozta összefüggésbe, felismerte például a kórképhez társuló laktóz-intoleranciát is, még nem volt számára ismert az elváltozásokat előidéző anyag. Terápiának is a diétát tartotta, ugyanakkor a pontos kiváltó ok ismeretének hiányában sok olyan ételtől is eltiltotta betegeit, melyeket azok fogyaszthattak volna (pl. rizs, gyümölcsök). Az újabb áttörést a holland H.W. Dicke munkássága jelentette. Dicke az 1944-es holland éhínség alatt felismerte, hogy a cöliákiás betegek állapotában drasztikus javulást idéz elő, ha megvonják tőlük a búza, rozs vagy zab alapú ételeket. Eredményeiről az 1950-es doktori értekezésében számolt be.[147] 1952-ben egy brit kutatócsoport a betegség közvetlen okozójaként a glutént azonosította.[148] A betegségre jellemző szövettani eltéréseket Paulley írta le 1954-ben, míg a szájon át történő szövettani mintavétel technikáját Margot Shiner dolgozta ki 1956-ban.[147] Egy évvel később E. Berger tudósított a gliadin elleni antitestekről, lehetővé téve a szérumdiagnosztika bevezetését.[15] A cöliákia és a dermatitis herpetiformis kapcsolatát 1966-ban írta le Shuster és Marks.[149]
Jegyzetek[szerkesztés]
- ↑ Green PH, Cellier C. (2007. October). „Celiac disease.” (angol nyelven). N Engl J Med. 357 (17), 1731-43. o. DOI:10.1056/NEJMra071600. PMID 17960014.
- ↑ a b c d Di Sabatino A, Corazza GR. (2009. April). „Coeliac disease.” (angol nyelven). Lancet. 373 (9673), 1480-93. o. DOI:10.1016/S0140-6736(09)60254-3. PMID 19394538.
- ↑ Inomata N. (2009. June). „Wheat allergy.” (angol nyelven). Curr Opin Allergy Clin Immunol. 9 (3), 238-43. o. DOI:10.1097/ACI.0b013e32832aa5bc. PMID 19318930.
- ↑ a b c d e f Gujral N, Freeman HJ, Thomson AB. (2012. November). „Celiac disease: Prevalence, diagnosis, pathogenesis and treatment” (angol nyelven). World J Gastroenterol. 18 (42), 6036-59. o. DOI:10.3748/wjg.v18.i42.6036. PMID 23155333.
- ↑ Hausch F, Shan L, Santiago NA, Gray GM, Khosla C. (2002. October). „Intestinal digestive resistance of immunodominant gliadin peptides.” (angol nyelven). Am J Physiol Gastrointest Liver Physiol. 283 (4), G996-G1003. o. DOI:10.1152/ajpgi.00136.2002. PMID 12223360.
- ↑ a b van Heel DA, West J. (2006. July). „Recent advances in coeliac disease.” (angol nyelven). Gut. 55 (7), 1037-46. o. DOI:10.1136/gut.2005.075119. PMID 16766754.
- ↑ Holtmeier W, Caspary WF. (2006. March). „Celiac disease.” (angol nyelven). Orphanet J Rare Dis. 1, 3. o. DOI:10.1186/1750-1172-1-3. PMID 16722573.
- ↑ a b c Freeman HJ. (2009. December). „Adult celiac disease and its malignant complications.” (angol nyelven). Gut Liver. 3 (4), 237-46. o. DOI:10.5009/gnl.2009.3.4.237. PMID 20431755.
- ↑ Kupper C (2005. April). „Dietary guidelines and implementation for celiac disease.” (angol nyelven). Gastroenterology. 128 (4 Suppl 1), S121-7. o. DOI:10.1053/j.gastro.2005.02.024. PMID 15825119.
- ↑ Niewinski MM. (2008. April). „Advances in celiac disease and gluten-free diet.” (angol nyelven). J Am Diet Assoc. 108 (4), 661-72. o. DOI:10.1016/j.jada.2008.01.011. PMID 18375224.
- ↑ Reilly NR, Green PH. (2012. July). „Epidemiology and clinical presentations of celiac disease.” (angol nyelven). Semin Immunopathol. 34 (4), 473-8. o. DOI:10.1007/s00281-012-0311-2. PMID 22526468.
- ↑ Green PH, Lebwohl B, Greywoode R. (2015. May). „Celiac disease.” (angol nyelven). J Allergy Clin Immunol. 135 (5), 1099-1106. o. DOI:10.1016/j.jaci.2015.01.044. PMID 25956012.
- ↑ a b Ludvigsson JF, Leffler DA, Bai JC, Biagi F, Fasano A, Green PH, Hadjivassiliou M, Kaukinen K, Kelly CP, Leonard JN, Lundin KE, Murray JA, Sanders DS, Walker MM, Zingone F, Ciacci C. (2013. January). „The Oslo definitions for coeliac disease and related terms.” (angol nyelven). Gut. 62 (1), 43-52. o. DOI:10.1136/gutjnl-2011-301346. PMID 22345659.
- ↑ Tersigni C, Castellani R, de Waure C, Fattorossi A, De Spirito M, Gasbarrini A, Scambia G, Di Simone N. (2014. July-August). „Celiac disease and reproductive disorders: meta-analysis of epidemiologic associations and potential pathogenic mechanisms.” (angol nyelven). Hum Reprod Update. 20 (4), 582-93. o. DOI:10.1093/humupd/dmu007. PMID 24619876.
- ↑ a b c d e f R. Keller: Klinische Symptomatik „Zöliakie, ein Eisberg“. In: Monatsschrift Kinderheilkunde. Heidelberg 151.2003, 706-714. ISSN 0026-9298
- ↑ Rashid M, Zarkadas M, Anca A, Limeback H. (2011). „Oral manifestations of celiac disease: a clinical guide for dentists.” (angol nyelven). J Can Dent Assoc. 77, b39. o. DOI:10.1136/gutjnl-2011-301346. PMID 21507289.
- ↑ O'Leary C, Wieneke P, Buckley S, O'Regan P, Cronin CC, Quigley EM, Shanahan F. (2002. June). „Celiac disease and irritable bowel-type symptoms.” (angol nyelven). Am J Gastroenterol. 97 (6), 1463-7. o. DOI:10.1111/j.1572-0241.2002.05690.x. PMID 12094866.
- ↑ Malamut G, Cellier C. (2013. September). „Refractory coeliac disease.” (angol nyelven). Curr Opin Oncol. 25 (5), 445-51. o. DOI:10.1097/01.cco.0000432526.47228.b6. PMID 23942290.
- ↑ Malamut G, Chandesris O, Verkarre V, et al. (2013. May). „Enteropathy associated T cell lymphoma in celiac disease: a large retrospective study.” (angol nyelven). Dig Liver Dis. 45 (5), 377-84. o. DOI:10.1016/j.dld.2012.12.001. PMID 23313469.
- ↑ Brousse N, Meijer JW. (2005. May). „Malignant complications of coeliac disease.” (angol nyelven). Best Pract Res Clin Gastroenterol. 19 (3), 401-12. o. DOI:10.1016/j.bpg.2005.02.002. PMID 15925845.
- ↑ Harper JW, Holleran SF, Ramakrishnan R, Bhagat G, Green PH. (2007. November). „Anemia in celiac disease is multifactorial in etiology.” (angol nyelven). Am J Hematol. 82 (11), 996-100. o. DOI:10.1155/2013/127589. PMID 17636474.
- ↑ Kemppainen T, Kröger H, Janatuinen E, et al. (1999. March). „Osteoporosis in adult patients with celiac disease.” (angol nyelven). Bone. 24 (3), 249-55. o. DOI:10.1016/S8756-3282(98)00178-1. PMID 10071918.
- ↑ Hjelle AM, Apalset E, Mielnik P, Bollerslev J, Lundin KE, Tell GS. (2014. June). „Celiac disease and risk of fracture in adults – a review.” (angol nyelven). Osteoporos Int. 25 (6), 1667-76. o. DOI:10.1007/s00198-014-2683-8. PMID 24691647.
- ↑ Pinto-Sánchez MI, Bercik P, Verdu EF, Bai JC. (2015). „Extraintestinal manifestations of celiac disease.” (angol nyelven). Dig Dis. 33 (2), 147-54. o. DOI:10.1159/000369541. PMID 25925916.
- ↑ a b c d e Lauret E, Rodrigo L. (2013). „Celiac disease and autoimmune-associated conditions.” (angol nyelven). Biomed Res Int. 2013, 127589. o. DOI:10.1155/2013/127589. PMID 23984314.
- ↑ a b c d Cohn A, Sofia AM, Kupfer SS. (2014. August). „Type 1 diabetes and celiac disease: clinical overlap and new insights into disease pathogenesis.” (angol nyelven). Curr Diab Rep. 14 (8), 517. o. DOI:10.1007/s11892-014-0517-x. PMID 24952108.
- ↑ Cerutti F, Bruno G, Chiarelli F, Lorini R, Meschi F, Sacchetti C; Diabetes Study Group of the Italian Society of Pediatric Endocrinology and Diabetology. (2004. June). „Younger age at onset and sex predict celiac disease in children and adolescents with type 1 diabetes: an Italian multicenter study.” (angol nyelven). Diabetes Care. 27 (6), 1294-8. o. DOI:10.2337/diacare.27.6.1294. PMID 15161778.
- ↑ Smyth DJ, Plagnol V, Walker NM, et al. (2008. December). „Shared and distinct genetic variants in type 1 diabetes and celiac disease.” (angol nyelven). N Engl J Med. 359 (26), 2767-77. o. DOI:10.1056/NEJMoa0807917. PMID 19073967.
- ↑ Bakker SF, Pouwer F, Tushuizen ME, Hoogma RP, Mulder CJ, Simsek S. (2013. July). „Compromised quality of life in patients with both Type 1 diabetes mellitus and coeliac disease.” (angol nyelven). Diabet Med. 30 (7), 835-9. o. DOI:10.1111/dme.12205. PMID 23534496.
- ↑ Ch'ng CL, Jones MK, Kingham JG. (2007. October). „Celiac disease and autoimmune thyroid disease.” (angol nyelven). Clin Med Res. 5 (3), 184-92. o. DOI:10.3121/cmr.2007.738. PMID 18056028.
- ↑ Kárpáti S. (2012. January-February). „Dermatitis herpetiformis.” (angol nyelven). Clin Dermatol. 30 (1), 56-9. o. DOI:10.1016/j.clindermatol.2011.03.010. PMID 22137227.
- ↑ Fry L, Seah PP, Harper PG, Hoffbrand AV, McMinn RM. (1974. October). „The small intestine in dermatitis herpetiformis.” (angol nyelven). J Clin Pathol. 27 (10), 817-24. o. PMID 4426977.
- ↑ Mendes FB, Hissa-Elian A, Abreu MA, Gonçalves VS. (2013. August). „Review: dermatitis herpetiformis.” (angol nyelven). An Bras Dermatol. 88 (4), 594-9. o. DOI:10.1590/abd1806-4841.20131775. PMID 24068131.
- ↑ Cardones AR, Hall RP 3rd. (2012. May). „Management of dermatitis herpetiformis.” (angol nyelven). Immunol Allergy Clin North Am. 32 (2), 275-81. o. DOI:10.1016/j.iac.2012.04.007. PMID 22560140.
- ↑ a b Rubio-Tapia A, Murray JA. (2008. December). „Liver involvement in celiac disease.” (angol nyelven). Minerva Med. 99 (6), 595-604. o. PMID 19034257.
- ↑ Bushara KO. (2005. April). „Neurologic presentation of celiac disease.” (angol nyelven). Gastroenterology. 128 (4 Suppl 1), s92-7. o. DOI:10.1053/j.gastro.2005.02.018. PMID 15825133.
- ↑ McGowan KE, Lyon ME, Butzner JD. (2008. July). „Celiac disease and IgA deficiency: complications of serological testing approaches encountered in the clinic.” (angol nyelven). Clin Chem. 54 (7), 1203-9. o. DOI:10.1373/clinchem.2008.103606. PMID 18487281.
- ↑ Wingren CJ, Agardh D, Merlo J. (2012. December). „Congenital anomalies and childhood celiac disease in Sweden.” (angol nyelven). J Pediatr Gastroenterol Nutr. 55 (6), 736-9. o. DOI:10.1097/MPG.0b013e318269f19d. PMID 22847461.
- ↑ Mårild K, Stephansson O, Grahnquist L, Cnattingius S, Söderman G, Ludvigsson JF. (2013. July). „Down syndrome is associated with elevated risk of celiac disease: a nationwide case-control study.” (angol nyelven). J Pediatr. 163 (1), 237-42. o. DOI:10.1016/j.jpeds.2012.12.087. PMID 23399451.
- ↑ Bonamico M, Bottaro G, Pasquino AM, Caruso-Nicoletti M, Mariani P, Gemme G, Paradiso E, Ragusa MC, Spina M. (1998. May). „Celiac disease and Turner syndrome.” (angol nyelven). J Pediatr Gastroenterol Nutr. 26 (5), 496-9. o. PMID 9586758.
- ↑ Emilsson L, Andersson B, Elfström P, Green PH, Ludvigsson JF. (2012. June). „Risk of idiopathic dilated cardiomyopathy in 29 000 patients with celiac disease.” (angol nyelven). J Am Heart Assoc. 1 (3), e001594. o. DOI:10.1161/JAHA.112.001594. PMID 23130142.
- ↑ Sollid LM. (2002. September). „Coeliac disease: dissecting a complex inflammatory disorder.” (angol nyelven). Nat Rev Immunol. 2 (9), 647-55. o. DOI:10.1038/nri885. PMID 12209133.
- ↑ a b Akobeng AK, Ramanan AV, Buchan I, Heller RF. (2006. January). „Effect of breast feeding on risk of coeliac disease: a systematic review and meta-analysis of observational studies.” (angol nyelven). Arch Dis Child. 91 (1), 39-43. o. PMID 16287899.
- ↑ Heap GA, van Heel DA. (2009. December). „Genetics and pathogenesis of coeliac disease.” (angol nyelven). Semin Immunol. 21 (6), 346-54. o. DOI:10.1016/j.smim.2009.04.001. PMID 19443237.
- ↑ Jacqueline Coutts, Richard Fielder: Management of Food Allergens. Wiley-Blackwell, ISBN 1-4051-6758-0, S. 157ff.
- ↑ Skovbjerg H, Anthonsen D, Knudsen E, Sjöström H. (2008. November). „Deamidation of gliadin peptides in lamina propria: implications for celiac disease.” (angol nyelven). Dig Dis Sci. 53 (11), 2917-24. o. DOI:10.1007/s10620-008-0450-4. PMID 18679797.
- ↑ Norris JM, Barriga K, Hoffenberg EJ, Taki I, Miao D, Haas JE, Emery LM, Sokol RJ, Erlich HA, Eisenbarth GS, Rewers M. (2005. May). „Risk of celiac disease autoimmunity and timing of gluten introduction in the diet of infants at increased risk of disease.” (angol nyelven). JAMA. 293 (19), 2343-51. o. DOI:10.1007/s10620-008-0450-4. PMID 15900004.
- ↑ Aronsson CA, Lee HS, Liu E, Uusitalo U, Hummel S, Yang J, Hummel M, Rewers M, She JX, Simell O, Toppari J, Ziegler AG, Krischer J, Virtanen SM, Norris JM, Agardh D; TEDDY STUDY GROUP. (2015. February). „Age at gluten introduction and risk of celiac disease.” (angol nyelven). Pediatrics. 135 (2), 239-45. o. DOI:10.1542/peds.2014-1787. PMID 25601977.
- ↑ Nisticò L, Fagnani C, Coto I, Percopo S, Cotichini R, Limongelli MG, Paparo F, D'Alfonso S, Giordano M, Sferlazzas C, Magazzù G, Momigliano-Richiardi P, Greco L, Stazi MA. (2006. June). „Concordance, disease progression, and heritability of coeliac disease in Italian twins.” (angol nyelven). Gut. 55 (6), 803-8. o. PMID 16354797.
- ↑ a b Megiorni F, Mora B, Bonamico M, Barbato M, Nenna R, Maiella G, Lulli P, Mazzilli MC. (2009. January). „HLA-DQ and risk gradient for celiac disease.” (angol nyelven). Hum Immunol. 70 (1), 55-9. o. DOI:10.1016/j.humimm.2008.10.018. PMID 19027045.
- ↑ Neefjes J, Jongsma ML, Paul P, Bakke O. (2011. November). „Towards a systems understanding of MHC class I and MHC class II antigen presentation.” (angol nyelven). Nat Rev Immunol. 11 (12), 823-36. o. DOI:10.1038/nri3084. PMID 22076556.
- ↑ Temme S, Kämper N, Koch N. (2013). „Assembly of matched alpha/beta subunits to HLA class II peptide receptors.” (angol nyelven). Methods Mol Biol. 960, 433-45. o. DOI:10.1007/978-1-62703-218-6_32. PMID 23329505.
- ↑ Schuppan D, Junker Y, Barisani D. (2009. December). „Celiac disease: from pathogenesis to novel therapies.” (angol nyelven). Gastroenterology. 137 (6), 1912-23. o. DOI:10.1053/j.gastro.2009.09.008. PMID 19766641.
- ↑ Karell K, Louka AS, Moodie SJ, Ascher H, Clot F, Greco L, Ciclitira PJ, Sollid LM, Partanen J; European Genetics Cluster on Celiac Disease. (2003. April). „HLA types in celiac disease patients not carrying the DQA1*05-DQB1*02 (DQ2) heterodimer: results from the European Genetics Cluster on Celiac Disease.” (angol nyelven). Hum Immunol. 64 (4), 469-77. o. DOI:10.1016/S0198-8859(03)00027-2. PMID 12651074.
- ↑ Wolters VM, Wijmenga C. (2008. January). „Genetic background of celiac disease and its clinical implications.” (angol nyelven). Am J Gastroenterol. 103 (1), 190-5. o. DOI:10.1111/j.1572-0241.2007.01471.x. PMID 18184122.
- ↑ Romanos J, van Diemen CC, Nolte IM, Trynka G, Zhernakova A, Fu J, Bardella MT, Barisani D, McManus R, van Heel DA, Wijmenga C. (2009. September). „Analysis of HLA and non-HLA alleles can identify individuals at high risk for celiac disease.” (angol nyelven). Gastroenterology. 137 (3), 834-40. o. DOI:10.1053/j.gastro.2009.05.040. PMID 19454285.
- ↑ Trynka G, Hunt KA, Bockett NA, et al. (2011. November). „Dense genotyping identifies and localizes multiple common and rare variant association signals in celiac disease.” (angol nyelven). Nat Genet. 43 (12), 1193-201. o. DOI:10.1038/ng.998. PMID 22057235.
- ↑ Popat S, Hearle N, Hogberg L (2002. March). „Variation in the CTLA4/CD28 gene region confers an increased risk of coeliac disease.” (angol nyelven). Ann Hum Genet. 66 (Pt 2), 125-37. o. DOI:10.1046/j.1469-1809.2002.00102.x. PMID 12174216.
- ↑ Henriksson C, Boström AM, Wiklund IE. (2013. June). „What effect does breastfeeding have on coeliac disease? A systematic review update.” (angol nyelven). Evid Based Med. 18 (3), 98-103. o. DOI:10.1136/eb-2012-100607. PMID 22864373.
- ↑ Szajewska H, Chmielewska A, Pieścik-Lech M, Ivarsson A, Kolacek S, Koletzko S, Mearin ML, Shamir R, Auricchio R, Troncone R; PREVENTCD Study Group. (2012. October). „Systematic review: early infant feeding and the prevention of coeliac disease.” (angol nyelven). Aliment Pharmacol Ther. 36 (7), 607-18. o. DOI:10.1111/apt.12023. PMID 22905651.
- ↑ Kagnoff MF, Paterson YJ, Kumar PJ, Kasarda DD, Carbone FR, Unsworth DJ, Austin RK. (1987. August). „Evidence for the role of a human intestinal adenovirus in the pathogenesis of coeliac disease.” (angol nyelven). Gut. 28 (8), 995-1001. o. PMID 2822550.
- ↑ Stene LC, Honeyman MC, Hoffenberg EJ, Haas JE, Sokol RJ, Emery L, Taki I, Norris JM, Erlich HA, Eisenbarth GS, Rewers M. (2006. October). „Rotavirus infection frequency and risk of celiac disease autoimmunity in early childhood: a longitudinal study.” (angol nyelven). Am J Gastroenterol. 101 (10), 2333-40. o. DOI:10.1111/j.1572-0241.2006.00741.x. PMID 17032199.
- ↑ Ruggeri C, La Masa AT, Rudi S, Squadrito G, Di Pasquale G, Maimone S, Caccamo G, Pellegrino S, Raimondo G, Magazzù G. (2008. August). „Celiac disease and non-organ-specific autoantibodies in patients with chronic hepatitis C virus infection.” (angol nyelven). Dig Dis Sci. 53 (8), 2151-5. o. DOI:10.1007/s10620-007-0146-1. PMID 18231858.
- ↑ Verdu EF, Mauro M, Bourgeois J, Armstrong D. (2007. July). „Clinical onset of celiac disease after an episode of Campylobacter jejuni enteritis.” (angol nyelven). Can J Gastroenterol. 21 (7), 453-5. o. PMID 17637949.
- ↑ Austin AS, Logan RF, Thomason K, Holmes GK. (2002. August). „Cigarette smoking and adult coeliac disease.” (angol nyelven). Scand J Gastroenterol. 37 (8), 978-82. o. PMID 12229976.
- ↑ Ludvigsson JF, Nordenvall C, Järvholm B. (2014. July). „Smoking, use of moist snuff and risk of celiac disease: a prospective study.” (angol nyelven). BMC Gastroenterol. 14, 120. o. DOI:10.1186/1471-230X-14-120. PMID 24994113.
- ↑ a b c Herold, Belgyógyászat, magyar főszerkesztő: Dr. Romics László
- ↑ K. P. Zimmer: Pathophysiologie der Zöliakie. In: Monatsschrift Kinderheilkunde. Heidelberg 151.2003, 698-705. ISSN 0026-9298
- ↑ Shan L, Qiao SW, Arentz-Hansen H, Molberg Ø, Gray GM, Sollid LM, Khosla C. (2005. September-October). „Identification and analysis of multivalent proteolytically resistant peptides from gluten: implications for celiac sprue.” (angol nyelven). J Proteome Res. 4 (5), 1732-41. o. DOI:10.1021/pr050173t. PMID 16212427.
- ↑ Molberg O, Mcadam SN, Körner R, Quarsten H, Kristiansen C, Madsen L, Fugger L, Scott H, Norén O, Roepstorff P, Lundin KE, Sjöström H, Sollid LM. (1998. June). „Tissue transglutaminase selectively modifies gliadin peptides that are recognized by gut-derived T cells in celiac disease.” (angol nyelven). Nat Med. 4 (6), 713-7. o. DOI:10.1038/nm0698-713. PMID 9623982.
- ↑ Maiuri L, Ciacci C, Ricciardelli I, Vacca L, Raia V, Auricchio S, Picard J, Osman M, Quaratino S, Londei M. (2003. July). „Association between innate response to gliadin and activation of pathogenic T cells in coeliac disease.” (angol nyelven). Lancet. 362 (9377), 30-7. o. DOI:10.1016/S0140-6736(03)13803-2. PMID 12853196.
- ↑ Di Sabatino A, Ciccocioppo R, Cupelli F, Cinque B, Millimaggi D, Clarkson MM, Paulli M, Cifone MG, Corazza GR. (2006. April). „Epithelium derived interleukin 15 regulates intraepithelial lymphocyte Th1 cytokine production, cytotoxicity, and survival in coeliac disease.” (angol nyelven). Gut. 55 (4), 469-77. o. PMID 16105889.
- ↑ De Nitto D, Monteleone I, Franzè E, Pallone F, Monteleone G. (2009. October). „Involvement of interleukin-15 and interleukin-21, two gamma-chain-related cytokines, in celiac disease.” (angol nyelven). World J Gastroenterol. 15 (37), 4609-14. o. DOI:10.3748/wjg.15.4609.. PMID 19787822.
- ↑ Caputo I, Barone MV, Martucciello S, Lepretti M, Esposito C. (2009. April). „Tissue transglutaminase in celiac disease: role of autoantibodies.” (angol nyelven). Amino Acids. 36 (4), 693-9. o. DOI:10.1007/s00726-008-0120-z. PMID 18600381.
- ↑ Ciccocioppo R, Di Sabatino A, Parroni R, D'alò S, Pistoia MA, Doglioni C, Cifone MG, Corazza GR. (2000. May). „Cytolytic mechanisms of intraepithelial lymphocytes in coeliac disease (CoD).” (angol nyelven). Clin Exp Immunol. 120 (2), 235-40. o. DOI:10.1046/j.1365-2249.2000.01200.x. PMID 10792370.
- ↑ Hüe S, Mention JJ, Monteiro RC, Zhang S, Cellier C, Schmitz J, Verkarre V, Fodil N, Bahram S, Cerf-Bensussan N, Caillat-Zucman S. (2004. September). „A direct role for NKG2D/MICA interaction in villous atrophy during celiac disease.” (angol nyelven). Immunity. 21 (3), 367-77. o. DOI:10.1016/j.immuni.2004.06.018. PMID 15357948.
- ↑ Lammers KM, Lu R, Brownley J, Lu B, Gerard C, Thomas K, Rallabhandi P, Shea-Donohue T, Tamiz A, Alkan S, Netzel-Arnett S, Antalis T, Vogel SN, Fasano A. (2008. July). „Gliadin induces an increase in intestinal permeability and zonulin release by binding to the chemokine receptor CXCR3.” (angol nyelven). Gastroenterology. 135 (1), 194-204. o. DOI:10.1053/j.gastro.2008.03.023. PMID 18485912.
- ↑ Matysiak-Budnik T, Moura IC, Arcos-Fajardo M, et al. (2008. January). „Secretory IgA mediates retrotranscytosis of intact gliadin peptides via the transferrin receptor in celiac disease.” (angol nyelven). J Exp Med. 205 (1), 143-54. o. DOI:10.1084/jem.20071204. PMID 18166587.
- ↑ Dieterich W, Ehnis T, Bauer M, Donner P, Volta U, Riecken EO, Schuppan D. (1997. July). „Identification of tissue transglutaminase as the autoantigen of celiac disease.” (angol nyelven). Nat Med. 3 (7), 797-801. o. DOI:10.1038/nm0797-797. PMID 9212111.
- ↑ Skovbjerg H, Norén O, Anthonsen D, Moller J, Sjöström H. (2002. July). „Gliadin is a good substrate of several transglutaminases: possible implication in the pathogenesis of coeliac disease.” (angol nyelven). Scand J Gastroenterol. 37 (7), 812-7. o. PMID 12190095.
- ↑ Fleckenstein B, Molberg Ø, Qiao SW, Schmid DG, von der Mülbe F, Elgstøen K, Jung G, Sollid LM. (2002. September). „Gliadin T cell epitope selection by tissue transglutaminase in celiac disease. Role of enzyme specificity and pH influence on the transamidation versus deamidation process.” (angol nyelven). J Biol Chem. 277 (37), 34109-16. o. DOI:10.1074/jbc.M204521200. PMID 12093810.
- ↑ Reif S, Lerner A. (2004. January). „Tissue transglutaminase--the key player in celiac disease: a review.” (angol nyelven). Autoimmun Rev. 3 (1), 40-5. o. DOI:10.1016/S1568-9972(03)00065-X. PMID 14871648.
- ↑ Di Sabatino A, Vanoli A, Giuffrida P, Luinetti O, Solcia E, Corazza GR. (2012. August). „The function of tissue transglutaminase in celiac disease.” (angol nyelven). Autoimmun Rev. 11 (10), 746-53. o. DOI:10.1016/j.autrev.2012.01.007. PMID 22326684.
- ↑ Lebwohl B, Rubio-Tapia A, Assiri A, Newland C, Guandalini S. (2012. October). „Diagnosis of celiac disease.” (angol nyelven). Gastrointest Endosc Clin N Am. 22 (4), 661-77. o. DOI:10.1016/j.giec.2012.07.004. PMID 23083985.
- ↑ Campanella J, Biagi F, Bianchi PI, Zanellati G, Marchese A, Corazza GR. (2008). „Clinical response to gluten withdrawal is not an indicator of coeliac disease.” (angol nyelven). Scand J Gastroenterol. 43 (11), 1311-4. o. DOI:10.1080/00365520802200036. PMID 18609173.
- ↑ a b c d e f g h i j Rubio-Tapia A, Hill ID, Kelly CP, Calderwood AH, Murray JA; American College of Gastroenterology. (2013. May). „ACG clinical guidelines: diagnosis and management of celiac disease.” (angol nyelven). Am J Gastroenterol. 108 (5), 656-76. o. DOI:10.1038/ajg.2013.79. PMID 23609613.
- ↑ a b c d e f Ludvigsson JF, Bai JC, Biagi F, Card TR, Ciacci C, Ciclitira PJ, Green PH, Hadjivassiliou M, Holdoway A, van Heel DA, Kaukinen K, Leffler DA, Leonard JN, Lundin KE, McGough N, Davidson M, Murray JA, Swift GL, Walker MM, Zingone F, Sanders DS; BSG Coeliac Disease Guidelines Development Group; British Society of Gastroenterology. (2014. August). „Diagnosis and management of adult coeliac disease: guidelines from the British Society of Gastroenterology.” (angol nyelven). Gut. 63 (8), 1210-28. o. DOI:10.1136/gutjnl-2013-306578. PMID 24917550.
- ↑ A Gasztroenterológiai Szakmai Kollégium: Az Egészségügyi Minisztérium szakmai protokollja Coeliakia (magyar nyelven) (pdf), 2011. október 10. (Hozzáférés: 2015. június 7.)
- ↑ Li M, Yu L, Tiberti C, Bonamico M, Taki I, Miao D, Murray JA, Rewers MJ, Hoffenberg EJ, Agardh D, Mueller P, Stern M, Bonifacio E, Liu E. (2009. January). „A report on the International Transglutaminase Autoantibody Workshop for Celiac Disease.” (angol nyelven). Am J Gastroenterol. 104 (1), 154-63. o. DOI:10.1038/ajg.2008.8. PMID 19098864.
- ↑ Lewis NR, Scott BB. (2010. January). „Meta-analysis: deamidated gliadin peptide antibody and tissue transglutaminase antibody compared as screening tests for coeliac disease.” (angol nyelven). Aliment Pharmacol Ther. 31 (1), 73-81. o. DOI:10.1111/j.1365-2036.2009.04110.x. PMID 19664074.
- ↑ Dahlbom I, Olsson M, Forooz NK, Sjöholm AG, Truedsson L, Hansson T. (2005. February). „Immunoglobulin G (IgG) anti-tissue transglutaminase antibodies used as markers for IgA-deficient celiac disease patients.” (angol nyelven). Clin Diagn Lab Immunol. 12 (2), 254-8. o. DOI:10.1128/CDLI.12.2.254-258.2005. PMID 15699419.
- ↑ Villalta D, Tonutti E, Prause C, Koletzko S, Uhlig HH, Vermeersch P, Bossuyt X, Stern M, Laass MW, Ellis JH, Ciclitira PJ, Richter T, Daehnrich C, Schlumberger W, Mothes T. (2010. March). „IgG antibodies against deamidated gliadin peptides for diagnosis of celiac disease in patients with IgA deficiency.” (angol nyelven). Clin Chem. 56 (3), 464-8. o. DOI:10.1373/clinchem.2009.128132. PMID 20022984.
- ↑ Amara W, Husebekk A. (1998. November). „Improved method for serological testing in celiac disease--IgA anti-endomysium antibody test: a comparison between monkey oesophagus and human umbilical cord as substrate in indirect immunofluorescence test.” (angol nyelven). Scand J Clin Lab Invest. 58 (7), 547-54. o. PMID 9890337.
- ↑ Nandiwada SL, Tebo AE. (2013. April). „Testing for antireticulin antibodies in patients with celiac disease is obsolete: a review of recommendations for serologic screening and the literature.” (angol nyelven). Clin Vaccine Immunol. 20 (4), 447-51. o. DOI:10.1128/CVI.00568-12. PMID 23365209.
- ↑ S. Buderus, M. J. Lentze: Serologische Diagnostik der Zöliakie. In: Monatsschrift Kinderheilkunde. Heidelberg 151.2003, 715-718. ISSN 0026-9298
- ↑ Hadithi M, von Blomberg BM, Crusius JB, Bloemena E, Kostense PJ, Meijer JW, Mulder CJ, Stehouwer CD, Peña AS. (2007. September). „Accuracy of serologic tests and HLA-DQ typing for diagnosing celiac disease.” (angol nyelven). Ann Intern Med. 147 (5), 294-3023. o. DOI:10.7326/0003-4819-147-5-200709040-00003. PMID 17785484.
- ↑ Rana SV, Malik A. (2014. October). „Hydrogen breath tests in gastrointestinal diseases.” (angol nyelven). Indian J Clin Biochem. 29 (4), 398-405. o. DOI:10.1007/s12291-014-0426-4. PMID 25298621.
- ↑ Uil JJ, van Elburg RM, Mulder CJ, Heymans HS. (1996. August). „The value of the D-xylose test compared with the differential sugar absorption test in recognizing coeliac disease.” (angol nyelven). Neth J Med. 49 (2), 68-72. o. PMID 8824107.
- ↑ a b Ianiro G, Gasbarrini A, Cammarota G. (2013. December). „Endoscopic tools for the diagnosis and evaluation of celiac disease.” (angol nyelven). World J Gastroenterol. 19 (46), 8562-70. o. DOI:10.3748/wjg.v19.i46.8562. PMID 24379573.
- ↑ Marsh MN. (1992. January). „Gluten, major histocompatibility complex, and the small intestine. A molecular and immunobiologic approach to the spectrum of gluten sensitivity ('celiac sprue').” (angol nyelven). Gastroenterology. 102 (1), 330-54. o. PMID 1727768.
- ↑ a b Oberhuber G. (2000. August). „Histopathology of celiac disease.” (angol nyelven). Biomed Pharmacother. 54 (7), 368-72. o. DOI:10.1016/S0753-3322(01)80003-2. PMID 10989975.
- ↑ Corazza GR, Villanacci V, Zambelli C, Milione M, Luinetti O, Vindigni C, Chioda C, Albarello L, Bartolini D, Donato F. (2007. July). „Comparison of the interobserver reproducibility with different histologic criteria used in celiac disease.” (angol nyelven). Clin Gastroenterol Hepatol. 5 (7), 838-43. o. DOI:10.1016/j.cgh.2007.03.019. PMID 17544877.
- ↑ Hammer ST, Greenson JK. (2013. September). „The clinical significance of duodenal lymphocytosis with normal villus architecture.” (angol nyelven). Arch Pathol Lab Med. 137 (9), 1216-9. o. DOI:10.5858/arpa.2013-0261-RA. PMID 23991733.
- ↑ a b c https://glutenerzekeny.hu/a-glutenerzekenyseg-diagnosztizalasa/
- ↑ http://www.otvenentul.hu/egeszseg/29302
- ↑ a b Archivált másolat. [2014. május 18-i dátummal az eredetiből archiválva]. (Hozzáférés: 2015. június 18.)
- ↑ a b Ciacci C, Ciclitira P, Hadjivassiliou M, Kaukinen K, Ludvigsson JF, McGough N, Sanders DS, Woodward J, Leonard JN, Swift GL. (2015. April). „The gluten-free diet and its current application in coeliac disease and dermatitis herpetiformis.” (angol nyelven). United European Gastroenterol J. 3 (2), 121-35. o. DOI:10.1177/2050640614559263. PMID 25922672.
- ↑ Case S. (2005. April). „The gluten-free diet: how to provide effective education and resources.” (angol nyelven). Gastroenterology. 128 (4 Suppl 1), S128-34. o. DOI:10.1053/j.gastro.2005.02.020. PMID 15825120.
- ↑ a b Akobeng AK, Thomas AG. (2008. June). „Systematic review: tolerable amount of gluten for people with coeliac disease.” (angol nyelven). Aliment Pharmacol Ther. 27 (11), 1044-52. o. DOI:10.1111/j.1365-2036.2008.03669.x. PMID 18315587.
- ↑ Hischenhuber C, Crevel R, Jarry B, Mäki M, Moneret-Vautrin DA, Romano A, Troncone R, Ward R. (2006. March). „Review article: safe amounts of gluten for patients with wheat allergy or coeliac disease.” (angol nyelven). Aliment Pharmacol Ther. 23 (5), 559-75. o. DOI:10.1111/j.1365-2036.2006.02768.x. PMID 16480395.
- ↑ Wild D, Robins GG, Burley VJ, Howdle PD. (2010. August). „Evidence of high sugar intake, and low fibre and mineral intake, in the gluten-free diet.” (angol nyelven). Aliment Pharmacol Ther. 32 (4), 574-81. o. DOI:10.1111/j.1365-2036.2010.04386.x. PMID 20528829.
- ↑ Karajeh MA, Hurlstone DP, Patel TM, Sanders DS. (2005. April). „Chefs' knowledge of coeliac disease (compared to the public): a questionnaire survey from the United Kingdom.” (angol nyelven). Clin Nutr. 24 (2), 206-10. o. DOI:10.1177/2050640614559263. PMID 15784479.
- ↑ Singh J, Whelan K. (2011. October). „Limited availability and higher cost of gluten-free foods.” (angol nyelven). J Hum Nutr Diet. 24 (5), 479-86. o. DOI:10.1111/j.1365-277X.2011.01160.x. PMID 21605198.
- ↑ Leffler DA, Edwards-George J, Dennis M, Schuppan D, Cook F, Franko DL, Blom-Hoffman J, Kelly CP. (2008. June). „Factors that influence adherence to a gluten-free diet in adults with celiac disease.” (angol nyelven). Dig Dis Sci. 53 (6), 1573-81. o. PMID 17990115.
- ↑ Vahedi K, Mascart F, Mary JY, Laberenne JE, Bouhnik Y, Morin MC, Ocmant A, Velly C, Colombel JF, Matuchansky C. (2003. May). „Reliability of antitransglutaminase antibodies as predictors of gluten-free diet compliance in adult celiac disease.” (angol nyelven). Am J Gastroenterol. 98 (5), 1079-87. o. DOI:10.1111/j.1572-0241.2003.07284.x. PMID 12809831.
- ↑ Ludvigsson JF, Michaelsson K, Ekbom A, Montgomery SM. (2007. February). „Coeliac disease and the risk of fractures - a general population-based cohort study.” (angol nyelven). Aliment Pharmacol Ther. 25 (3), 273-85. o. DOI:10.1111/j.1365-2036.2006.03203.x. PMID 17269989.
- ↑ a b A. van Teeffelen-Heithoff: Diätetische Grundlagen der Zöliakiebehandlung. In: Monatsschrift Kinderheilkunde. Heidelberg 151.2003, 719-725. ISSN 0026-9298
- ↑ DZG aktuell. 2005,1, S.29. ISSN 0947-5222
- ↑ Magyar Táplálékallergia és Táplálékintolerancia Adatbank: 2015. évi gluténmentes terméklista (magyar nyelven). (Hozzáférés: 2015. június 11.)
- ↑ Coeliacs UK: Coeliacs UK, Frequently Asked Questions: Can I eat maltodextrin? (angol nyelven). (Hozzáférés: 2015. június 10.)
- ↑ a b c Food allergy information: List of exemptions from allergen labelling (angol nyelven). [2015. június 17-i dátummal az eredetiből archiválva]. (Hozzáférés: 2015. június 11.)
- ↑ Coeliacs UK: Coeliacs UK, Frequently Asked Questions: Can I eat modified starch? (angol nyelven). (Hozzáférés: 2015. június 10.)
- ↑ Coeliacs UK: Coeliacs UK, Frequently Asked Questions: Is Chinese soy sauce gluten-free? (angol nyelven). (Hozzáférés: 2015. június 10.)
- ↑ Is Soy Sauce Gluten-Free?. Healthline. (Hozzáférés: 2022. július 1.)
- ↑ Celiac Support Association: Defining "Gluten-Free" (angol nyelven). [2015. június 12-i dátummal az eredetiből archiválva]. (Hozzáférés: 2015. június 11.)
- ↑ Coeliacs UK: Coeliacs UK, Frequently Asked Questions: Can I drink beer? (angol nyelven). (Hozzáférés: 2015. június 11.)
- ↑ Janatuinen EK, Kemppainen TA, Pikkarainen PH, Holm KH, Kosma VM, Uusitupa MI, Mäki M, Julkunen RJ. (2000. March). „Lack of cellular and humoral immunological responses to oats in adults with coeliac disease.” (angol nyelven). Gut. 46 (3), 327-31. o. DOI:10.1136/gut.46.3.327. PMID 10673292.
- ↑ Guttormsen V, Løvik A, Bye A, Bratlie J, Mørkrid L, Lundin KE. (2008). „No induction of anti-avenin IgA by oats in adult, diet-treated coeliac disease.” (angol nyelven). Scand J Gastroenterol. 43 (2), 161-5. o. DOI:10.1080/00365520701832822. PMID 18224563.
- ↑ Pulido OM, Gillespie Z, Zarkadas M, Dubois S, Vavasour E, Rashid M, Switzer C, Godefroy SB. (2009). „Introduction of oats in the diet of individuals with celiac disease: a systematic review.” (angol nyelven). Adv Food Nutr Res. 57, 235-85. o. DOI:10.1016/S1043-4526(09)57006-4. PMID 19595389.
- ↑ Thies F, Masson LF, Boffetta P, Kris-Etherton P. (2014. October). „Oats and bowel disease: a systematic literature review.” (angol nyelven). Br J Nutr. 112 (Suppl 2), S31-43. o. DOI:10.1017/S0007114514002293. PMID 25267242.
- ↑ a b c d e Az Európai Közösségek Bizottsága: A Bizottság 41/2009/EK rendelete a gluténérzékenyeknek szánt élelmiszerek összetételéről és címkézéséről (magyar nyelven), 2009. január 20. (Hozzáférés: 2015. június 10.). A jelenleg hatályos változat (helyesbítés) itt olvasható. A jogszabályt 2016. július 20-tól felváltja a csecsemők és kisgyermekek számára készült, a speciális gyógyászati célra szánt, valamint a testtömeg-szabályozás céljára szolgáló, teljes napi étrendet helyettesítő élelmiszerekről szóló 609/2013/EU európai parlamenti és tanácsi rendelet
- ↑ Fric P, Gabrovska D, Nevoral J. (2011. February). „Celiac disease, gluten-free diet, and oats.” (angol nyelven). Nutr Rev. 69 (2), 107-15. o. DOI:10.1111/j.1753-4887.2010.00368.x. PMID 21294744.
- ↑ Coeliac Disease - Coeliac Australia. www.coeliac.org.au . (Hozzáférés: 2019. május 8.)
- ↑ Leffler DA, Dennis M, Hyett B, Kelly E, Schuppan D, Kelly CP. (2007. April). „Etiologies and predictors of diagnosis in nonresponsive celiac disease.” (angol nyelven). Clin Gastroenterol Hepatol. 5 (4), 445-50. o. DOI:10.1016/j.cgh.2006.12.006. PMID 17382600.
- ↑ a b Rubio-Tapia A, Murray JA. (2010. April). „Classification and management of refractory coeliac disease.” (angol nyelven). Gut. 59 (4), 547-57. o. DOI:10.1136/gut.2009.195131. PMID 20332526.
- ↑ Al-Toma A, Verbeek WH, Hadithi M, von Blomberg BM, Mulder CJ. (2007. October). „Survival in refractory coeliac disease and enteropathy-associated T-cell lymphoma: retrospective evaluation of single-centre experience.” (angol nyelven). Gut. 56 (10), 1373-8. o. DOI:10.1136/gut.2009.195131. PMID 17470479.
- ↑ a b c Sollid LM, Khosla C. (2011. June). „Novel therapies for coeliac disease.” (angol nyelven). J Intern Med. 269 (6), 604-13. o. DOI:10.1111/j.1365-2796.2011.02376.x. PMID 21401739.
- ↑ Süddeutsche Zeitung. München 176.2006, 16. ISSN 0174-4917
- ↑ Tye-Din JA, Anderson RP, Ffrench RA, Brown GJ, Hodsman P, Siegel M, Botwick W, Shreeniwas R. (2010. March). „The effects of ALV003 pre-digestion of gluten on immune response and symptoms in celiac disease in vivo.” (angol nyelven). Clin Immunol. 134 (2), 289-95. o. DOI:10.1016/j.clim.2009.11.001. PMID 19942485.
- ↑ Stepniak, Dariusz, Cristina (2006. október 1.). „Highly efficient gluten degradation with a newly identified prolyl endoprotease: implications for celiac disease”. American Journal of Physiology-Gastrointestinal and Liver Physiology 291 (4), G621–G629. o. DOI:10.1152/ajpgi.00034.2006. ISSN 0193-1857.
- ↑ Leffler DA, Kelly CP, Abdallah HZ, Colatrella AM, Harris LA, Leon F, Arterburn LA, Paterson BM, Lan ZH, Murray JA. (2012. October). „A randomized, double-blind study of larazotide acetate to prevent the activation of celiac disease during gluten challenge.” (angol nyelven). Am J Gastroenterol. 107 (10), 1554-62. o. DOI:10.1038/ajg.2012.211. PMID 22825365.
- ↑ Holy Communion and People with Coeliac Disease (angol nyelven) (pdf). Liturgy Office, Englnad & Wales. (Hozzáférés: 2015. július 26.)
- ↑ Ratzinger, Joseph (24 July 2003). Prot. 89/78-174 98. Congregation for the Doctrine of the Faith. Full text at: The Use of Mustum and Low-Gluten Hosts at Mass. BCL Newsletter. United States Conference of Catholic Bishops, 2003. november 1. [2007. január 2-i dátummal az eredetiből archiválva]. (Hozzáférés: 2007. március 7.)
- ↑ Catholic Communion and Celiac Disease: the Options (angol nyelven). Catholic Celiac Society. (Hozzáférés: 2015. július 26.)
- ↑ Rabbi Avraham Juravel: Gluten Intolerance, Celiac, Allergies And Pesach. Orthodox Union. [2007. október 12-i dátummal az eredetiből archiválva]. (Hozzáférés: 2006. szeptember 3.)
- ↑ Archivált másolat. [2015. június 18-i dátummal az eredetiből archiválva]. (Hozzáférés: 2015. június 18.)
- ↑ a b c d Losowsky MS. (2008). „A history of coeliac disease.” (angol nyelven). Dig Dis. 26 (2), 112-20. o. DOI:10.1159/000116768. PMID 18431060.
- ↑ Anderson CM, French JM, Sammons HG, Frazer AC, Gerrard JW, Smellie JM. (1952. April). „Coeliac disease; gastrointestinal studies and the effect of dietary wheat flour.” (angol nyelven). Lancet. 1 (6713), 836-42. o. PMID 14918439.
- ↑ Marks J, Shuster S, Watson AJ. (1966. December). „Small-bowel changes in dermatitis herpetiformis.” (angol nyelven). Lancet. 2 (7476), 1280-2. o. PMID 4163419.
Ajánlott irodalom[szerkesztés]
- Kumar, Cotran, Robbins: A patológia alapjai, Semmelweis kiadó, Budapest, 1994
- Tulassay Zsolt (szerk.): A belgyógyászat alapjai, Medicina kiadó, 2007 Budapest, ISBN 978-963-226-072-3
- Dr. Solymosi Teréz: Lisztérzékenyek szakácskönyve, Könyvkuckó, 2006
- W. Kiess: Therapie in der Kinder- und Jugendmedizin. Urban & Fischer Verlag bei Elsevier, 2007 ISBN 978-3-437-23200-8
További információk[szerkesztés]
- Lisztérzékeny.lap.hu
- Lisztérzékenyek Érdekképviseletének Országos Egyesülete Archiválva 2015. január 20-i dátummal a Wayback Machine-ben
- Lisztérzékenység (cöliákia) tünetei és kezelése Archiválva 2018. április 26-i dátummal a Wayback Machine-ben
- Allergia Adatbank: 2015. évi gluténmentes terméklista
- WEBBeteg.hu: A lisztérzékenység tünetei
- HáziPatika.com: Lisztérzékenység
- Lisztérzékenyek magyar facebook csoportja
- Magyar Gasztroenterológiai Társaság honlapja
- Coeliacs UK, Az Egyesült Királyságban élő lisztérzékenyek szervezete (angol nyelven)
| Az itt található információk kizárólag tájékoztató jellegűek, nem minősülnek orvosi szakvéleménynek, nem pótolják az orvosi kivizsgálást és kezelést. A cikk tartalmát a Wikipédia önkéntes szerkesztői alakítják ki, és bármikor módosulhat. |

