Rotavírus
| Rotavirus | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
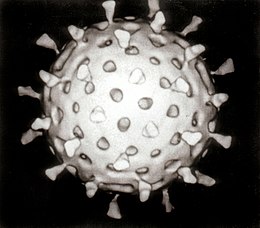 Rotavírus számítógépes modellje
| ||||||||||
| Vírusbesorolás | ||||||||||
| ||||||||||
| Típusfaj | ||||||||||
| rotavírus A | ||||||||||
| Fajok | ||||||||||
| ||||||||||
| Hivatkozások | ||||||||||
A Wikimédia Commons tartalmaz Rotavirus témájú kategóriát. |
A rotavírusok a vírusok Reoviridae családjának Rotavirus nemzetségéhez tartozó, kétszálú RNS-genommal rendelkező fajok, a kisgyerekek hasmenéses megbetegedéseinek leggyakoribb kórokozói.[1] A világon ötéves koráig szinte minden gyerek megfertőződik velük legalább egyszer.[2] Minden egyes fertőzéssel erősödik az immunitás, így a klinikai tünetek egyre enyhülnek; a felnőttek már csak ritkán érintettek.[3] A nemzetségbe kilenc faj tartozik, a rotavírus A, B, C, D, E, F, G, H és I. A leggyakoribb az A változat, a humán megbetegedések 90%-át ez okozza. A rotavírusokat 1973-ban fedezte fel az ausztrál Ruth Bishop.[4]
A vírus széklettel terjed. A szervezetbe jutva a vékonybél hámsejtjeiben szaporodik és eközben bélhurutos tüneteket okoz. Bár a csecsemők és kisgyerekek súlyos hasmenéses eseteik kb. egyharmadáért felelős,[5] közegészségügyi jelentőségét sokszor alábecsülik, különösen a fejlődő országokban.[6] A rotavírusok az állatokat, azon belül a haszonállatokat is képesek megfertőzni.[7]
A gyerekkori rotavírus-fertőzés általában könnyen kezelhető betegség; ennek ellenére csak 2013-ban ez a kórokozó felelt a hasmenéses okozta gyermek-halálesetek 37%-áért, világszerte 215 ezer áldozatot szedve.[8] Döntő többségük a fejlődő országokban történt.[9] Az Egyesült Államokban az oltási program bevezetése előtt a rotavírusok évente 2,7 milliónyi súlyos megbetegedéses esetet okoztak, amelyből 60 ezren kerültek kórházba, átlagosan 37-en pedig életüket vesztették.[10] A betegséget védőoltással lehet megelőzni, a fertőzés esetén pedig legfontosabb a megfelelő folyadékpótlás.[11] Azokban az országokban, ahol vakcinációs programot vezettek be, a rotavírusos fertőzések száma és súlyossága meredeken csökkent.[12][13][14]
Biológiája[szerkesztés]
A rotavírusok típusai[szerkesztés]
A rotavírusoknak kilenc faja ismert: A, B, C, D, E, F, G, H és I.[15] Az embereket leggyakrabban az A, ritkábban a B és C változatok fertőzik meg. Az A–E fajok más állatokban is okoznak megbetegedéseket,[16] az E és H fajok sertéseket, a D, F és G madarakat, az I macskákat fertőz.[17][18][19]
Az A fajon belül több különböző törzset, szerotípust különítettek el.[20] Az influenzavírushoz hasonlóan ezeket is két felszíni fehérjéjük szerint osztályozzák. A VP7 glikoprotein határozza meg a G-szerotípust, a proteázszenzitív VP4 pedig a P-t.[21] A G- és P-csoportot meghatározó fehérjék génjei egymástól függetlenül öröklődnek, így számos különböző kombináció jöhet létre.[21] A rotavírus A számára egy teljes genotipizálási rendszert fejlesztettek ki, amely lehetővé teszi az atipikus törzsek eredetének visszafejtését.[22] Az egyes G és P-változatok előfordulási gyakorisága az országokon belül és között, valamint időben is gyorsan változhat.[23]
Szerkezete[szerkesztés]
A rotavírusok genomja 11 különböző darab kettős szálú RNS-molekulából áll, amelyek együttes hossza 18 555 nukleotidot tesz ki. A molekulákat 1-től 11-ig számozták meg csökkenő sorrendben és valamennyin egy gént találunk. Minden gén egy fehérjét kódol, kivéve a 9-est, amelyik kettőt.[24] A genomot egy háromrétegű, ikozaéder alakú fehérjekapszid veszi körbe. A vírusrészecskék átmérője maximum 76,5 nm lehet.[25][26] A vírus lipidburokkal nem rendelkezik.
Proteinjei[szerkesztés]

A vírusrészecskét (viriont) hat vírusfehérje alkotja. Ezeknek az ún. struktúrproteineknek az elnevezése: VP1, VP2, VP3, VP4, VP6 és VP7. Rajtuk kívül a vírus hat másik, „nem-struktúr” fehérjét is termel, de ezek a fertőzött sejten belül hatnak és a virionba nem kerülnek be. Ezek az NSP1, NSP2, NSP3, NSP4, NSP5 és NSP6.[16]
Az összesen 12 vírusfehérje közül legalább 6 képes kötődni az RNS-hez.[27] Pontos feladatuk egyelőre nem teljesen ismert, feltételezik, hogy a genom másolásához, virionba való csomagolásához és a génexpresszió szabályozásához lehet közük.[28]
Struktúrproteinek[szerkesztés]
A VP1 a virion közepén található és funkciója szerint RNS-polimeráz.[29] A megfertőzött sejtben mRNS-t készít a vírusgénekről a fehérjék termeléséhez, valamint a szaporodáshoz számos kópiát készít a genomról.[30]
A VP2 a kapszid belső rétegét alkotja és megköti az RNS-genomot.[31]
A VP3 is a vírusrészecske belsejében található és feladata szerint egy guanilil-transzferáz enzim. Működése során 5' cap-pal ("sapkával") látja el a genomról átírt mRNS-t.[32] A sapka védi meg a molekulát a sejt nukleinsavakat bontó enzimeitől, a nukleázoktól.[33]
A VP4 egy felszíni fehérje, amely tüskeként mered ki a rotavírus felületéről.[34] Ő felelős azért, hogy megkösse a leendő gazdasejt felszínén a megfelelő receptort.[35] Éretlen alakjában nem képes elvégezni a feladatát, fertőzőképessé válásához előbb a gyomor tripszin enzimének VP5* és VP8* fehérjékké kell hasítania.[36] A VP4-tő függ a vírus virulenciája (betegségokozó képessége) és ő határozza meg az osztályozás során a P-típust.[37] Emberek esetében összefüggés mutatható ki a vércsoport szekrétor státusza és a rotavírus-fertőzésre való érzékenység között. A non-szekrétorok ellenállóak a vírus P[4] és P[8] törzseivel szemben, vagyis feltehető, hogy a vércsoport-antigének receptorként szolgálhatnak a vírus számára.[38]
A VP6 alkotja a kapszid nagy részét. Az immunrendszer jól reagál rá és általában ezt használják a rotavírusok fajainak elkülönítésére.[39] A rotavírus A-t detektáló tesztek is ezt a fehérjét ismerik fel.[40]
A VP7 egy glikoprotein, amely a virion külső felszínen található. Strukturális feladatain kívül meghatározza a G-csoportokat az osztályozás során és a VP6-hoz hasonlóan szintén sok ellenanyag képződik ellene.[25]
Nem-struktúrproteinek[szerkesztés]
Az NSP1, az 5. gén terméke egy RNS-kötő fehérje.[41] Képes blokkolni az interferonválaszt, amellyel a veleszületett immunrendszer védi a szervezetet a vírusfertőzéssel szemben. Az NSP1 hatására a gazdasejt fehérjebontó proteoszómái lebontják azokat a szignálproteineket (az ún. interferon regulációs faktor transzkripciós faktorokat), amelyek szükségesek az interferontermelés beindításához.[42]
Az NSP2 szintén RNS-kötő protein, amely a genom replikációjához szükséges és nagyobb mennyiségben gyűlik fel annak helyszínén.[31][43]
Az NSP3 a virális mRNS-hez kötődik és az a feladata, hogy leállítsa a sejt saját proteinjeinek szintézisét;[44] kikapcsolja azt a két transzlációiniciációs faktort, amire feltétlenül szükség van a gazdasejt mRNS-ének átírásához. Az NSP3 először leválasztja a poli(A)-kötő fehérjét (PABP) az eIF4F transzlációiniciációs faktorról. A PABP a megfelelő 3' poli(A)-farokkal rendelkező mRNS-ek (vagyis a gazdasejt szinte valamennyi mRNS-e) átírásához szükséges. Az NSP3 ezután foszforiláció elősegítésével inaktiválja az eIF2-t.[45] A 3' poli(A)-farkat nem tartalmazó virális mRNS-nek nincs szüksége a fenti faktorokra.[46]
Az NSP4 egy enterotoxin (az elsőként felfedezett virális enterotoxin), amely hasmenést indukál.[47]
Az NSP5-öt a 11-es genomszegmens kódolja. A fertőzött sejtekben a viroplazmában (a citoplazma azon helyén, ahol a vírusszaporodás történik) gyülemlik fel.[48]
Az NSP6 is képes nukleinsavakhoz kötődni és szintén a 11. szegmens egy alternatív leolvasású ORF-ja (nyitott leolvasási keret, gyakorlatilag gén) kódolja.[49][50]
| RNS-szegmens (gén) | Méret (bázispár) | Fehérje | Molekulasúly (kDa) | Elhelyezkedés | Szám viriononként | Funkció |
|---|---|---|---|---|---|---|
| 1 | 3302 | VP1 | 125 | A virion közepén | 12 | RNSA-függő RNA-polimeráz |
| 2 | 2690 | VP2 | 102 | A kapszid belső oldala | 120 | RNS-kötő |
| 3 | 2591 | VP3 | 88 | A virion közepén | 12 | metiltranszferáz, mRNS-„sapkát” készít |
| 4 | 2362 | VP4 | 87 | Felszíni tüske | 180 | Célsejthez való kapcsolódás, virulencia |
| 5 | 1611 | NSP1 | 59 | Nem-struktúr fehérje | 0 | 5'RNS-hez kötődés, interferon-antagonista |
| 6 | 1356 | VP6 | 45 | Kapszidfehérje | 780 | Struktúrfehérje, az egyik legfontosabb antigén |
| 7 | 1104 | NSP3 | 37 | Nem-struktúr fehérje | 0 | Aktiválja a virális mRNS-t és lekapcsolja a sejt proteinjeinek szintézisét |
| 8 | 1059 | NSP2 | 35 | Nem-struktúr fehérje | 0 | Az RNS-genom becsomagolását végző NTP-áz |
| 9 | 1062 | VP71 VP72 | 38 és 34 | Felszíni | 780 | Struktúrfehérje, immunrendszeri célpont |
| 10 | 751 | NSP4 | 20 | Nem-struktúr fehérje | 0 | Enterotoxin |
| 11 | 667 | NSP5, NSP6 | 22 | Nem-struktúr fehérje | 0 | Az NSP2 modulátorai, egy- és kétszálú RNS-t is kötnek, foszfoproteinek |
A fenti adatok az SA11 majom-rotavírusra igazak. A pontos méretek más törzseknél eltérhetnek.
Replikáció[szerkesztés]

A vírus a felszíni receptorhoz való kötődés után endocitózissal lép be a sejtbe, ahol egy emésztő vezikulumba, endoszómába kerül. A vírus külső fehérjéi (a VP7 és a VP4 tüske) megbontják az endoszóma membránját, a vírus kiszabadul a citoplazmába, de ez egyúttal a környezet kalciumkoncentrációjának megváltozásával is jár. Erre a szignálra a három alegységből álló VP7 darabjaira esik, a kapszidot csak annak második és harmadik (VP2-ből és VP6-ból álló) rétege alkotja ezután.[51]
A genom 11 db kettős RNS-e továbbra is a kapszidváz védelmében marad, míg a virális RNS-polimeráz elkezdi lemásolni őket. Azzal, hogy a genom nem lép ki a citoplazmába, a vírus kikerüli a sejt belső védelmi rendszereit, mint az RNS-intereferenciát, melyet a kettős szálú RNS jelenléte indít be.[52]
Az RNS-polimeráz mind fehérjeszintézis, mind genommásolás céljából írja át az RNS-genomot. A rotavírusok fehérjéi a citoplazma egy jól elhatárolható helyén, az ún. viroplazmában gyűlnek fel. A viroplazmában a pozitív-szenz RNS-szál (amelyről a vírus-mRNS íródik át) védve van az siRNS (kis interferáló RNS)-indukálta lebontástól.[53] A viroplazmák már két órával a fertőzés megkezdése után kialakulnak a sejtmag mellett és itt történik a virionok összecsomagolása, leginkább az NSP5 és NSP2 közreműködésével. Az NSP5 kikapcsolása (pl. RNS-interferencia segítségével) drasztikus módon lecsökkenti a rotavírusok replikációs hatékonyságát. A kétrétegű kapsziddal rendelkező, félkész virionok az endoplazmatikus retikulunhoz vándorolnak, ahol megkapják a harmadik, külső réteget. A kész virionok a sejt lízisével kerülnek ki a környezetbe.[36][54][55]
Terjedés[szerkesztés]

A rotavírusok a beteg székletével terjednek. A szennyezett kéz, különböző felületek, tárgyak érintése és szájba kerülése adja át a fertőzést.[56] Lehetséges, hogy cseppfertőzéssel, az aoroszolok belélegzésével is átadódik.[57] A beteg széklete rendkívül fertőző, grammonként 10 billió életképes vírusrészecskét is tartalmazhat.[39] A sikeres fertőzéshez kevesebb, mint 100 is elegendő.[3]
A rotavírusok közepesen ellenállóak a környezetben, amerikai vizsgálatok az iszapban literenként átlag egy fertőzőképes viriont találtak, amelyek 9-19 napig maradtak aktívak.[58] A baktériumok és paraziták ellen foganatosított közegészségügyi intézkedések a jelek szerint nem hatásosak a rotavírusok ellen, mert előfordulásuk a fejlett és fejlődő országokban hasonló.[57]
A fertőzés tünetei[szerkesztés]
A rotavírusos enteritisz lehet enyhe vagy súlyos betegség, amelynek tünetei émelygés, hányás, vizes hasmenés és hőemelkedés. A szimptómák általában a fertőzéstől számítva két nap múlva jelennek meg.[59] A betegség gyors lefolyású, általában hányással kezdődik, amit négy-nyolc napos, erőteljes hasmenéses időszak követ. A kiszáradás jóval gyakoribb, mint a bakteriális eredetű bélpanaszok esetében és a halálozások többségét ez okozza.[60]
A rotavírus A több alkalommal is megfertőzhet valakit élete során: az első többnyire még jellemző tüneteket okoz, de ahogyan az immunrendszer alkalmazkodik, az ezt követő fertőzések jóval enyhébbek vagy akár tünetmentesek.[39][61][62] Ennek megfelelően a szimptómás fertőzések a két év alatti gyerekek körében a leggyakoribbak és a kor előrehaladtával (akár 45 éves korig) egyre ritkábbá válnak.[63] A legsúlyosabb esetek a 0,5-2 éves gyerekek, az idősek és az immunhiányos páciensek közül kerülnek ki. A gyerekkorban megszerzett immunitás miatt a felnőttkori hasmenéses eseteket többnyire nem rotavírus okozza, azonban a tünetmentes fertőzés is elég ahhoz, hogy fenntartsa a vírusok jelenlétét a közösségben.[64] Vannak arra utaló jelek, hogy a vércsoporti szekrétor státusz (tehát hogy a vércsoport szerinti antigének ürülnek-e a testfolyadékokba), illetve a bél baktériumflórája befolyásolhatja a rotavírus-fertőzés lefolyását.[65]
A betegség mechanizmusa[szerkesztés]

A rotavírusok a vékonybélhám bolyhainak sejtjeiben, az enterocitákban szaporodnak, amely során a hámszövetben jelentős szerkezeti és funkcionális változások lépnek fel.[66][67] Emberekben és állatokban is előfordulhat, hogy a bélrendszerből szórványosan átterjedhetnek más szervekre és a makrofágokra is.[68]
A hasmenéses tüneteknek több oka is van.[69] A vírusszaporodás elpusztítja az enterocitákat, amely a tápanyagfelszívódás zavaraival jár. A vírus NSP4 proteinje egy enterotoxin, amely kalciumfüggő kloridszekréciót indukál, akadályozza a víz visszaszívását a bélüregből, csökkenti a mikrobolyhok diszacharidáz enzimeinek működését és aktiválja a helyi periférikus idegrendszer kalciumfüggő reflexeit.[47] Az NSP4 a sejtmembránba ágyazódva ioncsatornaként működik és megnöveli a citoplazma kalciumkoncentrációját, amely a virion összeszerelődéséhez szükséges. A megnövekedett kalciumszint autofágiát (önmegsemmisítést) indít be az érintett sejteknél.[70]
NSP4-szekrécióval kijuthat a fertőzött sejtből. Ez az extracelluláris forma, melyet a bél proteázenzimei módosítanak, enterotoxinként viselkedve az egészséges sejtek integrinreceptorához kapcsolódik, azok belső kalciumszintjét is megnöveli, további autofágiát és kiválasztásos hasmenést indukálva.[71]
A rotavírus-fertőzésre jellemző hányást az okozza, hogy a vírus az emésztőrendszer enterokromaffin sejtjeit is megtámadja. A fertőzés szerotonintermelést indukál, amely aktiválja a vagális afferens idegeket, amelyek az agytörzsben hányási reflexet idéznek elő.[72]
Az egészséges enterociták laktáz enzimet választanak ki a vékonybél üregébe. Pusztulásukkal enzimhiány és tejcukor-érzékenység lép fel,[73] amely néhány hétig tart.[74] Amikor a gyerek a betegség után ismét tejet kap, ismét enyhe hasmenés léphet fel, ezúttal a tejcukor bakteriális fermentációjának következtében.[75]
Immunválasz[szerkesztés]
Specifikus immunválasz[szerkesztés]
A rotavírusok a B- és T-sejtek immunválaszát is kiváltják. A VP4 és VP7 elleni ellenanyagok csökkentik a vírusok fertőzőképességét.[76] Az antitesteket az IgM, IgA és IgG típusú fehérvérsejtek is termelik. A magában beadott tisztított antitestek is védenek a fertőzéstől.[77] Az újszülötteket kb. fél éves korig az anyától kapott IgG ellenanyagok védik, ám ezek egyúttal csökkentik a védőoltás hatékonyságát is.[78]
Veleszületett immunválasz[szerkesztés]
A fertőzés beindítja a sejtek beépített vírusellenes védekezését, I. és III. típusú interferonok és más citokinek termelődnek, amelyek gátolják a vírusreplikációt, a makrofágok és természetes ölősejtek pedig elpusztítják a fertőzött sejteket.[79] A vírus kettős szálú RNS-ét felismerik a belső receptorok (mint a Toll-szerű receptorok), amelyek szintén interferontermelést indít el.[80] A rotavírusok NSP1 proteinje képes az interferon I blokkolására az IRF3, IRF5 és IRF7 regulációs fehérjék kikapcsolásával.[80]
A védettség jele[szerkesztés]
A vérben a specifikus IgG és IgA, a bélben az IgA a jele annak, hogy a szervezet védett a rotavírus-infekcióval szemben.[81] Az IgG és IgA megfelelően magas (>1:200) szintje a vérszérumban elegendő a fertőzés kivédésére; az IgA-szint és a védőoltás hatékonysága között egyértelmű összefüggés mutatható ki.[82]
Diagnózis[szerkesztés]
A rotavírus-fertőzöttség megállapítása általában a bélhurut diagnózisát követi. A kórházba kerülő gyerekeket általában letesztelik rotavírus A-ra;[83][84] a kórokozót a székletből mutatják ki antigénvizsgálattal. Több, elegendően érzékeny és specifikus teszt is rendelkezésre áll, amelyek a rotavírus A valamennyi szerotípusát felismerik.[85] Kutatólaboratóriumok polimeráz-láncreakcióval (PCR) vagy elektronmikroszkóppal is kimutathatják a vírust.[86] Mivel a vírusgenom RNS-ből áll, reverz transzkripciós PCR-re (RT-PCR) van szükség, de ebből is kifejlesztettek már olyat, amely képes kimutatni valamennyi humán rotavírus fajt és szerotípust.[87]
Kezelés[szerkesztés]
A rotavírus-fertőzés kezelése a tünetek enyhítésére és mindenekelőtt a kiszáradás elkerülésére szorítkozik.[11] Súlyos esetben a dehidratáció a páciens halálát is okozhatja.[88] Kevésébé súlyos esetben a szájon történő folyadékpótlás is elegendő, cukros-sós víz adásával.[89] A WHO és az UNICEF 2004-ben a heveny hasmenés kezelésére alacsony ozmolaritású folyadék itatását és a cinkpótlást ajánlotta.[90] Komoly folyadékvesztés esetén a rehidratációt kórházban végzik infúzió vagy nazogasztrikus szonda segítségével, a páciens elektrolit- és vércukorszintjét pedig folyamatosan monitorozzák.[83] A bélflórát helyreállító probiotikus készítmények (mint a Lactobacillus rhamnosus és Saccharomyces boulardii, esetleg olyan vegyületek mint a dioszmektit vagy a racekadotril)[91] csökkenthetik a hasmenéses időszak tartamát.[92] A rotavírus-fertőzés ritkán jár komplikációval és megfelelő kezelés mellett a prognózis igen jó.[93]
Megelőzés[szerkesztés]
A rotavírusok rendkívül fertőzőképesek és nem áll rendelkezésre ellenük specifikus antibiotikum vagy más gyógyszer. A higiéniai viszonyok javulása nem hozza magával a fertőzés gyakoriságának jelentős csökkenését és a kiszáradást megelőző terápia sem teszi nélkülözhetővé a kórházi kezelést a súlyos esetekben; ezért a visszaszorítására tett legfontosabb közegészségügyi intézkedés a lakosság védőoltással való ellátása.[2] Az Egyesült Államokban 1998-ban kapott engedélyt az első vakcina. A klinikai teszteket az USA-ban, Finnországban és Venezuelában végezték. A védőoltás komolyabb mellékhatás nélkül 80-100%-os védettséget biztosított a rotavírus A ellen.[94][95] Miután azonban kiderült, hogy 12 ezer gyerekből egyben megnöveli a bélbetüremkedés (intussusceptio) esélyét, 1999-ben kivonták a piacról.[96] Az intézkedést többen kritizálták, rámutatva, hogy az oltóanyag haszna jóval nagyobb lett volna, mint az általa jelentett kockázat.[97] 2006-ra két újabb vakcinát fejlesztettek ki, amelyek már kellően biztonságosnak bizonyultak.[98] 2009-ben a WHO javasolta, hogy a rotavírus elleni védőoltást vegyék fel az egyes országok immunizációs programjába.[99]
A javaslat szerint eljáró országokban a rotavírus-fertőzés előfordulása és a súlyos esetek száma jelentősen visszaesett.[12][13][14] Egy 2014-es felmérés úgy találta, hogy az oltóprogramok 49-92%-kal csökkentették a rotavírus-okozta hospitalizált esetek számát, általában pedig a kórházba került súlyos hasmenéses esetek száma 17-55%-kal esett vissza.[100] Mexikóban például a világon az elsők között vezették be a vakcinációt 2006-ban és 2009-ben már 65%-os csökkenést tapasztaltak a kétévesnék fiatalabb kisgyerekeknél a hasmenés okozta halálozások tekintetében.[101] Nicaragua 2006-ban az első fejlődő ország volt, amely bevezette a rotavírus elleni oltóprogramot és a fertőzések száma hamarosan 40%-kal, az orvoshoz fordulások száma pedig kb. 50%-kal esett vissza.[102] Az Egyesült Államokban 2006 óta 86%-kal csökkent a rotavírushoz köthető hospitalizációk száma. A programok a nem oltott gyerekek esetében is csökkentették a fertőződés esélyét, mert jelentősen visszaesett a cirkuláló vírusok aránya is.[103] Hasonló tapasztalatokat szereztek az afrikai és ázsiai fejlődő országokban is, ahol korábban a vírusok a legtöbb halálos áldozatot szedték.[14][104][105][106] Európában a nemzeti oltóprogramok hatására 65-84%-os csökkenést tapasztaltak a fertőzések számában.[107] Az egész világot tekintve a vakcináció átlagosan 67%-kal csökkentette az adott tünetekhez kötődő kórházi beutalásokat és ügyeleti kezeléseket.[108] Magyarországon 2017-ben nem volt kötelező a rotavírus elleni vakcina beadása, az érintett gyerekpopuláció átoltottságát 25%-osra becsülték.[109]
Epidemiológia[szerkesztés]

A rotavírusos megbetegedések 90%-áért felelős rotavírus A[111] az egész világon előfordul. Évente több millió hasmenéses esetet okoz, amelyek közül csak 2013-ban több mint 215 ezer bizonyult halálos kimenetelűnek, 90%-uk a fejlődő országokban.[6] Ötéves koráig szinte minden gyerek találkozik a vírussal legalább egyszer.[112] A csecsemők és kisgyerekek között a rotavírusok a leggyakoribb kórokozói a súlyos hasmenéses megbetegedéseknek, a kórházi ápolást igénylő esetek kb. harmadáért, az ilyen okból történő halálozások 37%-ért és az öt év alatti gyerekek haláleseteinek 5%-ért felelősek.[113] Az érintett fiúknak kétszer nagyobb az esélye a kórházba kerülésre, mint a lányoknak.[114][115] A vakcinálási kor előtt a fertőzések többsége az év hűvös, száraz időszakaiban következett be.[116][117]
Helyi járványok gyakran fordulnak elő kórházban fekvő csecsemők, bölcsődések vagy óvodások, esetenként otthonban élő idősek körében.[64][118] Az Egyesült Államokban még 1981-ben is előfordult, hogy a szennyezett vezetékes víz közvetítette a fertőzést.[119] Az eddigi legszélesebb körű hasmenésjárvány 2005-ben történt Nicaraguában. A kórokozó egy mutáción átesett rotavírus A-törzs volt, amely feltehetően képes volt kijátszani a lakosság már meglevő immunitását.[120] Hasonlóan jelentős járvány zajlott le 1977-ben Brazíliában.[121]
A rotavírus B Kínában váltott ki több alkalommal minden korosztályt érintő járványt; ilyenkor általában a vezetékes víz szennyeződött a csatornából.[122][123] 1998-ban Indiában zajlott le egy helyi, endemikus törzs (az ún. CAL) által okozott rotavírus B-járvány.[124][125] A világ más részein a rotavírus B ritka, pl. az Egyesült Államok felnőtt lakóinak nincs is ellene immunitásuk.[126] A rotavírus C-esetek igen ritkák és elszigeteltek, kisebb járványok családokon belül fordulhatnak elő.[127]
Egyéb gazdaállatok[szerkesztés]

A rotavírusok számos emlősfaj kicsinyeit képesek megtámadni és mind a házi-, mind a vadállatok körében hasmenésjárványokat okoznak.[7] A haszonállatok körében főleg a borjakat és malacokat betegítik meg, és a kezelési költségek, valamint az elhullások miatt jelentős gazdasági károkat okozhatnak.[128] Feltételezik, hogy a humán törzsek esetenként genetikai információt cserélhetnek az állatokat fertőző vírusokkal.[128] Néhány esetben kimutatható volt, hogy az állati törzsek közvetlenül embereket is megbetegítettek, vagy RNS-szegmeneseiket kicserélték a humán vírusváltozatokkal.[129][130][131]
Felfedezésük[szerkesztés]
Jacob Light és Horace Hodes 1943-ban kimutatta, hogy fertőző hasmenésben szenvedő gyerekek székletéből nyert, baktériumszűrön áthatoló ágens szarvasmarhánál is hasonló tüneteket produkál.[132] Három évtizeddel később a megőrzött mintákból kiderült, hogy rotavírusokkal dolgoztak.[133] Időközben felfedezték, hogy egy egérvírus hasonló szerkezetű, mint a szarvasmarhákat megbetegítő kórokozó.[134][135] Az ausztrál Ruth Bishop és munkatársai 1973-ban gyerekek székletében hasonló felépítésű vírusokat találtak.[4] A brit Thomas Henry Flewett javasolta a rotavírus elnevezést, mert az elektronmikroszkópos képeken a vírusrészecskék kerékre (latinul rota) emlékeztették.[136] 1976-ban más állatfajokból is leírtak hasonló szerkezetű és természetű vírusokat. A szerotípusokat először 1980-ban különítették el,[137] és a következő évben majomvese-sejtkultúrában tenyészteni is sikerült a vírusokat. Ekkor derült ki, hogy a replikációhoz feltétlenül szükség van a tripszin emésztőenzimre is.[138] A tenyésztés segítségével jelentősen felgyorsult a kutatás és az 1980-as évek közepén megkezdődhettek az első vakcinakísérletek.[139]
Jegyzetek[szerkesztés]
- ↑ (2015) „Rotavirus Infection: A Disease of the Past?”. Infectious Disease Clinics of North America 29 (4), 617–35. o. DOI:10.1016/j.idc.2015.07.002. PMID 26337738.
- ↑ a b Bernstein DI (2009). „Rotavirus overview”. The Pediatric Infectious Disease Journal 28 (Suppl 3), S50–3. o. [2013. május 11-i dátummal az eredetiből archiválva]. DOI:10.1097/INF.0b013e3181967bee. PMID 19252423. (Hozzáférés: 2018. augusztus 22.)
- ↑ a b (2009) „Rotavirus vaccines: opportunities and challenges”. Human Vaccines 5 (2), 57–69. o. DOI:10.4161/hv.5.2.6924. PMID 18838873.
- ↑ a b Bishop R (2009). „Discovery of rotavirus: Implications for child health”. Journal of Gastroenterology and Hepatology 24 (Suppl 3), S81–5. o. DOI:10.1111/j.1440-1746.2009.06076.x. PMID 19799704.
- ↑ World Health Organization: Global Rotavirus Sentinel Hospital Surveillance Network, 2015
- ↑ a b (2007) „Use of formative research in developing a knowledge translation approach to rotavirus vaccine introduction in developing countries”. BMC Public Health 7, 281. o. DOI:10.1186/1471-2458-7-281. PMID 17919334.
- ↑ a b Fenner's Veterinary Virology, 4th, Boston: Academic Press, 288. o. (2010). ISBN 0-12-375158-6
- ↑ (2016) „Global, Regional, and National Estimates of Rotavirus Mortality in Children <5 Years of Age, 2000-2013”. Clinical Infectious Diseases 62 (Suppl 2), S96–105. o. DOI:10.1093/cid/civ1013. PMID 27059362.
- ↑ World Health Organization (2008). „Global networks for surveillance of rotavirus gastroenteritis, 2001–2008”. Weekly Epidemiological Record 83 (47), 421–8. o. (Hozzáférés: 2012. május 3.)
- ↑ (2007) „Hospitalizations and deaths from diarrhea and rotavirus among children <5 years of age in the United States, 1993–2003”. Journal of Infectious Diseases 195 (8), 1117–25. o. DOI:10.1086/512863. PMID 17357047.
- ↑ a b Diggle L (2007). „Rotavirus diarrhea and future prospects for prevention”. British Journal of Nursing 16 (16), 970–4. o. DOI:10.12968/bjon.2007.16.16.27074. PMID 18026034.
- ↑ a b (2011) „Summary of effectiveness and impact of rotavirus vaccination with the oral pentavalent rotavirus vaccine: a systematic review of the experience in industrialized countries”. Human Vaccines 7 (7), 734–48. o. DOI:10.4161/hv.7.7.15511. PMID 21734466.
- ↑ a b (2010) „Performance of rotavirus vaccines in developed and developing countries”. Human Vaccines 6 (7), 532–42. o. DOI:10.4161/hv.6.7.11278. PMID 20622508.
- ↑ a b c (2016) „Health Benefits of Rotavirus Vaccination in Developing Countries”. Clinical Infectious Diseases 62 (Suppl 2), S91-228. o. DOI:10.1093/cid/civ1015.
- ↑ Virus Taxonomy: 2017 Release. International Committee on Taxonomy of Viruses (ICTV)
- ↑ a b (2010. szeptember 1.) „Genetic and antigenic diversity of human rotaviruses: potential impact on vaccination programs”. The Journal of Infectious Diseases 202 Suppl (Suppl 1), S43-8. o. DOI:10.1086/653548. PMID 20684716.
- ↑ (2011. augusztus 1.) „Porcine rotavirus closely related to novel group of human rotaviruses”. Emerging Infectious Diseases 17 (8), 1491–3. o. DOI:10.3201/eid1708.101466. PMID 21801631.
- ↑ (2014. július 1.) „Widespread rotavirus H in commercially raised pigs, United States”. Emerging Infectious Diseases 20 (7), 1195–8. o. DOI:10.3201/eid2007.140034. PMID 24960190.
- ↑ (2017. június 1.) „Rotavirus I in feces of a cat with diarrhea”. Virus Genes 53 (3), 487–490. o. DOI:10.1007/s11262-017-1440-4. PMID 28255929.
- ↑ (2009. március 1.) „The ever-changing landscape of rotavirus serotypes”. The Pediatric Infectious Disease Journal 28 (3 Suppl), S60-2. o. DOI:10.1097/INF.0b013e3181967c29. PMID 19252426.
- ↑ a b (2012. január 1.) „Rotavirus diversity and evolution in the post-vaccine world”. Discovery Medicine 13 (68), 85–97. o. PMID 22284787.
- ↑ (2016. július 1.) „Unbiased whole-genome deep sequencing of human and porcine stool samples reveals circulation of multiple groups of rotaviruses and a putative zoonotic infection”. Virus Evolution 2 (2), vew027. o. DOI:10.1093/ve/vew027. PMID 28748110.
- ↑ (1989. december 1.) „Temporal and geographical distributions of human rotavirus serotypes, 1983 to 1988”. Journal of Clinical Microbiology 27 (12), 2827–33. o. PMID 2556435.
- ↑ (1989) „Rotavirus gene structure and function”. Microbiological Reviews 53 (4), 410–49. o. PMID 2556635.
- ↑ a b Rotavirus proteins: structure and assembly, Reoviruses: Entry, Assembly and Morphogenesis, Current Topics in Microbiology and Immunology. New York: Springer, 189–219. o.. DOI: 10.1007/3-540-30773-7_7 (2006). ISBN 978-3-540-30772-3
- ↑ Structure of rotavirus, Rotaviruses, Current Topics in Microbiology and Immunology. New York: Springer, 9–29. o. (1994). ISBN 9783540567615
- ↑ (1995) „Structure and function of the rotavirus RNA-binding proteins”. The Journal of General Virology 76 (11), 2633–44. o. DOI:10.1099/0022-1317-76-11-2633. PMID 7595370.
- ↑ Patton JT (2001). „Rotavirus RNA replication and gene expression”. Novartis Foundation Symposium 238, 64–77; discussion 77–81. o. DOI:10.1002/0470846534.ch5. PMID 11444036.
- ↑ (2006) „Bioinformatic prediction of polymerase elements in the rotavirus VP1 protein”. Biological Research 39 (4), 649–59. o. DOI:10.4067/S0716-97602006000500008. PMID 17657346.
- ↑ (2012) „Interactions among capsid proteins orchestrate rotavirus particle functions”. Current Opinion in Virology 2 (4), 373–9. o. DOI:10.1016/j.coviro.2012.04.005. PMID 22595300.
- ↑ a b (2004) „Nonstructural proteins involved in genome packaging and replication of rotaviruses and other members of the Reoviridae”. Virus Research 101 (1), 57–66. o. DOI:10.1016/j.virusres.2003.12.006. PMID 15010217.
- ↑ Desk Encyclopedia of Human and Medical Virology. Boston: Academic Press, 277. o. (2009). ISBN 0-12-375147-0
- ↑ (2009) „Regulation of mRNA cap methylation”. The Biochemical Journal 425 (2), 295–302. o. DOI:10.1042/BJ20091352. PMID 20025612.
- ↑ (2006) „Rotavirus spike protein VP4 binds to and remodels actin bundles of the epithelial brush border into actin bodies”. Journal of Virology 80 (8), 3947–56. o. [2011. szeptember 28-i dátummal az eredetiből archiválva]. DOI:10.1128/JVI.80.8.3947-3956.2006. PMID 16571811. (Hozzáférés: 2018. augusztus 22.)
- ↑ (2002) „Molecular biology of rotavirus cell entry”. Archives of Medical Research 33 (4), 356–61. o. DOI:10.1016/S0188-4409(02)00374-0. PMID 12234525.
- ↑ a b (2004) „Emerging themes in rotavirus cell entry, genome organization, transcription and replication”. Virus Research 101 (1), 67–81. o. DOI:10.1016/j.virusres.2003.12.007. PMID 15010218.
- ↑ (2002) „Characterization of neutralization specificities of outer capsid spike protein VP4 of selected murine, lapine, and human rotavirus strains”. Virology 299 (1), 64–71. o. DOI:10.1006/viro.2002.1474. PMID 12167342.
- ↑ (2014) „Association between norovirus and rotavirus infection and histo-blood group antigen types in Vietnamese children”. Journal of Clinical Microbiology 52 (5), 1366–74. o. DOI:10.1128/JCM.02927-13. PMID 24523471.
- ↑ a b c Bishop RF (1996). „Natural history of human rotavirus infection”. Archives of Virology 12, 119–28. o. DOI:10.1007/978-3-7091-6553-9_14. PMID 9015109.
- ↑ (1984) „Enzyme-linked immunosorbent assays based on polyclonal and monoclonal antibodies for rotavirus detection” (PDF). Journal of Clinical Microbiology 19 (2), 248–54. o. [2011. szeptember 27-i dátummal az eredetiből archiválva]. PMID 6321549. (Hozzáférés: 2018. augusztus 22.)
- ↑ (1993) „Comparative analysis of the rotavirus NS53 gene: conservation of basic and cysteine-rich regions in the protein and possible stem-loop structures in the RNA”. Virology 196 (1), 372–8. o. DOI:10.1006/viro.1993.1492. PMID 8395125.
- ↑ (2016) „The Rotavirus Interferon Antagonist NSP1: Many Targets, Many Questions”. Journal of Virology 90 (11), 5212–5. o. DOI:10.1128/JVI.03068-15. PMID 27009959.
- ↑ (1994) „The rotavirus RNA-binding protein NS35 (NSP2) forms 10S multimers and interacts with the viral RNA polymerase”. Virology 202 (2), 803–13. o. DOI:10.1006/viro.1994.1402. PMID 8030243.
- ↑ (1993) „Rotavirus protein NSP3 (NS34) is bound to the 3' end consensus sequence of viral mRNAs in infected cells” (PDF). Journal of Virology 67 (6), 3159–65. o. [2011. szeptember 28-i dátummal az eredetiből archiválva]. PMID 8388495. (Hozzáférés: 2018. augusztus 22.)
- ↑ (2016) „Challenging the Roles of NSP3 and Untranslated Regions in Rotavirus mRNA Translation”. PLOS One 11 (1), e0145998. o. DOI:10.1371/journal.pone.0145998. PMID 26727111.
- ↑ (2012) „Rotavirus-host cell interactions: an arms race”. Current Opinion in Virology 2 (4), 389–98. o. DOI:10.1016/j.coviro.2012.05.001. PMID 22658208.
- ↑ a b (2009) „Rotavirus vaccines and pathogenesis: 2008”. Current Opinion in Gastroenterology 25 (1), 36–43. o. [2013. május 11-i dátummal az eredetiből archiválva]. DOI:10.1097/MOG.0b013e328317c897. PMID 19114772. (Hozzáférés: 2018. augusztus 22.)
- ↑ (1996) „Phosphorylation generates different forms of rotavirus NSP5”. Journal of General Virology 77 (9), 2059–65. o. [2012. május 26-i dátummal az eredetiből archiválva]. DOI:10.1099/0022-1317-77-9-2059. PMID 8811003.
- ↑ (2007) „Characterization of the NSP6 protein product of rotavirus gene 11”. Virus Research 130 (1–2), 193–201. o. DOI:10.1016/j.virusres.2007.06.011. PMID 17658646.
- ↑ (2001) „Nucleotide sequence analysis of rotavirus gene 11 from two tissue culture-adapted ATCC strains, RRV and Wa”. Virus Genes 23 (3), 321–9. o. DOI:10.1023/A:1012577407824. PMID 11778700.
- ↑ Rotavirus cell entry, Cell Entry by Non-Enveloped Viruses, Current Topics in Microbiology and Immunology, 121–48. o.. DOI: 10.1007/82_2010_34 (2010). ISBN 978-3-642-13331-2
- ↑ (2016) „The Rotavirus Interferon Antagonist NSP1: Many Targets, Many Questions”. Journal of Virology 90 (11), 5212–5. o. DOI:10.1128/JVI.03068-15. PMID 27009959.
- ↑ (2004) „Rotavirus replication: plus-sense templates for double-stranded RNA synthesis are made in viroplasms”. Journal of Virology 78 (14), 7763–74. o. DOI:10.1128/JVI.78.14.7763-7774.2004. PMID 15220450.
- ↑ (2004) „Replication and transcription of the rotavirus genome”. Current Pharmaceutical Design 10 (30), 3769–77. o. DOI:10.2174/1381612043382620. PMID 15579070.
- ↑ (2009) „Molecular biology of rotavirus entry and replication”. The Scientific World Journal 9, 1476–97. o. DOI:10.1100/tsw.2009.158. PMID 20024520.
- ↑ (1993) „Prevalence of rotavirus on high-risk fomites in day-care facilities”. Pediatrics 92 (2), 202–5. o. PMID 8393172.
- ↑ a b Dennehy PH (2000). „Transmission of rotavirus and other enteric pathogens in the home”. Pediatric Infectious Disease Journal 19 (Suppl 10), S103–5. o. DOI:10.1097/00006454-200010001-00003. PMID 11052397.
- ↑ (1984) „Isolation of enteroviruses from water, suspended solids, and sediments from Galveston Bay: survival of poliovirus and rotavirus adsorbed to sediments” (PDF). Applied and Environmental Microbiology 48 (2), 404–9. o. [2011. szeptember 27-i dátummal az eredetiből archiválva]. PMID 6091548. (Hozzáférés: 2018. augusztus 22.)
- ↑ (1999) „Rotavirus vaccine, live, oral, tetravalent (RotaShield)”. Pediatric Nursing 25 (2), 203–4, 207. o. PMID 10532018.
- ↑ (1990) „Rotavirus”. Baillière's Clinical Gastroenterology 4 (3), 609–25. o. DOI:10.1016/0950-3528(90)90052-I. PMID 1962726.
- ↑ (2006) „Rotavirus vaccines: current prospects and future challenges”. The Lancet 368 (9532), 323–32. o. DOI:10.1016/S0140-6736(06)68815-6. PMID 16860702.
- ↑ Offit PA. Gastroenteritis viruses. New York: Wiley, 106–124. o. (2001). ISBN 0-471-49663-4
- ↑ Epidemiology of Group A Rotaviruses: Surveillance and Burden of Disease Studies, Rotaviruses: Methods and Protocols, Methods in Molecular Medicine. Totowa, NJ: Humana Press, 217. o.. DOI: 10.1385/1-59259-078-0:217 (2000). ISBN 0-89603-736-3
- ↑ a b (2004) „Rotavirus infection in adults”. The Lancet Infectious Diseases 4 (2), 91–9. o. DOI:10.1016/S1473-3099(04)00928-4. PMID 14871633.
- ↑ (2017) „Relevance of secretor status genotype and microbiota composition in susceptibility to rotavirus and norovirus infections in humans”. Scientific Reports 7, 45559. o. DOI:10.1038/srep45559. PMID 28358023.
- ↑ (2009) „Rotaviruses: from pathogenesis to vaccination”. Gastroenterology 136 (6), 1939–51. o. DOI:10.1053/j.gastro.2009.02.076. PMID 19457420.
- ↑ Rotavirus pathology and pathophysiology, Rotaviruses, Current Topics in Microbiology and Immunology. New York: Springer, 255–83. o. (1994). ISBN 9783540567615
- ↑ (2006) „Rotavirus viremia and extraintestinal viral infection in the neonatal rat model”. Journal of Virology 80 (10), 4820–32. o. DOI:10.1128/JVI.80.10.4820-4832.2006. PMID 16641274.
- ↑ (2004) „Pathogenesis of intestinal and systemic rotavirus infection”. Journal of Virology 78 (19), 10213–20. o. DOI:10.1128/JVI.78.19.10213-10220.2004. PMID 15367586.
- ↑ (2010) „Rotavirus disrupts calcium homeostasis by NSP4 viroporin activity”. mBio 1 (5). DOI:10.1128/mBio.00265-10. PMID 21151776.
- ↑ (2006) „Rotavirus NSP4 induces a novel vesicular compartment regulated by calcium and associated with viroplasms”. Journal of Virology 80 (12), 6061–71. o. DOI:10.1128/JVI.02167-05. PMID 16731945.
- ↑ (2012) „Towards a human rotavirus disease model”. Current Opinion in Virology 2 (4), 408–18. o. DOI:10.1016/j.coviro.2012.05.006. PMID 22722079.
- ↑ Farnworth ER (2008). „The evidence to support health claims for probiotics”. The Journal of Nutrition 138 (6), 1250S–4S. o. PMID 18492865.
- ↑ (2003) „Health aspects of probiotics”. IDrugs : the Investigational Drugs Journal 6 (6), 573–80. o. PMID 12811680.
- ↑ Arya SC (1984). „Rotaviral infection and intestinal lactase level”. Journal of Infectious Diseases 150 (5), 791. o. DOI:10.1093/infdis/150.5.791. PMID 6436397.
- ↑ (2009) „Mechanisms of protection against rotavirus infection and disease”. The Pediatric Infectious Disease Journal 28 (Suppl 3), S57–9. o. DOI:10.1097/INF.0b013e3181967c16. PMID 19252425.
- ↑ (2012) „IgY antibodies protect against human Rotavirus induced diarrhea in the neonatal gnotobiotic piglet disease model”. PLOS One 7 (8), e42788. o. DOI:10.1371/journal.pone.0042788. PMID 22880110.
- ↑ (2017) „Contribution of Maternal Immunity to Decreased Rotavirus Vaccine Performance in Low- and Middle-Income Countries”. Clinical and Vaccine Immunology : CVI 24 (1). DOI:10.1128/CVI.00405-16. PMID 27847365.
- ↑ (2013) „Innate cellular responses to rotavirus infection”. The Journal of General Virology 94 (6), 1151–60. o. DOI:10.1099/vir.0.051276-0. PMID 23486667.
- ↑ a b (2016) „Intestinal Innate Antiviral Immunity and Immunobiotics: Beneficial Effects against Rotavirus Infection”. Frontiers in Immunology 7, 563. o. DOI:10.3389/fimmu.2016.00563. PMID 27994593.
- ↑ (1994) „Rotaviruses: immunological determinants of protection against infection and disease”. Advances in Virus Research 44, 161–202. o. DOI:10.1016/S0065-3527(08)60329-2. PMID 7817873.
- ↑ (2013) „A systematic review of anti-rotavirus serum IgA antibody titer as a potential correlate of rotavirus vaccine efficacy”. The Journal of Infectious Diseases 208 (2), 284–94. o. DOI:10.1093/infdis/jit166. PMID 23596320.
- ↑ a b (2007) „Routine laboratory testing data for surveillance of rotavirus hospitalizations to evaluate the impact of vaccination”. The Pediatric Infectious Disease Journal 26 (10), 914–9. o. DOI:10.1097/INF.0b013e31812e52fd. PMID 17901797.
- ↑ The Pediatric ROTavirus European CommitTee (PROTECT) (2006). „The paediatric burden of rotavirus disease in Europe”. Epidemiology and Infection 134 (5), 908–16. o. DOI:10.1017/S0950268806006091. PMID 16650331.
- ↑ Desk Encyclopedia of Human and Medical Virology. Boston: Academic Press, 278. o. (2009). ISBN 0-12-375147-0
- ↑ Gastroenteritis viruses. New York: Wiley, 14. o. (2001). ISBN 0-471-49663-4
- ↑ (2004) „Rotavirus typing methods and algorithms”. Reviews in Medical Virology 14 (2), 71–82. o. DOI:10.1002/rmv.411. PMID 15027000.
- ↑ (2003) „Treatment of infectious diarrhea in children”. Paediatric Drugs 5 (3), 151–65. o. DOI:10.2165/00128072-200305030-00002. PMID 12608880.
- ↑ Sachdev HP (1996). „Oral rehydration therapy”. Journal of the Indian Medical Association 94 (8), 298–305. o. PMID 8855579.
- ↑ World Health Organization, UNICEF: Joint Statement: Clinical Management of Acute Diarrhoea. (Hozzáférés: 2012. május 3.)
- ↑ (2014) „European Society for Pediatric Gastroenterology, Hepatology, and Nutrition/European Society for Pediatric Infectious Diseases evidence-based guidelines for the management of acute gastroenteritis in children in Europe: update 2014”. Journal of Pediatric Gastroenterology and Nutrition 59 (1), 132–52. o. DOI:10.1097/MPG.0000000000000375. PMID 24739189.
- ↑ (2015) „Efficacy of probiotic use in acute rotavirus diarrhea in children: A systematic review and meta-analysis”. Caspian Journal of Internal Medicine 6 (4), 187–95. o. PMID 26644891.
- ↑ Ramig RF (2007. április 25.). „Systemic rotavirus infection”. Expert Review of Anti-infective Therapy 5 (4), 591–612. o. DOI:10.1586/14787210.5.4.591. PMID 17678424.
- ↑ (1999) „Rotavirus vaccine for the prevention of rotavirus gastroenteritis among children. Recommendations of the Advisory Committee on Immunization Practices (ACIP)”. MMWR. Recommendations and Reports : Morbidity and Mortality Weekly Report. Recommendations and Reports 48 (RR-2), 1–20. o. PMID 10219046.
- ↑ Kapikian AZ (2001). „A rotavirus vaccine for prevention of severe diarrhoea of infants and young children: development, utilization and withdrawal”. Novartis Foundation Symposium 238, 153–71; discussion 171–9. o. DOI:10.1002/0470846534.ch10. PMID 11444025.
- ↑ Bines JE (2005). „Rotavirus vaccines and intussusception risk”. Current Opinion in Gastroenterology 21 (1), 20–5. o. [2013. május 11-i dátummal az eredetiből archiválva]. PMID 15687880. (Hozzáférés: 2018. augusztus 22.)
- ↑ Bines J (2006). „Intussusception and rotavirus vaccines”. Vaccine 24 (18), 3772–6. o. DOI:10.1016/j.vaccine.2005.07.031. PMID 16099078.
- ↑ Dennehy PH (2008). „Rotavirus vaccines: an overview”. Clinical Microbiology Reviews 21 (1), 198–208. o. [2011. szeptember 28-i dátummal az eredetiből archiválva]. DOI:10.1128/CMR.00029-07. PMID 18202442. (Hozzáférés: 2018. augusztus 22.)
- ↑ (2010) „Global impact of rotavirus vaccines”. Expert Review of Vaccines 9 (4), 395–407. o. DOI:10.1586/erv.10.17. PMID 20370550.
- ↑ (2014. április 25.) „Rotavirus Vaccines in Routine Use”. Clinical Infectious Diseases 59 (9), 1291–1301. o. DOI:10.1093/cid/ciu564. PMID 25048849.
- ↑ (2010) „Effect of Rotavirus Vaccination on Death From Childhood Diarrhea in Mexico”. The New England Journal of Medicine 362 (4), 299–305. o. DOI:10.1056/NEJMoa0905211. PMID 20107215.
- ↑ (2012) „Duration of protection of pentavalent rotavirus vaccination in Nicaragua”. Pediatrics 130 (2), e365–72. o. DOI:10.1542/peds.2011-3478. PMID 22753550.
- ↑ (2011) „Real World Impact of Rotavirus Vaccination”. Pediatric Infectious Disease Journal 30 (1), S1. o. DOI:10.1097/INF.0b013e3181fefa1f. PMID 21183833. (Hozzáférés: 2012. május 8.)
- ↑ Neuzil KM, Armah GE, Parashar UD, Steele AD (2010. április 25.). „Rotavirus Infection in Africa: Epidemiology, Burden of Disease, and Strain Diversity”. Journal of Infectious Diseases 202 (Suppl 1), S1-S265. o. DOI:10.1086/653545.
- ↑ (2009. április 25.) „Rotavirus in Asia: Updates on Disease Burden, Genotypes and Vaccine Introduction”. Vaccine 27 (Suppl 5), F1-F138. o.
- ↑ World Health Organization (2009). „Rotavirus vaccines: an update”. Weekly Epidemiological Record 51–52 (84), 533–40. o. (Hozzáférés: 2012. május 8.)
- ↑ (2015) „Effectiveness and impact of rotavirus vaccines in Europe, 2006–2014”. Vaccine 33 (18), 2097–107. o. DOI:10.1016/j.vaccine.2015.03.016. PMID 25795258.
- ↑ (2017) „Global Impact of Rotavirus Vaccination on Childhood Hospitalizations and Mortality from Diarrhea”. The Journal of Infectious Diseases 215 (11), 1666–72. o. DOI:10.1093/infdis/jix186. PMID 28430997.
- ↑ Kötelezővé tennék az oltást a gyermekorvosok Archiválva 2018. augusztus 22-i dátummal a Wayback Machine-ben Világgazdaság 2017.05.17.
- ↑ Rotavirus vaccination programme for infants (angol nyelven). www.gov.uk . Public Health England
- ↑ (2005) „Rotavirus gastroenteritis”. Advances in Therapy 22 (5), 476–87. o. DOI:10.1007/BF02849868. PMID 16418157.
- ↑ (2006) „Rotavirus and severe childhood diarrhea”. Emerging Infectious Diseases 12 (2), 304–6. o. DOI:10.3201/eid1202.050006. PMID 16494759.
- ↑ (2012) „2008 estimate of worldwide rotavirus-associated mortality in children younger than 5 years before the introduction of universal rotavirus vaccination programmes: a systematic review and meta-analysis”. The Lancet Infectious Diseases 12 (2), 136–41. o. DOI:10.1016/S1473-3099(11)70253-5. PMID 22030330.
- ↑ (2006) „Economics of rotavirus gastroenteritis and vaccination in Europe: what makes sense?”. Pediatric Infectious Diseases Journal 25 (Suppl 1), S48–55. o. DOI:10.1097/01.inf.0000197566.47750.3d. PMID 16397429.
- ↑ Hospital admissions attributable to rotavirus infection in England and Wales, S12–8. o.. DOI: 10.1093/infdis/174.Supplement_1.S12 (1996)
- ↑ (2010) „Temperature-dependent transmission of rotavirus in Great Britain and The Netherlands”. Proceedings of the Royal Society B: Biological Sciences 277 (1683), 933–42. o. DOI:10.1098/rspb.2009.1755. PMID 19939844.
- ↑ (2009) „Seasonality of rotavirus disease in the tropics: a systematic review and meta-analysis”. International Journal of Epidemiology 38 (6), 1487–96. o. DOI:10.1093/ije/dyn260. PMID 19056806.
- ↑ (2015) „Control of the spread of viruses in a long-term care facility using hygiene protocols”. American Journal of Infection Control 43 (7), 702–6. o. DOI:10.1016/j.ajic.2015.03.012. PMID 25944726.
- ↑ (1984) „A community waterborne gastroenteritis outbreak: evidence for rotavirus as the agent”. American Journal of Public Health 74 (3), 263–5. o. DOI:10.2105/AJPH.74.3.263. PMID 6320684.
- ↑ (2007) „Mutated G4P[8] rotavirus associated with a nationwide outbreak of gastroenteritis in Nicaragua in 2005”. Journal of Clinical Microbiology 45 (3), 990–7. o. [2011. szeptember 27-i dátummal az eredetiből archiválva]. DOI:10.1128/JCM.01992-06. PMID 17229854. (Hozzáférés: 2018. augusztus 22.)
- ↑ (1981) „An outbreak of rotavirus diarrhea among a non-immune, isolated South American Indian community”. American Journal of Epidemiology 113 (6), 703–10. o. DOI:10.1093/oxfordjournals.aje.a113151. PMID 6263087.
- ↑ (1984) „Waterborne outbreak of rotavirus diarrhea in adults in China caused by a novel rotavirus”. The Lancet 323 (8387), 1139–42. o. DOI:10.1016/S0140-6736(84)91391-6. PMID 6144874.
- ↑ (1989) „Investigation of an outbreak of adult diarrhea rotavirus in China”. Journal of Infectious Diseases 160 (6), 948–53. o. DOI:10.1093/infdis/160.6.948. PMID 2555422.
- ↑ (2004) „Group B rotaviruses similar to strain CAL-1, have been circulating in Western India since 1993”. Epidemiology and Infection 132 (4), 745–9. o. DOI:10.1017/S0950268804002171. PMID 15310177.
- ↑ (2004) „Genetic analysis of group B human rotaviruses detected in Bangladesh in 2000 and 2001”. Journal of Medical Virology 72 (1), 149–55. o. DOI:10.1002/jmv.10546. PMID 14635024.
- ↑ (1989) „Seroepidemiology of adult diarrhea rotavirus in China, 1977 to 1987”. Journal of Clinical Microbiology 27 (10), 2180–3. o. PMID 2479654.
- ↑ (2011) „First detection of group C rotavirus in children with acute gastroenteritis in South Korea”. Clinical Microbiology and Infection 17 (2), 244–7. o. DOI:10.1111/j.1469-0691.2010.03270.x. PMID 20491826.
- ↑ a b (2010) „Zoonotic aspects of rotaviruses”. Veterinary Microbiology 140 (3–4), 246–55. o. DOI:10.1016/j.vetmic.2009.08.028. PMID 19781872.
- ↑ (2007) „Rotaviruses: diversity and zoonotic potential—a brief review”. Berliner Und Munchener Tierarztliche Wochenschrift 120 (3–4), 108–12. o. PMID 17416132.
- ↑ (2004) „The zoonotic potential of rotavirus”. The Journal of Infection 48 (4), 289–302. o. DOI:10.1016/j.jinf.2004.01.018. PMID 15066329.
- ↑ (2015) „Zoonotic transmission of rotavirus: surveillance and control”. Expert Review of Anti-infective Therapy 13 (11), 1337–50. o. DOI:10.1586/14787210.2015.1089171. PMID 26428261.
- ↑ (1943) „Studies on Epidemic Diarrhea of the New-born: Isolation of a Filtrable Agent Causing Diarrhea in Calves”. American Journal of Public Health and the Nation's Health 33 (12), 1451–4. o. DOI:10.2105/AJPH.33.12.1451. PMID 18015921.
- ↑ (1976) „Diarrhea in gnotobiotic calves caused by the reovirus-like agent of human infantile gastroenteritis” (PDF). Infection and Immunity 14 (2), 471–4. o. [2011. szeptember 29-i dátummal az eredetiből archiválva]. PMID 184047. (Hozzáférés: 2018. augusztus 22.)
- ↑ (1971) „The growth of the virus of epidemic diarrhoea of infant mice (EDIM) in organ cultures of intestinal epithelium”. British Journal of Experimental Pathology 52 (4), 442–5. o. PMID 4998842.
- ↑ (1976) „Morphological and antigenic relationships between viruses (rotaviruses) from acute gastroenteritis in children, calves, piglets, mice, and foals” (PDF). Infection and Immunity 14 (3), 804–10. o. [2011. szeptember 29-i dátummal az eredetiből archiválva]. PMID 965097. (Hozzáférés: 2018. augusztus 22.)
- ↑ (1974) „Relation between viruses from acute gastroenteritis of children and newborn calves”. The Lancet 304 (7872), 61–3. o. DOI:10.1016/S0140-6736(74)91631-6. PMID 4137164.
- ↑ (1988) „The antigenic diversity of rotaviruses: significance to epidemiology and vaccine strategies”. European Journal of Epidemiology 4 (1), 1–11. o. DOI:10.1007/BF00152685. PMID 2833405.
- ↑ (1981) „Sequential passages of human rotavirus in MA-104 cells”. Microbiology and Immunology 25 (10), 1025–35. o. DOI:10.1111/j.1348-0421.1981.tb00109.x. PMID 6273696.
- ↑ (2009) „Rotarix: a rotavirus vaccine for the world”. Clinical Infectious Diseases 48 (2), 222–8. o. DOI:10.1086/595702. PMID 19072246.
Fordítás[szerkesztés]
- Ez a szócikk részben vagy egészben a Rotavirus című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
További információk[szerkesztés]
- WHO Rotavirus web page (angol nyelven). www.who.int. WHO. (Hozzáférés: 2018. október 6.)
- Rotavirus (angol nyelven). cdc.gov. Centers for Disease Control and Prevention (CDC). (Hozzáférés: 2018. október 6.)
- Viralzone: Rotavirus (angol nyelven). www.expasy.org. (Hozzáférés: 2018. október 6.)
- Vaccine Resource Library: Rotavirus (angol nyelven). path.org. (Hozzáférés: 2018. október 6.)
- De Feat (angol nyelven). DefeatDD.org. (Hozzáférés: 2018. október 6.)
- Centers for Disease Control and Prevention. Ch. 18: Rotavirus, Epidemiology and Prevention of Vaccine-Preventable Diseases [archivált változat], 12th, Washington DC: Public Health Foundation, 263–274. o. (2012). Hozzáférés ideje: 2018. augusztus 22. [archiválás ideje: 2017. március 10.] Archiválva 2017. március 10-i dátummal a Wayback Machine-ben
- 3D macromolecular structures of Rotaviruses from the EM Data Bank(EMDB) (angol nyelven). www.pdbe.org. (Hozzáférés: 2018. október 6.)
- ROTA Council (angol nyelven). rotacouncil.org. (Hozzáférés: 2018. október 6.)
- Rotavírus-fertőzés okai, szövődményei és kezelése. mtaki.hu. [2018. október 6-i dátummal az eredetiből archiválva]. (Hozzáférés: 2018. október 6.)


