Tripszin
| Tripszin-1 | |
 | |
| Azonosítók | |
| Jel | PRSS1, TRY1 |
| HGNC | 9475 |
| OMIM | 276000 |
| UniProt | P07477 |
| PDB | 1fxy |
| Egyéb adatok | |
| Lokusz | 7. krom. q34 |
A humán tripszinek közé 3 emésztőenzim tartozik, melyek a vékonybélben fehérjéket bontanak, így peptidázok. Ezek a tripszin-1 (kationos tripszin), a tripszin-2 (anionos tripszin) és a tripszin-3 (mezotripszin). Sok hasonló enzim van jelen emlősökben, rovarokban, halakban és gombákban, melyeket szintén tripszineknek neveznek.
A tripszin-1-hiány fehérjehiányhoz vezet. Ennek oka lehet a TRY1 gén mutációja, mely hasnyálmirigy-gyulladást okozhat, ahol a saját tripszin-1 nem tud lebomlani, így a hasnyálmirigyet bontja. A tripszin-2 génjének mutációja krónikus hasnyálmirigy-gyulladáshoz vezethet.[1]
Bioszintézis[szerkesztés]
A tripszin, chimotripszin és a karboxipeptidázok inaktív zimogénként jönnek létre a hasnyálmirigyben. A bélhámhoz kapcsolódó enteropeptidáz irányítja a tripszinogén tripszinné alakulását. A tripszin magától aktiválódik (pozitív visszacsatolás) és a chimotripszinogént, a proelasztázt, a prokarboxipeptidázt és további inaktív enzimeket aktív változatokká (chimotripszin, elasztáz, karboxipeptidáz) alakít.
Funkció[szerkesztés]
A tripszin endopeptidáz: a fehérjéket meghatározott helyeken bontja. A tripszin szerinproteáz. A bázikus aminosavakat, a lizint, az arginint és a módosult ciszteint választja le a fehérjéről. A proteinázok nem adott fehérjékre specializálódnak, hanem meghatározott aminosav-sorozatokra (szerkezeti jellemzőkre), ami az emésztés szempontjából fontos, különben a vékonybélben minden adott fehérjéhez önálló enzim kellene.
Az endopeptidázok fontos anyagok a kémiai-analitikai fehérjeszekvenáláshoz. A denaturált fehérjék könnyen hidrolizálnak, vízmolekulákat megkötve.
Hasonló a gyomorfal által elválasztott pepszin funkciója.
A tripszin pH-optimuma 8-8,5.[2] Gyakori tévhit, hogy a tripszin pH-optimuma a vékonybélnek felel meg.[3] A vékonybél kémhatása ugyanis savas–enyhén lúgos.[4][5]
Története[szerkesztés]
Gyulladásnál használatos enzim[szerkesztés]
A tripszin hatását a lárvaterápiában Ambroise Paré, Dominique-Jean Larrey és William Stevenson Baer is leírták. Ebben – Arthur Läwen szerint hatástalan – lárvakivonatot használnak.[6]
A tripszint 1857-ben fedezte fel Lucien Corvisart, 1867-ben Wilhelm Kühne izolálta és nevezte el.[7]:90 1955-től garat-, orr- és felső légúti gyulladásoknál használatos.[6]
1954-ben Irving Innerfield intramuszkuláris tripszininjekcióval kísérelt meg diabétesz okozta szöveti gyulladásokat és fekélyeket gyógyítani.[6]
Emésztőenzimként[szerkesztés]
A tripszin proteolitikus tulajdonságait 1836-ban figyelte meg Jan Evangelista Purkyně és Seligmann Simon Pappenheim, 1856-ban Claude Bernard. Lucien Corvisart 1857-ben több kísérletet végzett kutyák és bárányok hasnyálmirigy-szekrétumaival a hatás pontosabb leírásához.[6]
1862-ben Alekszandr Jakovlevics Danyilevszkij a tripszint homokkal és kovafölddel való dörzsöléssel és kolloidba helyezéssel izolálta. 1875-ben Rudolf Heidenhain felfedezte, hogy a hasnyálmirigy sejtjeiben inaktív formában van jelen a tripszin, és a duodenumba való ürüléskor válik csak aktívvá.[7]:90 Wilhelm Kühne nevezte el végül a fehérjét.[6]
1899-ben Ivan Petrovics Pavlov felfedezte, hogy a vékonybélszekrétum a tripszinogént aktiválja. Ezt az enzimet enterokináznak nevezte el.[6]
Hogy a szekretin felelős a hasnyálszekrécióért, Ernest Henry Starling és William Maddock Bayliss fedezték fel 1902-ben. Hogy a tripszin és a pepszin két eltérő enzim, Emil Aberhalden, V. Hemtiquez és Frankel fedezték fel egymástól függetlenül.[6]
1930-ban Ernst Kurt Frey, Heinrich Kraut és Eugen Werle felfedeztek egy tripszininhibitort.[7]:92 1931-ben John Howard Northrop meghatározta a tripszin kristályszerkezetét.[6]
1941-ben McClean és Hale felismerték, hogy a tripszin képes a bakteriális fertőzés előrehaladását egy szövetben lassítani a bakteriális hialuronidáz gátlásával. Így antibiotikumokkal es die bakterielle Hyaluronidase inaktiviert. So wurde es in Kombination mit Antibiotika erfolgreich gegen lokale Entzündungen angewendet. Aufzeichnungen hierzu gibt es bei Greuer und Hess aus dem Jahr 1954.[6]
Rákterápia[szerkesztés]
1906-ban tripszint használt John Beard neopláziákra, eredményeit The Enzyme treatment of cancer című munkájában írta le. Ugyanekkor intratumorális injekciót alkottak Ferdinand Blumenthal, William Allan Pusey és P. T. Hald tumorok enyhítésére. A brit orvosok ipari preparátumot hoztak létre, további betegeket kezelve velük. Mivel az enzimek szobahőmérsékleten aktivitásukat elvesztik, nem történt hatás, így a terápiás javaslatot elvetették.
Használat[szerkesztés]
A sejtkultúra-laboratóriumokban a tripszint tripszinizációra használják adherens sejtek kultúraedények aljáról való feloldására, illetve sejtek szétválasztására. Ha a sejtek tripszinkezelése nem túl hosszú, nem károsodnak, és csak a sejteken kívüli fehérjék denaturálódnak.
A proteomikában a tripszin a leggyakrabban használt proteáz tömegspektrometriai analízisre történő peptid-előkészítésre, például gélben történő emésztéshez.
A kariogram formájában történő kromoszóma-analízishez a GTG-sávozási technikához a kromoszómákat tripszinnel kezelik, és Giemsával színezik.[8]
A gyógyszerészetben a tripszint csak kombinált készítményekben használják. Példák erre az Alphintern, a Phlogenzym és a Wobenzym N.[6]
Ellenőrző reakció[szerkesztés]
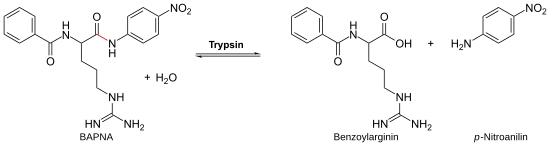
A tripszinaktivitás N-benzoil-d,l-arginin-p-nitroaniliddel (BAPNA) ellenőrizhető. Ekkor a BAPNA-t a tripszin az argininnál csapja ki, és p-nitroanilin keletkezik. Az így megnövekedő p-nitroanilin-koncentráció405 nm hullámhossz mellett követhető spektroszkópiával.
Jegyzetek[szerkesztés]
- ↑ OMIM: Trypsin-1
- ↑ Tibor Sipos, Joseph R. Merkel (1970). „Effect of calcium ions on the activity, heat stability, and structure of trypsin” 9 (14), 2766–2775. o. DOI:10.1021/bi00816a003.
- ↑ Laurence A. Moran: On the meaning of pH optima for enzyme activity. Sandwalk, 2014. december 9. (Hozzáférés: 2016. november 23.)
- ↑ J. Fallingborg (1999). „Intraluminal pH of the human gastrointestinal tract” 46 (3), 183–196. o. ISSN 0907-8916. PMID 10421978.
- ↑ L. Ovesen, F. Bendtsen, U. Tage-Jensen, N. T. Pedersen, B. R. Gram, S. J. Rune (1986). „Intraluminal pH in the stomach, duodenum, and proximal jejunum in normal subjects and patients with exocrine pancreatic insufficiency” 90 (4), 958–962. o. PMID 3949122.
- ↑ a b c d e f g h i j Wolf-Dieter Müller-Jahncke, Christoph Friedrich, Ulrich Meyer. Arzneimittelgeschichte, 2., átdolgozott, bővített kiadás, Stuttgart: Wissenschaftliche Verlagsgesellschaft mbH, 110. o. (2005). ISBN 978-3-8047-2113-5
- ↑ a b c K. Zimmermann.szerk.: Franz Xaver Sailer, Friedrich Wilhelm Gierhake: Bauchspeicheldrüse. Deisenhofen bei München: Dustri-Verlag (1973). ISBN 3-87185-021-7
- ↑ GTG-Bänderung (G-bands by trypsin using Giemsa).[halott link] Institut für Humangenetik im Universitätsklinikum Jena, hozzáférés dátuma: 2011. március 14.
Fordítás[szerkesztés]
Ez a szócikk részben vagy egészben a Trypsine című német Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Források[szerkesztés]
- Jennifer McDowall/Interpro: Protein Of The Month: Trypsin and Chymotrypsin. (angolul)
