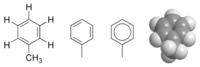
Toluol
| Toluol | |||
| |||

| |||
| Más nevek | fenilmetán toluol metilbenzol | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 108-88-3 | ||
| ChemSpider | 1108 | ||
| RTECS szám | XS5250000 | ||
| |||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C7H8 | ||
| Moláris tömeg | 92,14 g/mol | ||
| Megjelenés | színtelen folyadék | ||
| Sűrűség | 0,8669 g/ml (folyadék) | ||
| Olvadáspont | −93 °C | ||
| Forráspont | 110,6 °C | ||
| Oldhatóság (vízben) | 0,52 g/l (20 °C-on)[1] | ||
| Viszkozitás | 0,590 cP (20 °C-on) | ||
| Kristályszerkezet | |||
| Dipólusmomentum | 0,36 D | ||
| Veszélyek | |||
| MSDS | ScienceLab.com | ||
| Főbb veszélyek | Gyúlékony (F) Ártalmas (Xn)[2] | ||
| NFPA 704 | |||
| R mondatok | R11, R38, R48/20, R63, R65, R67[2] | ||
| S mondatok | (S2), S36/37, S62[2] | ||
| Lobbanáspont | 4 °C | ||
| LD50 | 636 mg/kg (patkány, szájon át)[3] | ||
| Rokon vegyületek | |||
| Rokon aromás szénhidrogének | benzol xilol naftalin | ||
| Rokon vegyületek | metilciklohexán | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A toluol (vagy metilbenzol) aromás szénhidrogén, a benzolhoz képest csak egyetlen metilcsoportban tér el. Színtelen folyadék, szaga a benzoléra emlékeztet. Apoláris vegyület, vízben nem oldódik. Szerves oldószerekkel korlátlanul elegyedik. A toluol maga is kitűnő oldószer. A benzol homológja, tulajdonságai is a benzoléhoz hasonlók. Képes feloldani bizonyos műanyagokat. Szobahőmérsékleten erősen párolog.
Nevét a tolubalzsamról(en) kapta, amiből először előállították.[4]
Kémiai tulajdonságai[szerkesztés]
Metilcsoportjának köszönhetően sokkal reaktívabb, mint a benzol. Oxidációs reakciókban benzoesavvá vagy benzaldehiddé alakul. Az oxidálószer például forró, híg salétromsav vagy kálium-permanganát lehet,[5] ekkor benzoesav keletkezik.
A toluol az oldalláncon (metilcsoport) vagy az aromás gyűrűn (magban) is halogénezhető (a reakciófeltételektől függően). A forró, napfénnyel vagy UV-fénnyel megvilágított toluol klórgáz hatására – gyökös szubsztitúciós reakcióban – az oldalláncon halogéneződik. A metilcsoport egy, két, vagy mindhárom hidrogénatomja klóratomra cserélhető (a behatás idejétől függően), ekkor benzil-klorid, benzál-klorid vagy benzotriklorid keletkezik. Szobahőmérsékleten katalizátor, például vas(III)-klorid jelenlétében a szubsztitúció a benzolgyűrűn megy végbe, orto-, és para-klórtoluol keletkezik.[5]
A nitrálás és a szulfonálás is könnyebben megy végbe a toluol esetén mint a benzolnál. Nitráláskor orto- és para-nitrotoluol keletkezik, de erélyesebb behatáskor akár három nitrocsoport is bekapcsolódhat,[5] ekkor trinitrotoluol (TNT) keletkezik.
Élettani hatása[szerkesztés]
Közvetlen belélegezve közepesen vagy erősen mérgező. Az agyat és idegrendszert károsítja, részegséghez hasonló állapotot, nem ritkán hallucinációt okoz. Ipari felhasználására szigorú munkavédelmi előírások vonatkoznak. Az egyik leggyakrabban előforduló talajszennyező anyag, a talajvízzel is bejuthat a szervezetbe.
Előállítása[szerkesztés]
A toluolt kőolajpárlatok vagy n-heptán dehidroaromatizálásával nyerik. De benzolból is előállítható toluol Friedel–Crafts-szintézissel. Előállítható frakcionált lepárlással kőszénkátrányból is.[5]

Felhasználása[szerkesztés]
Festékek, lakkok oldószereként alkalmazzák, a TNT gyártásának egyik alapanyaga. Szerves szintézisek kiindulóanyagaként hasznosítják. Néhány háztartásban előforduló termék összetevője is lehet, például lakkok, gyorsan száradó filctollak.
Jegyzetek[szerkesztés]
- ↑ A toluol vegyülethez tartozó bejegyzés az IFA GESTIS adatbázisából. A hozzáférés dátuma: 2018-06-27 (JavaScript szükséges) (angolul)
- ↑ a b c A toluol (ESIS)[halott link]
- ↑ A toluol vegyülethez tartozó bejegyzés az IFA GESTIS adatbázisából. A hozzáférés dátuma: 2010. november 6. (JavaScript szükséges) (angolul)
- ↑ Fülöp József: Rövid kémiai értelmező és etimológiai szótár. Celldömölk: Pauz–Westermann Könyvkiadó Kft. 1998. 142. o. ISBN 963 8334 96 7
- ↑ a b c d Bruckner Győző. Szerves kémia, II-1 kötet. Budapest: Tankönyvkiadó (1979). ISBN 963 17 3779 9


