Víz
| Víz | |

| |
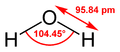 A vízmolekula szerkezete |
 A vízmolekula 3D modellje |
| IUPAC-név | víz oxidán[1] |
| Más nevek | dihidrogén-monoxid, hidrogén-hidroxid, aqua (latin) |
| Kémiai azonosítók | |
| CAS-szám | 7732-18-5 |
| RTECS szám | ZC0110000 |
| Kémiai és fizikai tulajdonságok | |
| Kémiai képlet | H2O |
| Moláris tömeg | 18,01528(33) g/mol |
| Megjelenés | színtelen, szagtalan |
| Sűrűség | 0,99701 g/cm³[2] |
| Olvadáspont | 0 °C (273,15 K) (32 °F)[2] |
| Forráspont | 100 °C (373,15 K) (212 °F)[2] |
| Savasság (pKa) | 15,74 |
| Lúgosság (pKb) | 15,74 |
| Törésmutató (nD) | 1,3330 |
| Viszkozitás | 0,8903 cP[2] |
| Kristályszerkezet | |
| Kristályszerkezet | Hexagonális lásd jég |
| Molekulaforma | V alakú |
| Dipólusmomentum | 1,85 D |
| Termokémia | |
| Std. képződési entalpia ΔfH |
−285,85 kJ/mol[2] |
| Hőkapacitás, C | 75,28 J/mol·K |
| Veszélyek | |
| EU osztályozás | nincsenek veszélyességi szimbólumok[3] |
| Főbb veszélyek | Nincs |
| NFPA 704 | |
| R mondatok | nincs[3] |
| S mondatok | nincs[3] |
| LD50 | >90 ml/kg (patkány, szájon át)[4] |
| Rokon vegyületek | |
| Rokon vegyületek | nehézvíz |
| Az infoboxban SI-mértékegységek szerepelnek. Ahol lehetséges, az adatok standardállapotra (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. Az ezektől való eltérést egyértelműen jelezzük. | |
A víz, vagyis a dihidrogén-monoxid (latinul: aqua) a hidrogén és az oxigén vegyülete, kémiai képlete H2O. Színtelen, szagtalan, íztelen, folyékony kémiai anyag, melynek mikroorganizmusoktól mentes állapotban olvadáspontja 0 °C, forráspontja 101,3 kPa nyomáson 100 °C. Egészen −48 Celsius-fokig túlhűthető.[5]
A „víz” megnevezés általában a szobahőmérsékleten folyékony állapotra vonatkozik; szilárd halmazállapotban jégnek, légnemű halmazállapotban gőznek nevezik. A vizet dipólusmolekulák (poláris molekulák) alkotják: a vízmolekulák töltéseloszlása egyenetlen, aminek megfelelően két ellentétes töltésű pólus (dipólus) alakul ki bennük. A víz amfoter vegyület, ami azt jelenti, hogy viselkedhet savként és bázisként is.
A víz a földi élet egyik alapja, de gazdasági szempontból is kiemelkedően fontos. A vízi úton történő szállítás a kereskedelem és gazdaság gerincét képezi.[6] A természetes vizekből és akvakultúrákból származó halgazdaság volumene 2017-ben meghaladta a 170 millió tonnát.[7] Ugyanebben az évben a világszerte működő, összesen 21,9 GW kapacitású vízierőművek 4,185 terawattóra energiát termeltek.[8] Emellett a vizet hűtő- és fűtőberendezésekben, illetve hőerőművekben is használják. Vegyipari és gyógyszeripari alkalmazása is igen sokrétű. Egyrészt szervetlen és szerves[9] szintézisekben nélkülözhetetlen oldószer, reakcióközeg, illetve reagens. Alkánok vízgőzzel történő reformálása szintézisgázt[10] eredményez, vízgőz krakkolással pedig igen értékes olefineket (etilén, propilén) állítanak elő. A propán és propilén oxidációján alapuló akrilsav-szintézisben is jelentős szerepe van.[11][12][13] Intenzív kutatások irányulnak a hidrogén-peroxid vízből történő előállítására is.[14]
A vendéglátásban a vezetékes és palackozott ivóvízzel, a forrásvízzel, a szikvízzel, az ásványi anyaggal dúsított ivóvízzel, az ízesített vízzel, a természetes ásványvízzel és a gyógyvízzel találkozhatunk. Napjainkban az ivóvizet már előállítják, kitermelik, és csővezetékeken keresztül juttatják el a felhasználókig. Régen főleg kútból/gémeskútból húzták fel a vizet, bár még most is vannak ilyen kutak.
Előfordulása a Földön[szerkesztés]
- A víz a Föld felületén megtalálható egyik leggyakoribb anyag, a földi élet alapfeltétele.
- A Föld felületének 71%-át víz borítja, ennek kb. 2,5%-a édesvíz, a többi sós víz, melyek a tengerekben, illetve óceánokban helyezkednek el. Az édesvízkészlet gleccserek és állandó hótakaró formájában található részét nem számítva az édesvíz 98%-a felszín alatti víz, ezért különösen fontos a felszín alatti vizek védelme. Magyarország ivóvízellátásának több mint 95%-a felszín alatti vizeken alapszik. Kanada rendelkezik a legnagyobb édesvíz-tartalékokkal, a források 25%-ával.



Drasztikusan csökken a Föld ivóvízkészlete.[15] Korunknak egyik nagy problémája az ivóvízhiány. 2006-ban a mezőgazdaság felelős a globális vízfogyasztás mintegy 80%-áért.[16]
Geológiai értelemben a víz egyszerre két csoportba tartozik: ásvány és kőzet egyidejűleg.
Ásványként az oxidásványok ásványosztályba és annak 1. alosztályába (egyszerű oxidok közé) tartozik, és a SiO2-hoz hasonló tetraéderes elemi cellái hatszöges kristályrendszerű (hexagonális) kristálykifejlődést eredményeznek. Általános megjelenési formája a hatszöges oszlop lenne, ennek azonban leggyakoribb és legismertebb a kezdeti fázisa a hópihe, a hatszöges oszlop metszete.
Kőzetként monomineralikus, a hidrogén-oxid ásványból álló üledékes kőzet. Ezt nem befolyásolja a folyékony halmazállapot, ahogy a higany is lehet ásványos terméselem, sőt a földgáz is kőzetfajta.
Az ivóvíz[szerkesztés]
A közfogyasztású ivóvizek vizsgálatát és ellenőrzését Magyarországon az Országos Közegészségügyi Intézet, valamint a helyi Állami Népegészségügyi és Tisztiorvosi Szolgálat (ÁNTSZ) végzi. [1]
A közegészségügyi előírások a főzésre, mosogatásra, testi tisztálkodásra szolgáló víztől ugyanazokat a tulajdonságokat követelik meg, mint az ivóvíztől. Az előírások szerint az alábbi tulajdonságokkal kell rendelkeznie az ivóvíznek:
- Színtelen, átlátszó:
- a vas-oxid-hidrát vörösessé, az algák zöldessé, a tőzeges talaj sárgássá festi, míg az algák, baktériumok, agyag és homok zavarossá tehetik a vizet. A festékanyagok olyan színűre színezik a vizet, amilyen színűek.
- Szagtalan:
- A kén-hidrogén, klór, klórfenolok, szerves anyagok, gyári termékek és gázok élvezhetetlenné, nagyobb mértékben az egészségre is károssá tehetik a vizet.
- Kellemes ízű:
- A tőzeges talajból származó vizek úgynevezett mocsárízzel, a magnéziumsók keserű, salétromsavas sók édes, a kloridok sós, a vas tintaízű vizet eredményeznek.
- Kellemes hőfokú legyen:
- A legjobb a 10-14 °C-os ivóvíz.
- Ne legyen sem túl lágy, sem túl kemény:
- A víz keménységét a benne oldott kalcium- és magnéziumsók adják.
- Ne tartalmazzon az egészségre ártalmas szennyező, fertőző anyagokat:
- A vizsgálólaboratóriumok ki tudják mutatni a levegőből, a talajból bekerült szennyező anyagok mennyiségét. A vegyi anyagok közül a nitrát-, de különösen a nitritszennyeződés alkalmatlanná teszi, míg a nagyobb mennyiségű fluor a fogak elszíneződését, esetleg fogszuvasodást is okoz. A vas- és mangánszennyeződéseket levegőztetéssel, homokrétegen és aktívszénen való átszűréssel javítják. A jódhiánytól golyvát kaphatnak az emberek. Előfordulhat még a fekáliával való fertőzés, ilyen esetekben a kólibaktérium okozta hasmenéssel kell számolnunk, ennek megszüntetésére felforralják, ultraibolya fénnyel besugározzák, vagy ózonizálják, klórozzák, vagy ezüst elektrokatadinezésével tisztítják meg a vizet. A háztartási és ipari víztisztítás jelenleg igen elterjedt módszere még a fordított ozmózis elve alapján történő víztisztítás.
A 18. század előtti írásokban az édes (iható) vizeket jónak nevezték.
Az ivóvizek fajtái[szerkesztés]
- Vezetékes ivóvíz
- Palackozott ivóvíz
- Forrásvíz
- Szikvíz
- Ásványi anyaggal dúsított ivóvíz
- Ízesített víz
- Természetes ásványvíz
Élettani jelentősége[szerkesztés]
Biológiai jelentősége óriási, a földi élet elképzelhetetlen nélküle, a sejt- és testnedvek legnagyobb részét víz alkotja. A vér ozmózisnyomásának normál szinten tartásában is jelentős szerepe van. Ajánlott a napi legalább 1,5-2 liter folyadék elfogyasztása, ez alapvető igénye szervezetünknek. Két-három napnál tovább az orvostudomány mai állása szerint az ember nem élheti túl a vízhiányt.
A víz rendkívül fontos szerepet betöltő kémiai anyag, a Föld vízburkát alkotja, kitölti a világ óceánjait és tengereit, az ásványok és kőzetek alkotórésze, a növényi és állati szervezetek pótolhatatlan része. Nagyon fontos az iparban, a mezőgazdaságban, a háztartásokban, a laboratóriumokban stb.
A vizekben élő állatok számára nélkülözhetetlen. Az oldott oxigént lélegzik kopoltyújukkal, másrészt télen, mivel 4 °C-on a legsűrűbb, a 4 °C-os víz a vizek aljára süllyed, és ezek után nem érintkezik a hideg levegővel, ezért nem fagy meg. Így az állatok áttelelhetnek megfagyás nélkül a tavak alsó részeiben.
Az alapelemek egyike[szerkesztés]

A mitológia illetve az ókori tudomány több helyen fontos dologként hivatkozik a vízre: Az arisztotelészi négy alapelemek (föld, víz, levegő, tűz) egyike.
Tulajdonságai[szerkesztés]



A víz színtelen, szagtalan, íztelen folyadék. Az ivóvíz kellemes ízét a benne oldott anyagok okozzák. A víz az egyetlen olyan természetes anyag a Földön, amely mindhárom halmazállapotában megtalálható. A víznek +4 °C-on a legnagyobb a sűrűsége. Nagy hőmérséklet hatására (pl. olvadt fém) termikus bomlás következik be, azaz hidrogénre és oxigénre bomlik – ezek elegye az igen robbanékony durranógáz.
A víz folyékony és szilárd halmazában is a vízmolekulák között hidrogénkötések (hidrogénhíd-kötések) jönnek létre: az egyik vízmolekula hidrogénatomja kapcsolódik a másik vízmolekula oxigénatomjának egyik nemkötő elektronpárjához. A molekulák közti hidrogénkötésben álló hidrogén és oxigén atommagok nagyobb távolságra vannak egymástól, mint a molekulán belüli kovalens kötésben álló hidrogén és oxigén atommagok. Egy vízmolekula összesen 4 másik vízmolekulához képes hidrogénkötéssel kapcsolódni. A folyékony halmazállapotú vízben nem minden hidrogénkötés jön létre, kialakulásuk és felbomlásuk folyamatos, csak részleges rendezettség alakul ki. Azonban a víz jéggé fagyásakor – azaz a molekularácsos kristályszerkezet kialakulásakor – minden hidrogénkötés létrejön, a molekulák között teljes rendezettség alakul ki, amely egyúttal rosszabb térkihasználtságot eredményez, mint amit a molekulák a folyékony vízben megvalósítanak: a molekulák a jégben távolabb helyezkednek el egymástól, nagyobb teret töltenek be, mint a vízben. Ez okozza azt, hogy a jég sűrűsége kisebb, mint a vízé, és fagyáskor a többi anyagtól eltérően a víz térfogata megnő (mintegy 9%-kal). Ezért úszik a jég a vízen.[17][18]
A víz mint oldószer[szerkesztés]
A víz molekulája poláris molekula: az oxigénatom felé eső molekularész kissé negatív, a hidrogénatomok felé eső molekularész pedig kissé pozitív töltésű, így a molekula dipólussá válik. Ezt a dipólust egyrészt az oxigénatom nagyobb elektronegativitása okozza (a molekulában levő mindkét kovalens kötés poláris és az oxigénatomhoz közelebb helyezkedik el), másrészt az oxigénatom nemkötő elektronpárjai, amik az oxigénatom közelében találhatók. Ennek a dipólusosságnak köszönhető, hogy a víz sok ionvegyület, például a konyhasó (NaCl) jó oldószere.
Túlhűtött víz[szerkesztés]
A víz jéggé alakulásához apró, szilárd szennyezőanyagoknak kell a vízben lenniük, amik körül a jéggé alakulás megindulhat. Ez átlagosan −12 °C körül következik be. Az ilyen hőmérsékletű víz kisebb rázkódás vagy porszem hatására is azonnal látványosan (3–5 cm/s) kristályosodásnak indul, de nem fagy meg teljesen. A jégkristályok között marad folyékony halmazállapotú víz, ami csak −48 °C-on fagy tömör jéggé. A mindenféle szennyeződéstől mentes („szupertiszta”) vizet ugyanis −48 °C-ig is le lehet hűteni anélkül, hogy jéggé fagyna.[19] −48 °C-on azonban a víz szerkezete hirtelen jéggé alakul, melyet hangjelenség kísér. Ez a legtisztább víznél is bekövetkezik. A 0 és −48 fok közötti víz azért kezd el kristályosodni, mert a hidrogénhíd-kötések ekkor már képesek összetartani a vízmolekulákat. Elektromos töltés hatására a víz dermedéspontja megváltozik. Az egyébként szokásos −12 °C helyett, ha a felszín pozitív elektromos töltésű, akkor −7 °C lesz, míg negatív töltés esetén −18 °C-ig hűthető.[20]
A kialakult anyag tovább hűthető: −120 °C alatt a víz sűrűn folyóvá válik, majd −135 °C-nál, ha addig nem alakult ki kristályszerkezet (például idő híján), üveges lesz kristályszerkezet kialakulása nélkül. [forrás?]
A Mpemba-paradoxon[szerkesztés]

A víz különleges tulajdonsága, hogy változatos körülmények között a fagyni kitett meleg víz hamarabb fagy meg, mint mellette a hideg. A Mpemba-paradoxonra több részleges magyarázatot adtak, de a teljes megértéshez még további vizsgálatokra van szükség.[21]
A víz sűrűségmaximuma[szerkesztés]
A víz sűrűségmaximuma a fagyáspont felett van (4 °C). A sűrűség és a hőmérséklet közötti összefüggés , de némi hiba van benne. Az összefüggés nem lineáris.
Jegyzetek[szerkesztés]
- ↑ Leigh, G. J. et al. 1998. Principles of chemical nomenclature: a guide to IUPAC recommendations Archiválva 2009. szeptember 29-i dátummal a Wayback Machine-ben, p. 99. Blackwell Science Ltd, UK. ISBN 0-86542-685-6
- ↑ a b c d e N. N. Greenwood, A. Earnshaw: Az elemek kémiája, 847. o. Nemzeti Tankönyvkiadó, Budapest, 1999. ISBN 963-18-9144-5
- ↑ a b c A víz vegyülethez tartozó bejegyzés az IFA GESTIS adatbázisából. (JavaScript szükséges) (angolul)
- ↑ Biztonsági adatlap (jtbaker.com). [2010. szeptember 18-i dátummal az eredetiből archiválva]. (Hozzáférés: 2010. október 17.)
- ↑ Archivált másolat. [2012. augusztus 26-i dátummal az eredetiből archiválva]. (Hozzáférés: 2012. augusztus 25.)
- ↑ Shipping - Backbone of Global Economy, says UN (angol nyelven). MarineLink, 2016. szeptember 30. (Hozzáférés: 2020. június 7.)
- ↑ fao.org: SOFIA 2018 - State of Fisheries and Aquaculture in the world 2018 (angol nyelven). www.fao.org. (Hozzáférés: 2020. június 7.)
- ↑ Statistics and knowledge | International Hydropower Association. www.hydropower.org. [2020. június 4-i dátummal az eredetiből archiválva]. (Hozzáférés: 2020. június 7.)
- ↑ Mironenko, Roman M., Tatiana I. (2019. április 1.). „Aqueous-phase hydrogenation of furfural over supported palladium catalysts: effect of the support on the reaction routes” (angol nyelven). Reaction Kinetics, Mechanisms and Catalysis 126 (2), 811–827. o. DOI:10.1007/s11144-018-1505-y. ISSN 1878-5204.
- ↑ Katheria, Sanjay, Goutam (2020. június 1.). „Kinetics of steam reforming of methane on Rh–Ni/MgAl2O4 catalyst” (angol nyelven). Reaction Kinetics, Mechanisms and Catalysis 130 (1), 91–101. o. DOI:10.1007/s11144-020-01767-y. ISSN 1878-5204.
- ↑ Kinetic studies of propane oxidation on Mo and V based mixed oxide catalysts
- ↑ (2012) „Surface chemistry of phase-pure M1 MoVTeNb oxide during operation in selective oxidation of propane to acrylic acid”. Journal of Catalysis (285), 48-60. o.
- ↑ (2014) „The reaction network in propane oxidation over phase-pure MoVTeNb M1 oxide catalysts.”. Journal of Catalysis (311), 369-385. o.
- ↑ Perry, Samuel C., Luciana (2019. július 1.). „Electrochemical synthesis of hydrogen peroxide from water and oxygen” (angol nyelven). Nature Reviews Chemistry 3 (7), 442–458. o. DOI:10.1038/s41570-019-0110-6. ISSN 2397-3358.
- ↑ Rohamosan csökkennek a természeti erőforrások Archiválva 2007. július 9-i dátummal a Wayback Machine-ben (2005. március 30.)
- ↑ Ivóvíz hiány Archiválva 2007. szeptember 27-i dátummal a Wayback Machine-ben (2006. augusztus 16.)
- ↑ víz - egy "különleges" anyag Archiválva 2011. február 4-i dátummal a Wayback Machine-ben elérve: 2008-03-12
- ↑ A víz (H2O). In Balázs Lórántné – J. Balázs Katalin: Kémia: Ennyit kell(ene) tudnod. Lektorálta: Mándics Dezső. Harmadik, javított kiadás. Budapest: Akkord Kiadó – Panem Kiadó. 1999. 153–155 (150–158). o. ISBN 963-545-256-X
- ↑ http://mernokbazis.hu/cikkek/a-v%C3%ADz-igazi-fagy%C3%A1spontja-%E2%80%93-m%C3%ADnusz-48-%C2%B0c Archiválva 2012. február 12-i dátummal a Wayback Machine-ben A víz igazi fagyáspontja −48 °C
- ↑ http://www.sciencenews.org/view/generic/id/56134/title/A_charge_for_freezing_water_at_different_temperatures Archiválva 2010. február 9-i dátummal a Wayback Machine-ben A charge for freezing water at different temperatures
- ↑ National Geographic Magyarország cikke Archiválva 2007. szeptember 27-i dátummal a Wayback Machine-ben a Mpemba-paradoxonról
További információk[szerkesztés]
- Magyar Hidrológiai Társaság – a víz helyzete ma Magyarországon
- EU-s normák
- Kút létesítésének technológiája
- Esővízgyűjtők készítésének technológiája
- Vízpiac Magazin
- Physicists discover new quantum state of water (2011-02-04)
- Elképesztő: a világegyetem legnagyobb víztárolója egy kvazár körül[halott link]. Mno.hu.
- A 4 °C-os víz sűrűsége – YouTube videó
Kapcsolódó szócikkek[szerkesztés]
- Adattáblázat
- Balneológia
- Gyógyító fürdő
- Gőzfürdő
- Természetvédelem
- Ivókúra
- Terápia
- Pszichrometria
- Ásványi anyagok
- Kút
- A víz világnapja
- Sótalanítás
- Tengervíz
- Ásványvíz
- Kneipp kúra
- Fiziológiás oldat
- Ivóvízhiány
- Holdi víz
- bázis
- Vízkeménység
- hidrogén-peroxid
- amfoter
- hidrogén
- oxigén
- sav
- lúg
- édesvíz
- négy elem
- árvíz
- pH




