Elektron
| Elektron | |
 | |
| A hidrogénatom elektronjainak hullámfüggvényei | |
| Osztályozás | lepton |
| Összetétel | elemi részecske |
| Kölcsönhatások | gravitáció, elektromágneses, gyenge |
| Jel | e-, β- |
| Antirészecske | pozitron |
| Megsejtette | Richard Laming (1838–1851) |
| Felfedezte | Joseph John Thomson (1897)[1] |
| Fizikai adatai | |
| Tömeg | |
| 9,109 382 15(45) ·10−31 kg[2] | |
| 5,485 799 0943(23)-4 u[3] | |
| Töltés | |
| -1 e | |
| 1,602 176 487(40) ·10−19 C[4] | |
| Mágneses momentum | |
| −928,476 377(23) ·10−26 J·T−1[5] | |
| Spin | 1/2 (fermion) |
Az elektron (az ógörög ήλεκτρον, borostyán szóból) negatív elektromos töltésű elemi részecske,[6] amely az atommaggal együtt kémiai részecskéket alkot, és felelős a kémiai kötésekért. Szokásos jelölése: e‒. Az elektron feles spinű lepton; a leptonok első generációjának tagja.[7] Antirészecskéje a pozitron.
Az elektron tömege a proton tömegének 1/1836 része.[8] Az elektronok és a többi elemi részecske kölcsönhatását a kémia és a magfizika vizsgálja. Antianyagbeli párja, a pozitron tömege és spinje megegyezik az elektronéval, azonban töltése ellentétes. Ha pozitron és elektron találkozik, energia felvillanás során mindkettő szétsugárzódik, és gamma-foton jön létre.
Normális körülmények között az elektronok az atomok pozitív magjához kötődnek, mivel az ellentétes elektromos töltések vonzzák egymást. Egy semleges atomban az elektronok száma azonos a mag pozitív töltéseinek számával. Egy atomon belül az elektronok szabályosan elrendezett pályákon mozognak a mag körül, a mag és az elektronok közti vonzás legyőzi az elektronok közt fellépő taszító hatást. Az elektronpályák koncentrikus héjakba rendeződnek, és a magtól kifelé haladva egyre több az alhéj. A magtól való távolságtól függően a héjakban lévő elektronok kötése egyre lazább. Az elektronok elrendeződése meghatározza az atom méretét, és hatással van arra, hogy reagál más atomokra, részecskékre és az elektromágneses sugárzásra. Az ionizáció és a részecskék közötti arány megváltozása megváltoztatja a rendszer kötési energiáját. Két vagy több atom között az elektronok kicserélése vagy megosztása kémiai kötést hoz létre.[9] Fontos szerepet tölt be kémiai reakciók legnagyobb csoportjában, a redoxireakciókban.
Mivel spinje félegész szám a ħ Planck-állandóban mérve, a fermionok közé tartozik, így a Pauli-féle kizárási elv miatt két elektron nem foglalhatja el ugyanazt a kvantumállapotot.[7] Ahogy a többi anyagi részecskének, az elektronnak is van hullámtermészete; így ütközhet más részecskékkel, és megtörhet, mint a fény. Hullámtermészete egyszerűbben vizsgálható, mert kis tömege miatt a De Broglie-féle hullámhossza is magasabb a tipikus energiaszinteken.
Több fizikai jelenségben is kulcsfontosságú, így az elektromosságban, a mágnesességben, és a hővezetésben. Továbbá hat rá a többi alapvető erő: a gravitáció, az elektromágnesesség és a gyenge kölcsönhatás.[10] Negatív töltése miatt az elektron elektromos erőteret hoz létre maga körül. Egy megfigyelőhöz képest mozogva mágneses mezőt hoz létre. A külső elektromágneses terek a Lorentz-törvény szerint hatnak rá. Részt vesz a magreakciókban is, például a csillagokban zajló fúzióban, és radioaktív bomlási folyamatokban is létrejön, ahol béta-részecskeként ismert. Nagy energiájú ütközések is elektronokat hoznak létre, például a kozmikus sugarak, amikor elérik a légkört. Gyorsításkor fotonok formájában vesz fel és ad le energiát. Laboratóriumi eszközökben akár egyetlen elektron vagy elektronplazma is tartható és megfigyelhető elektromágneses mezővel. Teleszkópokkal a külső elektronplazma is megfigyelhető.
Sok alkalmazásban felhasználják, mint az elektronikában, a hegesztésben, a katódsugárcsövekben, az elektronmikroszkópokban, a sugárterápiában, a lézerekben vagy a részecskegyorsítókban.
Először Richard Laming feltételezte 1838-ban az elektromos töltés egy láthatatlan egységét, hogy megmagyarázza az atomok kémiai viselkedését.[11] George Johnstone Stoney nevezte el elektronnak ezt az elemi töltésegységet. Az elnevezés a görög elektron szóból származik, amely jelentése borostyánkő. A görögök borostyánkövet dörzsöltek meg más anyaggal, és tapasztalták az elektromos vonzó tulajdonságát. Kísérleti kimutatása 1897-ben Joseph John Thomsonnak sikerült először.[12][13][14]
| Elektromos töltés | |
| Nyugalmi tömeg |
5,485 799 0943(23)·10−4 u[16] = |
| Relatív töltés | −1 |
| Relatív tömeg | 1 / 1836[18] |
| Moláris tömeg | 5,485 799 0946(22)·10−7 kg mol−1[19] |
| Nyugalmi energia | |
| Mágneses momentum | −928,476 377(23)·10−26 J T−1[22] |
| Spin | 1/2 (fermion) |
| g-faktor | −2,002 319 304 3622(15)[23] |
| Élettartam | stabil |
Története[szerkesztés]
Már az ókori görögök felfedezték, hogy a borostyán vonzza az apró tárgyakat, ha bundával dörzsölik. A villámlás mellett ez az emberiség egyik legrégibb tapasztalata az elektromosságról.[24] 1600-ban az angol William Gilbert a De Magnete című értekezésében erre a jelenségre alapozva megalkotta az újlatin electricus szót.[25]
Az 1700-as évek elején Francis Hauksbee és a francia Charles François de Cisternay du Fay egymástól függetlenül felfedezték a dörzsölési elektromosság kétféle típusát. Az egyik az üveg, a másik a gyanta megdörzsölésével hozható létre. Du Fay elmélete szerint itt kétféle elektromos folyadék van, amelyek dörzsöléssel elválaszthatók, és semlegesítik egymást, ha összeérnek.[26] Egy évtizeddel később Benjamin Franklin szerint egyféle folyadék van, kétféle nyomással. Tőle származik a pozitív és a negatív elnevezés is.[27] Szerinte a pozitív a töltéshordozó, de nem szólt arról, hogy melyik állapotban van hiány, és melyikben fölösleg.[28]
Richard Laming angol természetfilozófus 1838 és 1851 között alkotta meg atommodelljét, amiben az atomok magból és szubatomi töltéshordozó részecskékből állnak.[29] 1846-tól a német William Weber szerint az elektromosságot pozitív és negatív folyadékok alkotják, és az inverz négyzet törvénye szerint hatnak kölcsön. Az ír George Johnstone Stoney 1874-ben tanulmányozta az elektrolízist; ez kialakította benne az elemi töltés gondolatát, ami megegyezik egy egyszeres töltésű ion töltésével. Mérései alapján meg is becsülte ezt a mennyiséget az elektrolízis Faraday-féle törvénye alapján.[30] Ő azonban azt hitte, hogy ez a töltés nem távolítható el az atomból. Hermann von Helmholtz 1881-ben amellett érvelt, hogy a pozitív és a negatív elektromosság is elemi részecskékből áll, amelyek az elektromosság atomjaiként működnek.[11]
Stoney electrolionnak nevezte az elemi töltésegységet 1881-ben. Tíz év múlva a nevet electronra változtatta. Így írt erről: Becslés készült az elektromosságnak ennek a figyelemre méltó egységnek az aktuális mennyiségéről, aminek az elektron nevet javaslom. Volt egy javaslat 1906-ban, hogy a nevet elektrolionra kell visszaváltoztatni, ám Hendrik Lorentz előnyben részesítette az elektron nevet.[31][32] A név az electric és az ion szavak kombinációjából keletkezett,[33] de azóta az elektron szóból eredeztethető -on végződés más elemi részecskék nevének végén is megjelent, például proton, neutron.[34][35]
Felfedezése[szerkesztés]


A német Johann Wilhelm Hittorf ritkított gázok elektromos vezetését vizsgálta. 1869-ben a katódról induló izzást figyelt meg, ami annál erősebb volt, minél ritkább volt a gáz. 1876-ban a német Eugen Goldstein megmutatta, hogy ezek a sugarak árnyékot vetnek, és elnevezte őket katódsugárnak.[37] Az 1870-es években az angol William Crookes előállította az első katódsugárcsövet, vákuummal a belsejében.[38] Ezzel megmutatta, hogy a fénylő sugarak a katódról indulnak az anód felé, és energiát szállítanak. Ezután sikerült mágneses mezővel meghajlítani a katódsugarakat, megerősítve, hogy a sugarak negatív töltésűek.[39][40] 1879-ben kifejtette, hogy ez egy sugárzó anyaggal magyarázható. Szerinte ez az anyag negyedik halmazállapota, ami negatív töltésű összetett ionokból áll, amik nagy sebességgel vetődnek ki a katódból az anód felé.[41]
A német földön született, de az Egyesült Királyság polgárává lett Arthur Schuster folytatta Crookes kísérleteit. Két fémlapot helyezett el a katódsugarakkal párhuzamosan, és elektromos feszültséget állított elő a kettő közül. A katódsugarak a pozitív feszültségű lemez felé hajlottak el, ezzel újra megerősítették, hogy a katódsugarak negatív töltésűek. Adott erősségű áram mellett az elhajlást mérve Schuster 1890-ben megbecsülte a sugarak töltés/tömeg arányát. Mivel a kapott érték mintegy ezerszerese volt a vártnak, a legtöbben hibára gyanakodtak, és nem hitték el ezt az eredményt.[39][42]
1892-ben Hendrik Lorentz azt sugallta, hogy az elektronok tömege a töltésük következménye.[43]
1896-ban az angol J. J. Thomson, John S. Townsend és H. A. Wilson[13] kísérleteikből arra jutottak, hogy a katódsugarakat elemi részecskék alkotják, és nem hullámok, vagy ionok, mint ahogy korábban gondolták.[12] Thomson pontos becslést kapott mind a tömegre (m), mind a töltésre (e), ahol is a tömeg csak ezredrésze a legkönnyebb ionnak, a hidrogénnek.[12][14] Azt is megmutatta, hogy az e/m arány független a katód anyagától. Továbbá a radioaktív bomlás, a hevítés és a megvilágítás hatására is ugyanilyen részecskék lépnek ki. Az ír George F. Fitzgerald újra javasolta az elektron megnevezést, és ez el is terjedt.[12][44]
A természetes fluoreszkáló ásványok tanulmányozása közben Henri Becquerel felfedezte, hogy sugárzást bocsátanak ki akkor is, ha kívülről nem nyernek energiát. Ezek a radioaktív anyagok az érdeklődés középpontjába kerültek. Ernest Rutherford felfedezte, hogy részecskéket bocsátanak ki. Ezeket alfa- és béta-részecskéknek nevezte, arra utalva, hogy milyen mértékben képesek áthaladni az anyagon.[45] 1900-ban Becquerel a rádium béta-sugarait elektromos mezővel elhajlította, és kimutatta, hogy tömeg/töltés arányuk ugyanaz, mint a katódsugarak részecskéinek.[46] Ez erősítette azt a nézetet, hogy az elektronok az atomok részei.[47][48]

Az elektron töltését az amerikai Robert Millikan és Harvey Fletcher mérte meg pontosabban 1909-es olajcseppkísérletükben, aminek eredményeit 1911-ben publikálták. Ebben elektromos mezővel lebegtettek egy elektromosan feltöltött olajcseppet. Az eszközzel 1-150 ion töltését tudták megmérni kevesebb mint 0,3%-os hibával. Korábban Thomson csapata is végzett hasonló kísérletet[12] az elektrolízis által feltöltött vízcseppekből álló köddel.[13] 1911-ben Abram Ioffe fémek elektromosan töltött mikroporával szintén hasonló kísérletet végzett, és függetlenül Millikantől és Fletchertől hasonló eredményt kapott a töltésre. Eredményeit 1913-ban publikálta.[49] Az olajcseppek alkalmasabbak erre a kísérletre, mint a vízcseppek, mert az olaj lassabban párolog, így a hosszabb ideig tartó kísérletben pontosabb eredményekhez lehet jutni.
A 20. század elején felfedezték, hogy a gyorsan mozgó részecskék bizonyos körülmények között kondenzációs csíkot húznak a túltelített vizes oldatban. 1911-ben Charles Wilson ezen az elven ködkamrát készített, amiben le tudta fényképezni a részecskék nyomait, így a gyors elektronokét is.[50]
Atomelmélet[szerkesztés]
1914-ben Ernest Rutherford, Henry Moseley, James Franck és Gustav Hertz kísérletek alapján belátták, hogy az atomok kicsi, de nehéz pozitív töltésű magból és könnyű elektronokból állnak.[51] 1913-ban a dán Niels Bohr azt az elméletet javasolta, hogy az elektronok csak bizonyos energiaszinteket foglalhatnak el, ezért nem zuhannak a magba. Az ezek által meghatározott pályák között ugrálhatnak. Amikor egy magasabb szintről alacsonyabb szintre lépnek, akkor a különbség fotonként távozik. Ezzel az elmélettel sikerült megmagyaráznia a hidrogén színképét,[52] de adós maradt a nehezebb atomok spektrumával és a színképvonalak relatív fényességével.[51]
Az atomok közötti kovalens kötéseket Gilbert Newton Lewis magyarázta azzal, hogy az atomokat egy vagy több közös elektronpár tartja össze a molekulákban.[53] 1927-ben Walter Heitler és Fritz London kvantummechanikai magyarázatot adott erre.[54] 1919-ben az amerikai Irving Langmuir Lewis statikus modelljével foglalkozott, és gömbhéjakon képzelte el az elektronokat,[55] ahol egy héjon egy elektronpár osztozik. Ezzel a modellel Langmuir meg tudta magyarázni az összes elem kémiai tulajdonságait a periódusos rendszerben.[54] Ezek főbb jellemzőikben periódusosan viselkednek.[56]
1924-ben az osztrák Wolfgang Pauli négy paraméterrel írta le az atom héjszerkezetét, amiben minden elektron más állapotot foglal el. Ezt ma Pauli-féle kizárási elvként ismerik.[57] Az utolsó paraméternek két állapota van. Ennek fizikai mechanizmusát a holland Samuel Goudsmit és George Uhlenbeck magyarázta. 1925-ben felfedezték, hogy az elektron pályájáinak perdülete mellett belső impulzusmomentumuk és mágneses dipólmomentumuk is van.[51][58] Azóta ezt az elektron spinjének nevezik. Ez magyarázza a színképvonalak misztikus hasadását, ami nagy felbontású spektrográffal figyelhető meg. Ez a finomszerkezeti hasadás.[59]
Kvantummechanika[szerkesztés]

1924-ben kiadott értekezésében a francia Louis de Broglie azt az elméletét írta le, hogy az anyag részecsketermészetű elemei a fényhez hasonlóan hullámformalizmussal is leírhatók.[60] Ez azt jelenti, hogy bizonyos körülmények között az anyagi részecskék hullámként is viselkedhetnek. Részecskeként van helye, pályája és sebessége,[61] a hullámtermészet pedig akkor figyelhető meg, ha például réseken bocsátják át, és interferenciajelenség lép fel. 1927-ben George Paget Thomson elvégezte a kísérletet: résen át anyagi részecskenyalábot vezetett, a rés túloldalára pedig ernyőt helyezett. Az ernyőn kialakuló interferenciakép megmutatta, hogy a hullámtermészet valóban fellép bizonyos fizikai folyamatokban. Clinton Davisson és Lester Germer amerikai fizikusok nikkelkristályt használtak hasonló kísérletükben.[62]
Az anyag kettős természetére utaló kísérletek arra ösztönözték Erwin Schrödingert, hogy a mag vonzása alatt álló elektron mozgását is hullámegyenlettel írja le. Az 1926-ban közzétett Schrödinger-egyenlettel azt is le tudta írni, hogyan haladnak az elektronhullámok.[63] Ahelyett, hogy az elektron pillanatnyi helyét, illetve klasszikus értelemben vett pályáját számította volna ki, azt határozta meg hogy a mag körül az elektron előfordulásának milyen a valószínűségi sűrűségfüggvénye. Ez a megközelítés vezetett a kvantummechanika újrafogalmazásához. A Schrödinger-egyenletből származtatott hidrogénatom-energiaspektrum jó egyezést mutatott Bohr 1913-as eredményeivel.[64] Mivel ez a megközelítés lehetővé tette az elektronok egymás közötti kölcsönhatásainak, illetve az elektronok spinjéből származó hatásoknak a figyelembe vételét, a hidrogénnél magasabb rendszámú atomokban is meg lehetett határozni az elektronok konfigurációját.[65]
1928-ban Wolfgang Pauli munkájára alapozva Paul Dirac egy új egyenlettel állt elő, ami az elektron egy modelljét írja le. A Dirac-egyenlet összhangban áll a relativitáselmélettel, ugyanis a Hamilton-formalizmust relativisztikus és szimmetriameggondolásokkal egészíti ki.[66] A relativisztikus elmélet problémáját az jelentette, hogy nem volt alsó korlát az energiára, ezért némiképp a Pauli-elvre alapozva Dirac a vákuumot úgy modellezte, mint amiben negatív energiájú részecskék végtelen sokasága tölti fel a mínusz végtelentől az alapállapoti energiáig tartó energiatartományt. Ezt az elméleti koncepciót nevezik Dirac-tengernek. Ez elvezette őt az elektron antirészecskéjéhez, a pozitronhoz.[67] A részecskét 1932-ben Carl Anderson fedezte fel, aki azt javasolta, hogy az elektront negatronnak nevezzék, és legyen az elektron a pozitron és a negatron közös neve, azonban ez a terminológia nem terjedt el.
1947-ben Willis Lamb hallgatójával, Robert Retherforddal közösen úgy találta, hogy a hidrogénatom bizonyos, elvben azonos energiájú állapotai egymáshoz képest energiában kissé eltolódnak, azaz a degenerált energiaszint felhasad. Ezt nevezik a Lamb-eltolódásnak.[68] Ugyanekkor Polykarp Kusch és Henry M. Foley felfedezték, hogy az elektron mágneses momentuma valamivel nagyobb, mint ami Dirac-egyenletből következne. Ezt a különbséget az elektron anomáliás mágneses dipólmomentumának nevezték, melyet a többek között Tomonaga Sinicsiró, Julian Schwinger és Richard Feynman által az 1940-es évek végén kifejlesztett kvantum-elektrodinamika magyarázza meg.[69]
Részecskegyorsítók[szerkesztés]
A részecskegyorsítók fejlődésével és az egyre nagyobb energiák elérésével a fizikusok egyre mélyebben tudták elemezni az elemi részecskék tulajdonságait.[70] Az elektronokat először 1942-ben tudta felgyorsítani Donald Kerst mágneses indukcióval. Betatronjával 2,3 MeV-ot ért el; a későbbi betatronok 300 MeV-ig gyorsították az elektronokat. 1947-ben felfedezték a szinkrotronsugárzást a General Electric 70 MeV-os szinkrotronjában. A sugárzást a körpályára állított elektronok gyorsulása okozta: az egyenletes körmozgás során az elektronra centripetális gyorsulás hat, és a gyorsuló, töltött részecskék fékezési sugárzást bocsátanak ki.[71]
Az első részecskeütköztető az ADONE volt, ami 1968-ban kezdte meg működését 1,5 GeV energiájú nyalábokkal.[72] Elektronokat és pozitronokat ütköztetett, amivel megkétszerezte az ütközés energiáját az álló célhoz képest.[73] A CERN ütköztetője, a Large Electron–Positron Collider (LEP) 1989-től 2000-ig működött, 209 GeV ütközési energiát ért el, és fontos méréseket végzett a részecskefizika standard modellje számára, például 2012-ben itt fedezték fel az évtizedekkel korábban elméletileg megjósolt Higgs-bozont is.[74][75]
Egyes elektronok befogása[szerkesztés]
A 2010-es évekre már megjelentek olyan eszközök, melyek egyedi elektronok viselkedésén alapulnak. Ilyenek például a 2012-ben bemutatott L=20 nm, W=20 nm csatornaméretű CMOS tranzisztorok −269 °C (4 K) és −258 °C (15 K) között.[76] Az elektron úgy halad egy félvezető kristályban, hogy eközben a többi elektronnal és a ráccsal kis mértékben reagál, effektív tömege pedig eltérhet az elektron nyugalmi tömegétől. Az ilyen rácselektronok szilárdtestekben való viselkedésével a félvezetők fizikája és a szilárdtestfizika foglalkozik.
Tulajdonságai[szerkesztés]
Osztályozása[szerkesztés]
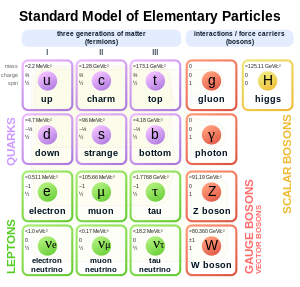
A részecskefizika standard modellje szerint az elektron a leptonok részecskecsaládjába tartozik. Az elektromosan töltött leptonok között az elektron a legkönnyebb. A standard modellben az első generációs elemi részecskék közé sorolják.[77] A második és a harmadik generációhoz sorolt leptonokkal azonos a töltése és a spinje, és azonos kölcsönhatásokban is vesz részt, azonban a müonhoz és a tauhoz képest az elektron jóval kisebb tömegű. A leptonok abban különböznek a kvarkoktól, hogy nem vesznek részt az erős kölcsönhatásban. A leptonok mind fermionok, melyet félegész spinjük is mutat. Az elektron spinje 1/2 vagy –1/2 lehet.[78]
Alapvető tulajdonságai[szerkesztés]
Egy elektron invariáns tömege megközelítőleg 9,109×10−31 kilogramm, vagy 5,489×10−4 atomi tömegegység.[79] Einstein tömeg-energia megfeleltetésével ez 0,511 MeV nyugalmi energiának felel meg. A proton és az elektron tömegének aránya körülbelül 1836.[8][80] A csillagászati mérések azt mutatják, hogy a proton/elektron tömegarány változatlan legalább az Univerzum életének legalább a fele óta, ahogy a standard modell állítja.[81]
Az elektron töltése −1,602×10−19 Coulomb.[79] Ezt elemi töltésegységnek nevezik, és a szubatomi részecskék töltésének mérésére használják. Relatív pontossága 2,2×10−8.[79] Kísérleti pontossággal az elektron töltése ugyanakkora, mint a protoné, de ellenkező előjelű.[82] Az elemi töltést gyakran e-vel jelölik, így az elektron jele e−, ahol a mínusz jel a negatív töltésre utal. Hasonlóan, a pozitron jele e+, mivel minden tulajdonságban egyezik az elektronnal, kivéve ellentétes töltését.[78][79]
Az elektron belső impulzusmomentuma avagy spinje 1/2.[79] Erre gyakran úgy utalnak röviden, hogy az elektron félegész spinű részecske.[78] Az ilyen részecskék spinjének magnitúdója ħ. Ez azt jelenti, hogy a spin vetülete (és így a kvantummechanikai értelemben vett mérési értéke) bármely tengely irányában ±ħ/2. Emellett az elektronnak spintengely irányú mágneses momentuma is van,[79] ami megközelítőleg 1 Bohr-magneton.[83] A Bohr-magneton:
- Ennek mértéke 9.27400915(23)×10−24 Joule / Tesla.[79] A spin momentum szerinti iránya definiálja a helicitást.[84]
Az elektronnak nincs ismert belső szerkezete,[85][86] a modellek kiterjedés nélküli tömegpontnak és ponttöltésnek tekintik.[7] A klasszikus fizikában egy test perdülete és mágneses momentuma fizikai kiterjedésétől függ. Így a pontszerű elektronmodell ellentmond a Penning-csapdákkal tett megfigyeléseknek, amik véges, de nem nulla sugárra utalnak. Ennek egy lehetséges magyarázatát rendszerint a Foldy–Wouthuysen-transzformáció figyelembe vételével adják meg.
Az elektron sugara egy megoldatlan kérdés a modern részecskefizikában. A véges nem nulla sugár nem fér össze a relativitáselmélettel. Másrészt a pontszerű elektron súlyos matematikai problémákat okoz, mivel így az elektron sajátenergiája végtelennek adódik.[87] Mindezeket részletesen elemezte Dmitrij Ivanyenko és Arszenyij Szokolov.
A Penning-csapdába befogott elektron mérésével a részecske sugarára 10−22 méter adódik.[88] Létezik egy klasszikus fizikai konstans, ami az elektronsugár néven ismert, ami 2,8179×10−15 m, így nagyobb, mint a protoné. Ez az elnevezés a kvantumfizikai hatásokat figyelmen kívül hagyó számításokból ered. Valójában ennek nem sok köze van az elektron valódi szerkezetéhez.[89]
Vannak elemi részecskék, amik spontán könnyebb részecskékre bomlanak. Erre egy példa a müon, ami elektronra, neutrinóra és antineutrinóra bomlik 2,2×10−6 várható élettartammal. Az elektron stabilitását elméleti indokok magyarázzák: mivel a legkönnyebb részecske, aminek tömege van, ezért bomlása sértené az anyagmegmaradás elvét. Az elektron élettartama legalább 6,6×1028 év, 90%-os konfidenciával.[90][91][92][93]
Kvantummechanikai tulajdonságai[szerkesztés]
Ahogy minden részecskének, úgy az elektronnak is van hullámtermészete, és megnyilvánulhat hullámként. Ez a hullám-részecske kettősség, és a kétnyílásos kísérlettel mutatható meg. Hullámtermészete miatt az elektron egyszerre mindkét nyíláson áthaladhat, és interferálhat önmagával.
A kvantummechanika a részecskék hullámtermészetét komplex értékű függvénnyel írja le. Ez a hullámfüggvény, amit görög betűvel, ψ-vel jelölnek. Ha ennek abszolútértékét négyzetre emelik, akkor megkapjuk annak a valószínűségét, hogy a részecske mely hely közelében milyen valószínűséggel figyelhető meg. Ez a valószínűségi sűrűség.[94]
Az egyes elektronok nem különböztethetők meg egymástól belső fizikai tulajdonságaik alapján. Ez azt jelenti, hogy egy egymással kölcsönható elektronpár két tagja kicserélhető anélkül, hogy észrevehető, mérhető változás történne. A fermionok, köztük az elektronok hullámfüggvénye antiszimmetrikus, ami azt jelenti, hogy a két elektron felcserélésével a függvény előjelet vált. Azaz ψ(r1, r2) = −ψ(r2, r1), ahol az r1 és az r2 változók az elektronokat jelölik. Mivel ezzel nem változott az abszolútérték, ezért a valószínűségek változatlanok maradtak. A bozonok hullámfüggvénye ezzel szemben szimmetrikus.[94]
Antiszimmetrikus esetben a hullámegyenletek megoldása nulla valószínűséget ad arra, hogy a két részecske egyszerre ugyanazt a helyet vagy állapotot foglalja el. Ennek a következménye a Pauli-féle kizárási elv. Ez magyarázza az elektronok viselkedését, például hogy miért kerülnek páronként külön pályára, vagy hogy miért alakulnak ki elektronpárok.[94]
Virtuális részecskék[szerkesztés]

Egyszerűsített kép szerint a fotonok életük egy szakaszát elektron-pozitron párként töltik, amelyek hamarosan megsemmisülnek, és energiájuk fotonná alakul.[95] A párok létrejöttéhez szükséges energia és a pár élettartama az alábbi határozatlansági relációban áll egymással: ΔE · Δt ≥ ħ. Az összefüggés értelmében a párkeltéshez szükséges ΔE energiát a kicsi Δt idő erejéig a vákuumtól is kölcsönözheti a keltett pár, így létrejöttük bizonyos valószínűséggel az aktiválási energiát el nem érő esetben is lehetséges. Mivel ħ ≈ 6,6×10−16 eV·s, ezért az elektron esetén többnyire 1,3×10−21 s élettartam a jellemző.[96]
Ha egy virtuális elektron-pozitron pár egy elektron erőteréhez közel jön létre, a pár ellentétes töltésű tagjaira őket elválasztó erők hatnak: a pozitron vonzódik a külső elektronhoz, a keltett elektront pedig taszítja. Ezt a jelenséget nevezik vákuumpolarizációnak amelynek értelmében a vákuum a anyagokhoz hasonlóan dielektrikus közegként viselkedik, és egy dielektrikus permittivitással jellemezhető. A vákuumpolarizációt kialakító virtuális részecskék árnyékoló hatása miatt egy elektron töltése a mérések során kisebbnek bizonyul, mint amekkora enélkül lenne.[97][98] Ezt az elgondolást 1997-ben a japán TRISTAN részecskegyorsítóval végzett kísérletek kísérletileg megerősítették.[99] A virtuális részecskék hasonlóan árnyékolják az elektron tömegét is.[100]
A virtuális részecskékkel történő kölcsönhatás magyarázza a belső mágneses momentum 0,1%-os eltérését a Bohr-magnetontól. Ez az anomáliás mágneses momentum.[83][101] A kvantum-elektrodinamika egyik legfontosabb eredménye, hogy a megjósolt eltérést mérési eredményekkel is igazolni lehetett.[102]
A virtuális részecskék segítenek megmagyarázni a pontszerű elektron „belső perdületét” (azaz az elektron spinjét) és mágneses momentumát jellemző jelenségeket. A virtuális fotonok alapján magyarázható az elektron „remegő” mozgása (azaz a zitterbewegung),[103] amely miatt az elektron precessziós körpályán mozog. Ez hozza létre a spint és a mágneses momentumot.[7][104] Az atomokban szintén a virtuális fotonok okozzák a színképvonalak Lamb-eltolódását.[97]
Kölcsönhatások[szerkesztés]

Az elektron negatív töltésű, ezért elektromos erőtere vonzza a pozitív töltésű részecskéket (például a protont), és taszítja a negatív töltésűeket. A kölcsönhatás nemrelativisztikus esetben a Coulomb-törvény határozza meg.[105] A mozgó elektron mágneses erőteret indukál.[94] Az Ampère-törvény azt jellemzi, hogy milyen erősségű mágneses mezőt kelt az elektronok kollektív mozgása. Mivel a mágneses mezővel mechanikai munkát lehet végezni, így az indukció jelensége alapján magyarázható például a villanymotor működése is. A kétköznapi léptékűnél gyorsabban mozgó töltött részecskék mágneses terét a Liénard–Wiechert-potenciálokkal szokták jellemezni, melyek relativisztikus mozgású, fénysebesség közeli részecskékre is jó közelítésű leírást adhatnak.
Ha egy elektron mágneses térben mozog, akkor Lorentz-erő hat rá, mely az elektron mozgási irányvektorának és a térerősségvektornak a vektori szorzatával adható meg. A gyakorlatban például egy tér nélkül egyenes pályán mozgó elektron, ha egyenletes mezőbe ér, körpályára áll, amelyhez a szükséges centripetális erőt a Lorentz-erő szolgáltatja. Az ilyen körpálya sugarát nevezik Larmor-sugárnak.[94][106] A gyorsuló mozgást végző elektron úgynevezett szinkrotronsugárzást kelt. A kisugárzott energiateljesítmény az elektront lassítja. Az Abraham–Lorentz–Dirac-erő az elektron saját terének visszahatása miatt az elektronra ható erő.[107]
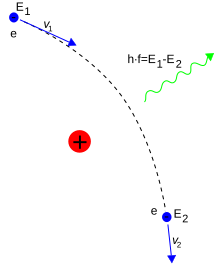
A kvantum-elektrodinamikában a részecskék között a fotonok közvetítik az elektromágneses kölcsönhatást. Egy állandó sebességű, egyenes vonalon mozgó elektron nem bocsátana ki vagy nyelne el fotont, amivel megsértené az energiamegmaradást és a lendületmegmaradást. A töltött részecskék közötti kölcsönhatáshoz figyelembe kell venni a virtuális fotonok szerepét: az feloldja az ellentmondást, hogy ezeket tekintik az elektromágneses kölcsönhatásban az energia- és a lendületátadás közvetítőnek. Például a töltött részecskék közötti Coulomb-erő is a virtuális fotonok közreműködésével lép fel.[108] Ennek értelmében az elektron például energiát adhat le, ha egy proton körüli elektromos téren szóródik. Az elektron gyorsulása fékezési sugárzást eredményez.[109]
Egy szabadon mozgó elektron és egy foton rugalmatlan ütközése a Compton-szórás. Ennek eredményeképpen megváltozik a részecskék lendülete és energiája, így a foton hullámhossza a Compton-eltolással módosul. Ennek nagysága legfeljebb h/mec, amit Compton-hullámhossznak neveznek.[110] Ez elektronra például 2,43×10−12 m. Hosszúhullámú részecskék szóródása esetén, mint például a látható fény (0,4–0,7 μm) ez az eltolódás elhanyagolható. Ez utóbbi kölcsönhatást nevezik Thomson-szórásnak.[111]
Két töltött részecske közötti elektromágneses kölcsönhatás erősségét a finomszerkezeti állandó adja meg. Ezt a mértékegység nélküli mennyiséget két energia hányadosa adja meg: a Compton-hullámhossznyi távolságban elhelyezett töltéseken mérhető elektrosztatikus energiájának, illetve a töltött részecske nyugalmi energiájának hányadosa. Mennyisége α ≈ 7,297353×10−3, ami megközelítőleg .[79]
Ha elektron és pozitron találkozik, akkor szétsugárzódnak (annihilálódnak) két vagy több foton (gamma-részecske) formájában. Ha lendületük elhanyagolható, akkor a szétsugárzódás előtt pozitróniumatom alakulhat ki. Az annihiláció során kisugárzott energia 1,022 MeV.[112][113] Másrészt, a nagy energiájú fotonok töltött részecskék közelében elektron-pozitron párrá alakulhatnak, amely jelenséget párkeltésnek neveznek.[114][115]
Az elektrogyenge kölcsönhatások elméletében az elektron hullámfüggvényének balsodrású kiralitással rendelkező komponense gyenge izospin dubletet alkot az elektron-neutrinókkal. Ez azt jelenti, hogy a gyenge kölcsönhatásokban az elektron-neutrinó ugyanúgy viselkedik, mint az elektron. A kettős bármelyik tagja töltésátvitelt szenvedhet: egy W-bozon kibocsátásával vagy elnyelésével a kettős egy másik tagjává alakulhat. A töltés eközben megmarad, mert a W-bozonnak is van töltése. Ez a töltésátvitel eredményezi a radioaktív bomlás során a béta-bomlást. Az elektron és az elektron-neutrinó semleges kölcsönhatásba is folytathat, ami egy Z0 cseréjével jár: ez írja le például a neutrinó-elektron rugalmas szórást.[116]
Atomok, ionok, molekulák[szerkesztés]
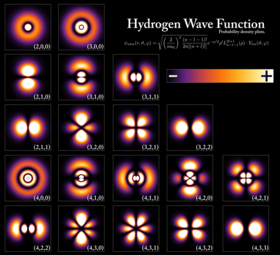
Az elektron egy pozitív töltésű atommag körül kötött állapotba kerülhet, mely klasszikusan a Coulomb-erő fellépésével magyarázható. Az atommag és elektronok alkotta rendszert nevezik atomnak. Ha az elektronok száma nem felel meg az atommag rendszámának, az atomot ionnak nevezik. Az atomi rendszerben kötött állapotban levő elektron hullámszerű viselkedését állapotfüggvények, úgynevezett atompályák írják le, amelyek segítségével megadható, hogy egy elektron hol milyen valószínűséggel tartózkodik az atommag körül. Minden pályát más-más kvantumszámok jellemeznek, és csak a megfelelően megadott kvantumszámok határoznak meg pályát. Mivel az elektronok fermionok, ezért a Pauli-féle kizárási elv értelmében minden pályán csupán két, ellentétes spinű elektron tartózkodhat.
Az elektronok fotonok elnyelésével vagy kibocsátásával léphetnek át a különböző energiájú atompályák között. A foton energiája megegyezik a két pálya energiájának különbségével.[117] Az atompályák közötti átlépés más részecskékkel való ütközéstől is történhet, de olyan összetett folyamatok is atomi átmenetekkel járnak, mint például az Auger-effektus.[118] Az atomtól való elszakadáshoz az elektronnak akkora energiára kell szert tennie, amennyi eléri vagy meghaladja a kötési energiát. Azt a jelenséget, mely során az atomból fotonelnyeléssel elektron lép ki, fényelektromos jelenségnek nevezik.[119]
Az elektronok pálya-impulzusmomentuma kvantált, azaz csak véges lépésekben változhat. Mivel az elektronnak töltése van, a pályaimpulzusa következtében ezzel arányos mágneses momentuma is van. Az atom mágneses momentuma egyenlő a mag és az elektronok pálya menti és spin mágneses momentumainak vektori összegével. Az elektronpárok mágneses momentuma ellentettje egymásnak, ezért kiegyenlítik egymást.[120]
Az atomok közötti kémiai kötések elektromágneses kölcsönhatások eredményei, amelyeket a kvantummechanika törvényei írnak le.[121] A legerősebb kötéseket az elektronok átadása (elektrontranszfer) vagy megosztása (kovalens kötés) hozza létre, ezek segítségével atomokból molekulák épülnek fel.[9] Több atommag elektromos terében az elektronok molekulapályán mozognak.[122] A molekulák kialakulásában döntő szerepe van az elektronpároknak, melyek azonos molekulapályán elhelyezkedő, ellentétes spinű elektronok. A különböző molekulapályák esetén az elektron megtalálási valószószínűségének térbeli eloszlása eltérő: a kötő elektronpárok többnyire a két atom között fordulnak elő, míg a nem kötő elektronpárok többnyire az atomok körül helyezkednek el.[123]
Vezetés[szerkesztés]

Egy test elektromosan semleges, ha benne a negatív és pozitív töltések mennyisége megegyezik. Hétköznapi esetben például ez úgy teljesülhet, ha egy testen az elektronok száma megegyezik a protonok számával. Ha egy testnek több, vagy kevesebb elektronja van, mint amennyi az elektromos semlegességhez kellene, akkor a test elektromosan töltött. Ha több elektronja van, akkor azt negatív, ha kevesebb, akkor azt pozitív sztatikus töltöttségnek nevezik. A makroszkopikus testek elektromos töltést nyerhetnek például dörzsölés által, ez a dörzselektromosság.[127]
A vákuumban, szabad pályán mozgó elektronokat szabad elektronoknak nevezik. A fémes anyagokban az elektronok egy része úgy viselkedik, mintha szabad elektron lenne: a testben viszonylag nagyobb távolságot is képes ütközés nélkül megtenni. A szilárdtestekben elmozdulni képes töltéshordozókat jellemzően sávelektronoknak nevezik, melyek effektív tömege a szilárdtestbeli viselkedésük folytán különbözhet az elektronok nyugalmi tömegétől.[128] Ha a szabad elektronok együtt mozognak, akkor kollektív mozgásuk elektromos áramot valósít meg. Az elektromos áram mágneses teret kelt, és visszafelé is: a változó mágneses tér áramot indukál. Ezeket a kölcsönhatásokat a Maxwell-egyenletek írják le.[129]
Minden anyagnak van kisebb-nagyobb elektromos vezetőképessége, mely a hőmérséklettől is függ. A jó vezetők közé tartozik a legtöbb fém, például az ezüst, az arany és a réz, míg az üveg és a teflon például rosszul vezeti az elektromosságot. A szigetelő anyagokban (dielektrikumokban) az elektronok szorosan kötődnek az atomokhoz és a molekulákhoz, ezért ezek elektromos szigetelőként viselkednek. A félvezető anyagok vezetőképessége a jó vezetők és a jó szigetelők közötti.[130] A fémek elektron-sávszerkezete csak részben töltött sávokból áll. A sávokon belüli energiájú elektronok szabadon elmozdulhatnak az anyagban, nem egy, hanem sok atomhoz tartoznak. A delokalizált elektronok egy gáz atomjaihoz hasonlóak, melyen alapul a jellemzően vezetőkre alkalmazható elektrongáz koncepciója.[131]
A Drude-modell értelmében az elektronok és a kristálybeli atomtörzsek közötti ütközések következtében az elektronok sebessége statisztikusan állandósul. Ez a driftsebesség néhány mm/s nagyságrendű. Ezzel szemben az anyagban a változások tipikusan a fénysebesség 75%-ával terjednek.[132] Ez azért lehetséges, mert az elektromos jelek hullámként, azaz az elektronok kollektív mozgásával terjednek, mely hullámok csoportsebessége az anyag dielektromos állandójától függ.[133]
A legtöbb fém a hőt is jól vezeti a delokalizált elektronoknak köszönhetően. Hővezetésük, szemben az elektromos vezetéssel, közel független a hőmérséklettől, amit a Wiedemann–Franz-törvény fejez ki: a hővezetés és az elektromos vezetés aránya egyenesen arányos a hőmérséklettel.[131] Minél melegebb a fémes anyag, annál erősebbek a kristályrács rezgései, ami akadályozza az elektromos vezetést, azaz növeli az ellenállást.[134]
Egy bizonyos hőmérséklet alá hűtve az anyagok ellenállása megszűnik, és az anyag szupravezetővé válik. A BCS-elmélet szerint ennek az az oka, hogy az elektronok ezen a hőmérsékleten úgynevezett Cooper-párokat alkotnak (mely nem összekeverendő az atomfizikai értelemben vett elektronpárokkal). A Cooper-párok a hideg közegben Bose–Einstein-kondenzátumot alkotnak, a rácsrezgéseket reprezentáló fononokkal csatolva úgy képesek az anyagban elmozdulni, hogy az ütközések száma minimális, azaz az anyag ellenállása igen lecsökken. A Cooper-párok sugara nagyjából 100 nm, így átfedhetik egymást.[135][136] A BCS-elmélet sikerrel magyarázza az alacsony hőmérsékletű szupravezetést, azonban az, hogy a szupravezetés magasabb hőmérsékleten hogyan jöhet létre, még további kutatást igényel.
Az abszolút nulla fok közelében a becsapdázott elektron úgy viselkedik, mintha három kvázirészecske kölcsönhatásaként állna össze: tulajdonságai spinonra, orbitonra és holonra hasadnak szét, melyek közül az első hordozza a spint, a második a részecskepályát, a harmadik a töltést.[137][138]
Mozgás és energia[szerkesztés]

Einstein speciális relativitáselmélete szerint, ha egy elektron sebessége megközelíti a fénysebességet, akkor a megfigyelő szempontjából megnő a relativisztikus tömege, és nehezebb lesz gyorsítani. Például egy elektron sebessége megközelítheti a vákuumbeli fénysebességet, de nem érheti el. Ha azonban közel fénysebességgel haladó elektront dielektromos közegbe, például vízbe juttatunk, az elektron egy ideig gyorsabban haladhat a közegbeli fénysebességnél. A közeggel kölcsönhatva ekkor Cserenkov-sugárzást bocsát ki.[139]
A speciális relativitáselmélet hatásainak leírásakor a Lorentz-tényezőt alkalmazzák:
ahol c a fénysebesség, v pedig a részecske sebessége. A v sebességgel mozgó elektron Ke mozgási energiája: , ahol me az elektron tömege.
Például, a Stanford lineáris gyorsító az elektront 51 GeV-ra.[140] Hullámtermészete miatt az elektronnak de Broglie-hullámhossza is van. Ennek képlete λe = h/p, ahol h a Planck-állandó, p a momentum.[60] Például az 51 GeV energiához tartozó hullámhossz 2,4×10−17 m, ami elég kicsi ahhoz, hogy az atommagnál sokkal kisebb szerkezetek is vizsgálhatók legyenek.[141]
Keletkezése[szerkesztés]

Az ősrobbanás-elmélet a legelfogadottabb tudományos elmélet a világegyetem keletkezésére.[142] Az első ezredmásodpercben a hőmérséklet 10 milliárd Kelvin fölött volt, és a fotonok átlagos energiája meghaladta a millió elektronvoltot. Ez elég volt ahhoz, hogy elektron-pozitron párokat hozzanak létre. A fotonok, elektronok és pozitronok egyensúlya jellemezte az univerzumot 15 másodpercig. Ezután annyira lehűlt, hogy nem tudott több elektron-pozitron pár létrejönni. A legtöbb pár összetalálkozva szétsugárzódott, ami egy időre újra felmelegítette az univerzumot.[143]
Ismeretlen okokból a leptogenezis folyamán valamivel több elektron jött létre, mint pozitron.[144] Így minden milliárdból egy elektron élte túl a szétsugárzódást. Ugyanez volt a hatás a bariogenezisre is, így ugyanannyi proton maradt, mint elektron, ezzel az világegyetem töltésösszege nulla lett.[145][146] A megmaradt protonokból és neutronokból nukleoszintézissel a hidrogén, a hélium és nyomokban a lítium izotópjainak magjai jöttek létre. Ez 5 perccel az Univerzum keletkezése után érte el csúcsát. A kimaradt neutronok 1000 másodperces felezési idővel elbomlottak:
- n → p + e− + νe
A következő 300 000–400 000 évben a fölös elektronok túl nagy energiával bírtak ahhoz, hogy atomok részeivé váljanak.[147] Ezután jött el a rekombináció ideje, amikor semleges atomok jöttek létre, és a táguló Univerzum áthatolhatóvá vált a sugárzások számára.[148]
Az ősrobbanás után 1 millió évvel kezdődött a csillagok keletkezése. A csillagokban zajló nukleoszintézis neutronokat és pozitronokat termel. A pozitronok fogyasztják az elektronokat. Ezzel szemben a nukleoszintézis radioaktív magokat is létrehoz, amelyek egy része béta-bomlással bomlik, és elektront és antineutrinót bocsátanak ki.[149] Erre példa a kobalt-60, ami béta-bomlással nikkel-60-ná alakul.[150]

A 20 naptömegnél nehezebb csillagok magja a külső rétegeket ledobva életük végén magába roskad, és fekete lyukat hoz létre.[151] A klasszikus fizika szerint semmi, még elektromágneses sugárzás sem juthat ki belőle. A kvantummechanika szerint azonban a Hawking-sugárzás érkezhet az eseményhorizont mögül. Ennek a hatására szintén keletkezhetnek elektronok és pozitronok.
A Hawking-sugárzás mechanizmusa a következő: A fekete lyuk eseményhorizontja közelében virtuális részecskék jönnek létre. A fekete lyuk gravitációs potenciálja pozitív energiát juttat a pár egyik tagjának, és az valódi részecskévé válik,[152] míg a másik tagja negatív energiához jut, és csökkenti a fekete lyuk energiáját, így az lassanként párolog. A Hawking-sugárzás a csökkenéssel együtt erősödik, míg végül a fekete lyuk felrobban.[153]
A kozmikus sugarak nagy energiájú részecskékből állnak. Megfigyeltek már 3,0×1020 eV energiájú részecskéket is.[154] Ha ezek a Föld légkörének nukleonjaival találkoznak, akkor részecskezáport indítanak el, amiben többek között pionok is keletkeznek.[155] Az esetek többségében müonok érkeznek. A müonok a pionok bomlásának termékei:
- π− → μ− + νμ
A müon bomlása pedig elektront vagy pozitront termel:[156]
- μ− → e− + νe + νμ
Megfigyelése[szerkesztés]

Az elektronok távoli megfigyelése többek között a kibocsátott sugárzásuk által lehetséges. Például a csillagok koronájában az elektronok plazmát alkotnak, amelyekből fékezési sugárzás érkezhet. Elektrongázban kialakulhat plazmaoszcilláció is, mely egy közeg elektronsűrűségének nagy frekvenciával, szinkronban váltakozása, és amely rádióteleszkóppal megfigyelhető.[158]
A foton energiája frekvenciájával arányos. Amikor egy kötött pályájú elektron egyik atompályáról másikra lép, akkor meghatározott energiájú (és ennek megfelelő frekvenciájú) fotonokat nyel el vagy bocsát ki. Ha például az atomokon széles spektrumú fény hatol át, akkor bizonyos frekvenciák kiszűrődnek, az áthatolás után a spektrumban elnyelési vonalak jelennek meg. Minden elemnek megvannak a karakterisztikus elnyelési színképvonalai. Ennek köszönhetően spektroszkópiai elemzéssel egy vizsgált anyagban az egyes összetevők kimutathatók.[159][160]
Laboratóriumi körülmények között az egyes elektronok kölcsönhatásai részecskedetektorokkal figyelhetők meg, amelyekkel mérni lehet az energiát, a spint és a töltést. A Paul-csapda és a Penning-csapda lehetővé teszi töltött részecskék hosszabb ideig tartó becsapdázását és tárolását akár hónapokon át.[161] Ezen eszközök segítségével a részecskék tulajdonságai jól mérhetők. Az elektron mágneses momentumát 11 tizedesjegy pontossággal tudták megmérni, ami 1980-ban meghaladta a többi ismert fizikai állandó pontosságát.[162]
Az elektron energiaeloszlásának változását először a svéd Lundi Egyetemen filmezték le 2008 februárjában. A kutatók attoszekundumos fényvillanásokat használtak, így elsőként figyelhették meg közvetlenül egy elektron mozgását.[163][164]
Az elektronok szilárdtestbeli eloszlása például az impulzusfelbontású fotoemissziós spektroszkópia (ARPES) segítségével vizsgálható, mely a fényelektromos jelenségen alapulva képezi le a kristályos szilárdtest reciprokrácsát, melyből rácsjellemzőkre, szimmetriákra, összetételre lehet következtetni. Segítségével jellemezhetők a kristályrácsban az elektronra vonatkozó szórási jellemzők.[165]
Alkalmazások[szerkesztés]
Részecskenyalábok[szerkesztés]
Az irányított elektronnyaláb például alkalmazható hegesztésre.[166] A technika lehetővé teszi a 0,1–1,3 mm foltméretűre fókuszált, 107 W·cm−2 energiasűrűségű nyalábok előállítását. A nyalábot a munkadarabhoz vákuumon át kell elvezetni, különben az elektronok reakcióba lépnének a gázzal még mielőtt a hegesztés megtörténne. Ezzel olyan vezető anyagokat is összekapcsolnak, amiket nem lehetne hagyományos módon összehegeszteni.[167][168]
Az elektronsugaras litográfia (EBL) félvezető eszközök mikrométernél jóval nagyobb pontosságú gyártásához használják.[169] Az elektronsugarat vákuumtérben alkalmazzák. Az elektronok szóródása a szilárdtestekben kb. 10 nm-re korlátozza a pontosságot. A módszer lassúsága és költségessége miatt csak speciális integrált áramkörhöz, illetve alapkutatási kísérletekben használják a módszert, továbbá jellemzően elektronlitográfiával készülnek a jóval termelékenyebb fotolitográfia fotomaszkjai.[170]
Az elektronnyalábbal való besugárzást élelmiszerek és gyógyszerek sterilizálására alkalmazzák.[171] Nagymértékben lehet továbbá módosítani például üveges anyagok mechanikai jellemzőit, így viszkozitását anélkül, hogy a folyamat aktiválási energiájának eléréséhez az anyagot magas hőmérsékleten hőkezelni kellene.[172]
A lineáris részecskegyorsítók által kisugárzott elektronsugarakkal felszíni daganatokat kezelnek. Az elektronterápiával azért kezelhetők bőrsérülések és a bazális sejtkarciómák, mert az elektronnyaláb behatolási mélysége az emberi szövetben kicsi (5–20 MeV energia esetén tipikusan 5 cm), így nem hatol mélyre. Kiegészítésként használhatják a röntgenes besugárzási kezelések után.[173][174]
A részecskegyorsítók által kiadott szinkrotronsugárzást a részecskefizikában, atomfizikában és kémiai alapkutatásban alkalmazzák. Ezen eszközökben a mágneses térbe vezetett, spinpolarizált elektronok bocsátják ki az elektromágneses sugárzást: ezen viselkedést nevezik Szokolov–Tyernov-hatásnak. Az így nyert elektronsugarakkal különféle kísérleteket végeznek. A szinkrotronsugárzás az elektronok lassítására is használható. Az elektronok és pozitronok ütköztetése energiát hoz létre, amit szintén tanulmányoznak.[175]
Képalkotás[szerkesztés]
A kisenergiás elektrondiffrakció (LEED) egy olyan módszer, amely során kristályos anyagokat bombáznak elektronsugarakkal, az elektronok pedig az szilárdtest atomjain szóródnak. A visszaszórás miatt keletkező diffrakciós mintázatból következtetnek az anyag szerkezetére. Itt az elektronok energiája tipikusan 20–200 eV.[176] A nagyenergiás elektron-visszaszórás (RHEED) előzővel rokon eljárása a szilárdtestek felületi vizsgálataira alkalmazható. Az elektronnyaláb energiája 8–20 keV, a nyaláb beesési szöge pedig 1–4° közötti.[177][178]
Az elektronmikroszkóp fókuszált elektronsugarakat bocsát a tárgyra. Az elektronok egy részének a vizsgált anyag atomjaival való ütközés során megváltozik a mozgási iránya, szöge, fázisa és energiája. Ezek alapján megalkotható a tárgy közel atomi felbontású képe.[179] Az eljárás jelentőségét az adja, hogy a míg fénymikroszkópokban a diffrakciós korlát miatt kék fény használatával kb. 200 nm-es felbontás érhető el,[180] ez a megkötés elektronmikroszkópok esetén jóval nagyobb felbontást is megenged. Ennek az az oka, hogy a képalkotásra használt elektronok de Broglie-hullámhossza a fénymikroszkópban alkalmazott detektáló fényénél jóval rövidebb, például 100 000 V-os gyorsítófeszültség esetén 0,0037 nm.[181] A lencsehibák ellenében korrigált transzmissziós elektronmikroszkóp elvben képes 0,05 nm-nél is jobb felbontás elérésére, ami elég lenne ahhoz, hogy egyes atomokat láthatóvá tegyen, bár a gyakorlatban ennél kissé gyengébb felbontás a jellemző.[182] Az elektronmikroszkóp hasznos képalkotó segédeszköz a laboratóriumok számára, azonban technikai nehézségek (vákuumrendszer, minta-előkészítés technikai nehézségei, stb.) és a készülék nagy beruházás- és karbantartásigénye miatt csak speciális kutatási célokra alkalmazzák.
Az elektronmikroszkópnak két fő típusa létezik: a transzmissziós és a pásztázó elektronmikroszkóp. A transzmisszós elektronmikroszkóp esetén az elektronnyaláb keresztülhalad a tárgyon az áthaladt elektronokat mágneslencsével rávetítik a képalkotó felületre. A pásztázó elektronmikroszkópok a tárgy felszínéről visszaverődő elektronokkal vizsgálják a tárgyat. Mindkét típus nagyítása százszorostól egymilliószorosig, vagy akár még tovább is terjedhet.
A pásztázó alagútmikroszkópok az alagúteffektus elvét kihasználva végeznek képalkotást. E módszer lényege, hogy a vizsgált minta felszíne felett, annak „domborzatát” lekövetve hegyes, gyakorlatilag egyetlen atomban végződő tűt mozgatnak. A minta és a mérőtű távolságát a kettő közötti alagútáram szinten tartásával szabályozzák. Így a felület lepásztázásával magasságtérkép alakul ki, melynek felbontása az atomi mérettartományba esik. Az eszköz a felszín atomi szintű topológiai felmérése mellett elektronszerkezeti mérésekre, sőt, a felület módosítására, bizonyos korlátokkal akár egyedi atomok elmozdítására is alkalmazható.[183][184][185]
Más alkalmazások[szerkesztés]
A szabadelektron-lézerben (FEL) relativisztikus elektronsugár halad át egy dipólmágnesekből álló rácson (úgynevezett undulátoron), amiben a mágnesek azonos polaritással néznek egymás felé. Az elektronok szinkrotronsugárzást bocsátanak ki, amely koherensen kölcsönhat az elektronokkal, ami az eszköz rezonanciafrekvenciáján felerősíti a sugárzás intenzitását. A FEL különböző frekvencián képes koherens elektromágneses sugarakat kibocsátani, a mikrohullámoktól a lágy röntgensugarakig. Az eszközt elsősorban az iparban, a kommunikációban és a gyógyításban, és a tudományos alapkutatásban alkalmazzák.[186]
A modernebb technológiák elterjedéséig a katódsugárcsöveket széles körben használták, melyek megtalálhatóak voltak laboratóriumi berendezésekben, tévékészülékekben és képernyőkben.[187] A fotoelektron-sokszorozó csövekben a fotókatódhoz érkező fotonok elektronlavinát indítanak el, ami detektálható áramlökést produkál.
Az elektroncsövekben vezetett elektronsugarak elektromos jeleket közvetítenek, amivel a huszadik század első felében kritikus szerephez jutottak az elektrotechnikában. Idővel az elektroncsöveket felváltották a jóval nagyobb teljesítményű, kisebb méretű, csekélyebb energiafogyasztású és olcsóbb szilárdtest-eszközök, például tranzisztorok.[188]
Jegyzetek[szerkesztés]
- ↑ Thomson, J.J. (1897). „Cathode Rays”. Philosophical Magazine 44 (269), 293. o. DOI:10.1080/14786449708621070.
- ↑ CODATA electron mass (angol nyelven). (Hozzáférés: 2010. április 28.)
- ↑ CODATA electron mass in u (angol nyelven). (Hozzáférés: 2010. április 28.)
- ↑ CODATA elementary charge (angol nyelven). (Hozzáférés: 2010. április 28.)
- ↑ CODATA electron magnetic moment (angol nyelven). (Hozzáférés: 2010. április 28.)
- ↑ JERRY COFF. [2016. március 4-i dátummal az eredetiből archiválva]. (Hozzáférés: 2010. szeptember 10.)
- ↑ a b c d Curtis, L.J.. Atomic Structure and Lifetimes: A Conceptual Approach. Cambridge University Press, 74. o. (2003). ISBN 0-521-53635-9
- ↑ a b CODATA value: proton-electron mass ratio. 2006 CODATA recommended values. National Institute of Standards and Technology. [2009. december 13-i dátummal az eredetiből archiválva]. (Hozzáférés: 2009. július 18.)
- ↑ a b Pauling, L.C.. The Nature of the Chemical Bond and the Structure of Molecules and Crystals: an introduction to modern structural chemistry, 3rd, Cornell University Press, 4–10. o. (1960). ISBN 0-8014-0333-2
- ↑ Anastopoulos, C.. Particle Or Wave: The Evolution of the Concept of Matter in Modern Physics. Princeton University Press, 236–237. o. (2008). ISBN 0-691-13512-6
- ↑ a b Arabatzis, T.. Representing Electrons: A Biographical Approach to Theoretical Entities. University of Chicago Press, 70–74. o. (2006). ISBN 0-226-02421-0
- ↑ a b c d e Thomson, J.J. (1897). „Cathode Rays”. Philosophical Magazine 44 (269), 293. o. [2017. július 3-i dátummal az eredetiből archiválva]. DOI:10.1080/14786449708621070. (Hozzáférés: 2016. március 21.)
- ↑ a b c Dahl (1997:122–185).
- ↑ a b Wilson, R.. Astronomy Through the Ages: The Story of the Human Attempt to Understand the Universe. CRC Press, 138. o. (1997). ISBN 0-7484-0748-0
- ↑ CODATA elementary charge (angol nyelven). [2018. június 13-i dátummal az eredetiből archiválva]. (Hozzáférés: 2010. április 28.)
- ↑ CODATA electron mass in u (angol nyelven). [2011. augusztus 5-i dátummal az eredetiből archiválva]. (Hozzáférés: 2010. április 28.)
- ↑ CODATA electron mass (angol nyelven). [2011. június 5-i dátummal az eredetiből archiválva]. (Hozzáférés: 2010. április 28.)
- ↑ CODATA proton-electron mass ratio (angol nyelven). [2009. december 13-i dátummal az eredetiből archiválva]. (Hozzáférés: 2010. április 28.)
- ↑ CODATA electron molar mass (angol nyelven). [2012. június 3-i dátummal az eredetiből archiválva]. (Hozzáférés: 2012. április 12.)
- ↑ CODATA electron mass energy equivalent in MeV (angol nyelven). [2009. augusztus 4-i dátummal az eredetiből archiválva]. (Hozzáférés: 2010. április 28.)
- ↑ CODATA electron mass energy equivalent (angol nyelven). [2011. augusztus 5-i dátummal az eredetiből archiválva]. (Hozzáférés: 2010. április 28.)
- ↑ CODATA electron magnetic moment (angol nyelven). [2010. szeptember 6-i dátummal az eredetiből archiválva]. (Hozzáférés: 2010. április 28.)
- ↑ CODATA electron g factor (angol nyelven). [2010. szeptember 6-i dátummal az eredetiből archiválva]. (Hozzáférés: 2010. április 28.)
- ↑ Shipley, J.T.. Dictionary of Word Origins. The Philosophical Library, 133. o. (1945). ISBN 0-88029-751-4
- ↑ Baigrie, B.. Electricity and Magnetism: A Historical Perspective. Greenwood Press, 7–8. o. (2006). ISBN 0-313-33358-0
- ↑ Keithley, J.F.. The Story of Electrical and Magnetic Measurements: From 500 B.C. to the 1940s. IEEE Press, 15, 20. o. (1999). ISBN 0-7803-1193-0
- ↑ Benjamin Franklin (1706–1790). Eric Weisstein's World of Biography. Wolfram Research. [2017. október 18-i dátummal az eredetiből archiválva]. (Hozzáférés: 2010. december 16.)
- ↑ The Basics of Physics. Greenwood Publishing Group, 242. o. (2006). ISBN 0-313-32857-9. Hozzáférés ideje: 2016. február 28.
- ↑ Farrar, W.V. (1969). „Richard Laming and the Coal-Gas Industry, with His Views on the Structure of Matter”. Annals of Science 25 (3), 243–254. o. DOI:10.1080/00033796900200141.
- ↑ Barrow, J.D. (1983). „Natural Units Before Planck”. Quarterly Journal of the Royal Astronomical Society 24, 24–26. o.
- ↑ Sōgo Okamura. History of Electron Tubes. IOS Press, 11. o. (1994). ISBN 978-90-5199-145-1. Hozzáférés ideje: 2015. május 29. „In 1881, Stoney named this electromagnetic 'electrolion'. It came to be called 'electron' from 1891. [...] In 1906, the suggestion to call cathode ray particles 'electrions' was brought up but through the opinion of Lorentz of Holland 'electrons' came to be widely used.”
- ↑ Stoney, G.J. (1894). „Of the "Electron," or Atom of Electricity”. Philosophical Magazine 38 (5), 418–420. o. DOI:10.1080/14786449408620653.
- ↑ "electron, n.2". OED Online. March 2013. Oxford University Press. Accessed 12 April 2013 [1]
- ↑ Soukhanov, A.H. ed.. Word Mysteries & Histories. Houghton Mifflin Company, 73. o. (1986). ISBN 0-395-40265-4
- ↑ Guralnik, D.B. ed.. Webster's New World Dictionary. Prentice Hall, 450. o. (1970)
- ↑ Born, M.. Atomic Physics. Courier Dover, 26. o. (1989). ISBN 0-486-65984-4
- ↑ Dahl (1997:55–58).
- ↑ DeKosky, R.K. (1983). „William Crookes and the quest for absolute vacuum in the 1870s”. Annals of Science 40 (1), 1–18. o. DOI:10.1080/00033798300200101.
- ↑ a b Leicester, H.M.. The Historical Background of Chemistry. Courier Dover, 221–222. o. (1971). ISBN 0-486-61053-5
- ↑ Dahl (1997:64–78).
- ↑ Zeeman, P. (1907). „Sir William Crookes, F.R.S”. Nature 77 (1984), 1–3. o. DOI:10.1038/077001a0.
- ↑ Dahl (1997:99).
- ↑ Frank Wilczek: "Happy Birthday, Electron Archiválva 2013. november 1-i dátummal a Wayback Machine-ben" Scientific American, June 2012.
- ↑ Thomson, J.J.: Nobel Lecture: Carriers of Negative Electricity. The Nobel Foundation, 1906. [2008. október 10-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. augusztus 25.)
- ↑ Trenn, T.J. (1976). „Rutherford on the Alpha-Beta-Gamma Classification of Radioactive Rays”. Isis 67 (1), 61–75. o. DOI:10.1086/351545.
- ↑ Becquerel, H. (1900). „Déviation du Rayonnement du Radium dans un Champ Électrique” (francia nyelven). Comptes rendus de l'Académie des sciences 130, 809–815. o.
- ↑ Buchwald and Warwick (2001:90–91).
- ↑ Myers, W.G. (1976). „Becquerel's Discovery of Radioactivity in 1896”. Journal of Nuclear Medicine 17 (7), 579–582. o. [2008. december 22-i dátummal az eredetiből archiválva]. PMID 775027. (Hozzáférés: 2016. március 1.)
- ↑ Kikoin, I. K. (1961). „Abram Fjodorovics Ioffe akadémikus (80. születésnapjára)”. A fizikai tudományok sikerei 3 (5), 798–809. o. DOI:10.1070/PU1961v003n05ABEH005812. Original publication in Russian: Кикоин, И. К. (1960). „Академик А. Ф. Иоффе”. Успехи Физических Наук 72 (10), 303–321. o. [2018. október 9-i dátummal az eredetiből archiválva]. (Hozzáférés: 2016. március 2.)
- ↑ Das Gupta, N.N. (1999). „A Report on the Wilson Cloud Chamber and Its Applications in Physics”. Reviews of Modern Physics 18 (2), 225–290. o. DOI:10.1103/RevModPhys.18.225.
- ↑ a b c Smirnov, B.M.. Physics of Atoms and Ions. Springer, 14–21. o. (2003). ISBN 0-387-95550-X
- ↑ Bohr, N.: Nobel Lecture: The Structure of the Atom. The Nobel Foundation, 1922. [2008. december 3-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. december 3.)
- ↑ Lewis, G.N. (1916). „The Atom and the Molecule”. Journal of the American Chemical Society 38 (4), 762–786. o. DOI:10.1021/ja02261a002.
- ↑ a b Arabatzis, T. (1997). „The chemists' electron”. European Journal of Physics 18 (3), 150–163. o. DOI:10.1088/0143-0807/18/3/005.
- ↑ Langmuir, I. (1919). „The Arrangement of Electrons in Atoms and Molecules”. Journal of the American Chemical Society 41 (6), 868–934. o. DOI:10.1021/ja02227a002.
- ↑ Scerri, E.R.. The Periodic Table. Oxford University Press, 205–226. o. (2007). ISBN 0-19-530573-6
- ↑ Massimi, M.. Pauli's Exclusion Principle, The Origin and Validation of a Scientific Principle. Cambridge University Press, 7–8. o. (2005). ISBN 0-521-83911-4
- ↑ Uhlenbeck, G.E. (1925). „Ersetzung der Hypothese vom unmechanischen Zwang durch eine Forderung bezüglich des inneren Verhaltens jedes einzelnen Elektrons” (német nyelven). Die Naturwissenschaften 13 (47), 953. o. DOI:10.1007/BF01558878.
- ↑ Pauli, W. (1923). „Über die Gesetzmäßigkeiten des anomalen Zeemaneffektes” (német nyelven). Zeitschrift für Physik 16 (1), 155–164. o. DOI:10.1007/BF01327386.
- ↑ a b de Broglie, L.: Nobel Lecture: The Wave Nature of the Electron. The Nobel Foundation, 1929. [2008. október 4-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. augusztus 30.)
- ↑ Falkenburg, B.. Particle Metaphysics: A Critical Account of Subatomic Reality. Springer, 85. o. (2007). ISBN 3-540-33731-8
- ↑ Davisson, C.: Nobel Lecture: The Discovery of Electron Waves. The Nobel Foundation, 1937. [2008. július 9-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. augusztus 30.)
- ↑ Schrödinger, E. (1926). „Quantisierung als Eigenwertproblem” (német nyelven). Annalen der Physik 385 (13), 437–490. o. DOI:10.1002/andp.19263851302.
- ↑ Rigden, J.S.. Hydrogen. Harvard University Press, 59–86. o. (2003). ISBN 0-674-01252-6
- ↑ Reed, B.C.. Quantum Mechanics. Jones & Bartlett Publishers, 275–350. o. (2007). ISBN 0-7637-4451-4
- ↑ Dirac, P.A.M. (1928). „The Quantum Theory of the Electron”. Proceedings of the Royal Society A 117 (778), 610–624. o. DOI:10.1098/rspa.1928.0023.
- ↑ Dirac, P.A.M.: Nobel Lecture: Theory of Electrons and Positrons. The Nobel Foundation, 1933. [2008. július 23-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. november 1.)
- ↑ Lamb-eltolódás. www.vilaglex.hu. [2017. október 1-i dátummal az eredetiből archiválva]. (Hozzáférés: 2017. június 22.)
- ↑ The Nobel Prize in Physics 1965. The Nobel Foundation. [2008. október 24-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. november 4.)
- ↑ Panofsky, W.K.H. (1997). „The Evolution of Particle Accelerators & Colliders”. Beam Line 27 (1), 36–44. o, Kiadó: Stanford University. [2016. június 3-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. szeptember 15.)
- ↑ Elder, F.R. (1947). „Radiation from Electrons in a Synchrotron”. Physical Review 71 (11), 829–830. o. DOI:10.1103/PhysRev.71.829.5.
- ↑ Hoddeson, L.. The Rise of the Standard Model: Particle Physics in the 1960s and 1970s. Cambridge University Press, 25–26. o. (1997). ISBN 0-521-57816-7
- ↑ Bernardini, C. (2004). „AdA: The First Electron–Positron Collider”. Physics in Perspective 6 (2), 156–183. o. DOI:10.1007/s00016-003-0202-y.
- ↑ Testing the Standard Model: The LEP experiments. CERN, 2008. [2013. február 13-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. szeptember 15.)
- ↑ (2000) „LEP reaps a final harvest”. CERN Courier 40 (10). [2010. november 21-i dátummal az eredetiből archiválva]. (Hozzáférés: 2016. március 6.)
- ↑ (2012) „Few electron limit of n-type metal oxide semiconductor single electron transistors”. Nanotechnology 23 (21), 215204. o. DOI:10.1088/0957-4484/23/21/215204. PMID 22552118.
- ↑ Frampton, P.H. (2000). „Quarks and Leptons Beyond the Third Generation”. Physics Reports 330 (5–6), 263–348. o. DOI:10.1016/S0370-1573(99)00095-2.
- ↑ a b c Raith, W.. Constituents of Matter: Atoms, Molecules, Nuclei and Particles. CRC Press, 777–781. o. (2001). ISBN 0-8493-1202-7
- ↑ a b c d e f g h The original source for CODATA is Mohr, P.J. (2006). „CODATA recommended values of the fundamental physical constants”. Reviews of Modern Physics 80 (2), 633–730. o. DOI:10.1103/RevModPhys.80.633.
- Individual physical constants from the CODATA are available at: The NIST Reference on Constants, Units and Uncertainty. National Institute of Standards and Technology. [2013. október 14-i dátummal az eredetiből archiválva]. (Hozzáférés: 2009. január 15.)
- ↑ Zombeck, M.V.. Handbook of Space Astronomy and Astrophysics, 3rd, Cambridge University Press, 14. o. (2007). ISBN 0-521-78242-2
- ↑ Murphy, M.T. (2008). „Strong Limit on a Variable Proton-to-Electron Mass Ratio from Molecules in the Distant Universe”. Science 320 (5883), 1611–1613. o. [2008. augusztus 1-i dátummal az eredetiből archiválva]. DOI:10.1126/science.1156352. PMID 18566280. (Hozzáférés: 2016. március 7.)
- ↑ Zorn, J.C. (1963). „Experimental Limits for the Electron-Proton Charge Difference and for the Charge of the Neutron”. Physical Review 129 (6), 2566–2576. o. DOI:10.1103/PhysRev.129.2566.
- ↑ a b Odom, B. (2006). „New Measurement of the Electron Magnetic Moment Using a One-Electron Quantum Cyclotron”. Physical Review Letters 97 (3), 030801. o. DOI:10.1103/PhysRevLett.97.030801. PMID 16907490.
- ↑ Anastopoulos, C.. Particle Or Wave: The Evolution of the Concept of Matter in Modern Physics. Princeton University Press, 261–262. o. (2008). ISBN 0-691-13512-6
- ↑ Eichten, E.J. (1983). „New Tests for Quark and Lepton Substructure”. Physical Review Letters 50 (11), 811–814. o. DOI:10.1103/PhysRevLett.50.811.
- ↑ Gabrielse, G. (2006). „New Determination of the Fine Structure Constant from the Electron g Value and QED”. Physical Review Letters 97 (3), 030802(1–4). o. DOI:10.1103/PhysRevLett.97.030802.
- ↑ Eduard Shpolsky, Atomic physics (Atomnaia fizika),second edition, 1951
- ↑ Dehmelt, H. (1988). „A Single Atomic Particle Forever Floating at Rest in Free Space: New Value for Electron Radius”. Physica Scripta T22, 102–10. o. DOI:10.1088/0031-8949/1988/T22/016.
- ↑ Meschede, D.. Optics, light and lasers: The Practical Approach to Modern Aspects of Photonics and Laser Physics. Wiley-VCH, 168. o. (2004). ISBN 3-527-40364-7
- ↑ Steinberg, R.I. (1999). „Experimental test of charge conservation and the stability of the electron”. Physical Review D 61 (2), 2582–2586. o. DOI:10.1103/PhysRevD.12.2582.
- ↑ Agostini M. et al. (Borexino Coll.) (2015). „Test of Electric Charge Conservation with Borexino”. Physical Review Letters 115 (23), 231802. o. DOI:10.1103/PhysRevLett.115.231802.
- ↑ J. Beringer (Particle Data Group) (2012). „Review of Particle Physics: [electron properties]”. Physical Review D 86 (1), 010001. o. [2016. március 3-i dátummal az eredetiből archiválva]. DOI:10.1103/PhysRevD.86.010001. (Hozzáférés: 2016. március 9.)
- ↑ Back, H. O. (2002). „Search for electron decay mode e → γ + ν with prototype of Borexino detector”. Physics Letters B 525, 29–40. o. DOI:10.1016/S0370-2693(01)01440-X.
- ↑ a b c d e Munowitz, M.. Knowing, The Nature of Physical Law. Oxford University Press (2005). ISBN 0-19-516737-6
- ↑ Kane, G.: Are virtual particles really constantly popping in and out of existence? Or are they merely a mathematical bookkeeping device for quantum mechanics?. Scientific American, 2006. október 9. (Hozzáférés: 2008. szeptember 19.)
- ↑ Taylor, J..szerk.: Davies, Paul: Gauge Theories in Particle Physics, The New Physics. Cambridge University Press, 464. o. (1989). ISBN 0-521-43831-4
- ↑ a b Genz, H.. Nothingness: The Science of Empty Space. Da Capo Press, 241–243, 245–247. o. (2001). ISBN 0-7382-0610-5
- ↑ Gribbin, J.. „More to electrons than meets the eye”, New Scientist, 1997. január 25.. [2011. június 23-i dátummal az eredetiből archiválva] (Hozzáférés: 2008. szeptember 17.)
- ↑ Levine, I. (1997). „Measurement of the Electromagnetic Coupling at Large Momentum Transfer”. Physical Review Letters 78 (3), 424–427. o. DOI:10.1103/PhysRevLett.78.424.
- ↑ Murayama, H. (2006. március 10.). „Supersymmetry Breaking Made Easy, Viable and Generic”..
- ↑ Schwinger, J. (1948). „On Quantum-Electrodynamics and the Magnetic Moment of the Electron”. Physical Review 73 (4), 416–417. o. DOI:10.1103/PhysRev.73.416.
- ↑ Huang, K.. Fundamental Forces of Nature: The Story of Gauge Fields. World Scientific, 123–125. o. (2007). ISBN 981-270-645-3
- ↑ Foldy, L.L. (1950). „On the Dirac Theory of Spin 1/2 Particles and Its Non-Relativistic Limit”. Physical Review 78, 29–36. o. DOI:10.1103/PhysRev.78.29.
- ↑ Sidharth, B.G. (2008). „Revisiting Zitterbewegung”. International Journal of Theoretical Physics 48 (2), 497–506. o. DOI:10.1007/s10773-008-9825-8.
- ↑ Elliott, R.S. (1978). „The History of Electromagnetics as Hertz Would Have Known It”. IEEE Transactions on Microwave Theory and Techniques 36 (5), 806–823. o. DOI:10.1109/22.3600.
- ↑ Mahadevan, R. (1996). „Harmony in Electrons: Cyclotron and Synchrotron Emission by Thermal Electrons in a Magnetic Field”. The Astrophysical Journal 465, 327–337. o. DOI:10.1086/177422.
- ↑ Rohrlich, F. (1999). „The Self-Force and Radiation Reaction”. American Journal of Physics 68 (12), 1109–1112. o. DOI:10.1119/1.1286430.
- ↑ Georgi, H..szerk.: Davies, Paul: Grand Unified Theories, The New Physics. Cambridge University Press, 427. o. (1989). ISBN 0-521-43831-4
- ↑ Blumenthal, G.J. (1970). „Bremsstrahlung, Synchrotron Radiation, and Compton Scattering of High-Energy Electrons Traversing Dilute Gases”. Reviews of Modern Physics 42 (2), 237–270. o. DOI:10.1103/RevModPhys.42.237.
- ↑ Staff: The Nobel Prize in Physics 1927. The Nobel Foundation, 2008. [2008. október 24-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. szeptember 28.)
- ↑ Chen, S.-Y. (1998). „Experimental observation of relativistic nonlinear Thomson scattering”. Nature 396 (6712), 653–655. o. DOI:10.1038/25303.
- ↑ Beringer, R. (1942). „The Angular Distribution of Positron Annihilation Radiation”. Physical Review 61 (5–6), 222–224. o. DOI:10.1103/PhysRev.61.222.
- ↑ Buffa, A.. College Physics, 4th, Prentice Hall, 888. o. (2000). ISBN 0-13-082444-5
- ↑ Eichler, J. (2005). „Electron–positron pair production in relativistic ion–atom collisions”. Physics Letters A 347 (1–3), 67–72. o. DOI:10.1016/j.physleta.2005.06.105.
- ↑ Hubbell, J.H. (2006). „Electron positron pair production by photons: A historical overview”. Radiation Physics and Chemistry 75 (6), 614–623. o. DOI:10.1016/j.radphyschem.2005.10.008.
- ↑ Quigg, C. (2000. június 4.). „The Electroweak Theory”..
- ↑ Mulliken, R.S. (1967). „Spectroscopy, Molecular Orbitals, and Chemical Bonding”. Science 157 (3784), 13–24. o. DOI:10.1126/science.157.3784.13. PMID 5338306.
- ↑ Burhop, E.H.S.. The Auger Effect and Other Radiationless Transitions. Cambridge University Press, 2–3. o. (1952). ISBN 0-88275-966-3
- ↑ Grupen, C. (2000). „Physics of Particle Detection”. AIP Conference Proceedings 536, 3–34. o. DOI:10.1063/1.1361756.
- ↑ Jiles, D.. Introduction to Magnetism and Magnetic Materials. CRC Press, 280–287. o. (1998). ISBN 0-412-79860-3
- ↑ Löwdin, P.O.. Fundamental World of Quantum Chemistry: A Tribute to the Memory of Per- Olov Löwdin. Springer, 393–394. o. (2003). ISBN 1-4020-1290-X
- ↑ McQuarrie, D.A.. Physical Chemistry: A Molecular Approach. University Science Books, 325–361. o. (1997). ISBN 0-935702-99-7
- ↑ Daudel, R. (1973). „The Electron Pair in Chemistry”. Canadian Journal of Chemistry 52 (8), 1310–1320. o. [2014. január 8-i dátummal az eredetiből archiválva]. DOI:10.1139/v74-201. (Hozzáférés: 2016. március 16.)
- ↑ Rakov, V.A.. Lightning: Physics and Effects. Cambridge University Press, 4. o. (2007). ISBN 0-521-03541-4
- ↑ Freeman, G.R. (1999). „Triboelectricity and some associated phenomena”. Materials Science and Technology 15 (12), 1454–1458. o. DOI:10.1179/026708399101505464.
- ↑ Forward, K.M. (2009). „Methodology for studying particle–particle triboelectrification in granular materials”. Journal of Electrostatics 67 (2–3), 178–183. o. DOI:10.1016/j.elstat.2008.12.002.
- ↑ Weinberg, S.. The Discovery of Subatomic Particles. Cambridge University Press, 15–16. o. (2003). ISBN 0-521-82351-X
- ↑ Lou, L.-F.. Introduction to phonons and electrons. World Scientific, 162, 164. o. (2003). ISBN 978-981-238-461-4
- ↑ Guru, B.S.. Electromagnetic Field Theory. Cambridge University Press, 138, 276. o. (2004). ISBN 0-521-83016-8
- ↑ Achuthan, M.K.. Fundamentals of Semiconductor Devices. Tata McGraw-Hill, 49–67. o. (2007). ISBN 0-07-061220-X
- ↑ a b Ziman, J.M.. Electrons and Phonons: The Theory of Transport Phenomena in Solids. Oxford University Press, 260. o. (2001). ISBN 0-19-850779-8
- ↑ Main, P. (1993. június 12.). „When electrons go with the flow: Remove the obstacles that create electrical resistance, and you get ballistic electrons and a quantum surprise”. New Scientist 1887, 30. o. [2011. június 23-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. október 9.)
- ↑ Blackwell, G.R.. The Electronic Packaging Handbook. CRC Press, 6.39–6.40. o. (2000). ISBN 0-8493-8591-1
- ↑ Durrant, A.. Quantum Physics of Matter: The Physical World. CRC Press, 43, 71–78. o. (2000). ISBN 0-7503-0721-8. Hozzáférés ideje: 2016. március 21.
- ↑ Staff: The Nobel Prize in Physics 1972. The Nobel Foundation, 2008. [2008. október 11-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. október 13.)
- ↑ Kadin, A.M. (2007). „Spatial Structure of the Cooper Pair”. Journal of Superconductivity and Novel Magnetism 20 (4), 285–292. o. DOI:10.1007/s10948-006-0198-z.
- ↑ Discovery About Behavior Of Building Block Of Nature Could Lead To Computer Revolution. ScienceDaily, 2009. július 31. [2019. április 4-i dátummal az eredetiből archiválva]. (Hozzáférés: 2009. augusztus 1.)
- ↑ Jompol, Y. (2009). „Probing Spin-Charge Separation in a Tomonaga-Luttinger Liquid”. Science 325 (5940), 597–601. o. [2009. augusztus 8-i dátummal az eredetiből archiválva]. DOI:10.1126/science.1171769. PMID 19644117. (Hozzáférés: 2016. március 21.)
- ↑ Staff: The Nobel Prize in Physics 1958, for the discovery and the interpretation of the Cherenkov effect. The Nobel Foundation, 2008. [2008. október 18-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. szeptember 25.)
- ↑ Staff: Special Relativity. Stanford Linear Accelerator Center, 2008. augusztus 26. [2008. augusztus 28-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. szeptember 25.)
- ↑ Adams, S.. Frontiers: Twentieth Century Physics. CRC Press, 215. o. (2000). ISBN 0-7484-0840-1
- ↑ Lurquin, P.F.. The Origins of Life and the Universe. Columbia University Press, 2. o. (2003). ISBN 0-231-12655-7
- ↑ Silk, J.. The Big Bang: The Creation and Evolution of the Universe, 3rd, Macmillan, 110–112, 134–137. o. (2000). ISBN 0-8050-7256-X
- ↑ Christianto, V. (2007). „Thirty Unsolved Problems in the Physics of Elementary Particles”. Progress in Physics 4, 112–114. o. [2008. szeptember 10-i dátummal az eredetiből archiválva]. (Hozzáférés: 2010. február 28.)
- ↑ Kolb, E.W. (1980). „The Development of Baryon Asymmetry in the Early Universe”. Physics Letters B 91 (2), 217–221. o. DOI:10.1016/0370-2693(80)90435-9.
- ↑ Sather, E.: The Mystery of Matter Asymmetry. Beam Line. University of Stanford, 1996 [2008. október 12-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. november 1.)
- ↑ Boesgaard, A.M. (1985). „Big bang nucleosynthesis – Theories and observations”. Annual Review of Astronomy and Astrophysics 23 (2), 319–378. o. DOI:10.1146/annurev.aa.23.090185.001535.
- ↑ Barkana, R. (2006). „The First Stars in the Universe and Cosmic Reionization”. Science 313 (5789), 931–934. o. [2008. december 7-i dátummal az eredetiből archiválva]. DOI:10.1126/science.1125644. PMID 16917052. (Hozzáférés: 2016. március 21.)
- ↑ Burbidge, E.M. (1957). „Synthesis of Elements in Stars”. Reviews of Modern Physics 29 (4), 548–647. o. DOI:10.1103/RevModPhys.29.547.
- ↑ Rodberg, L.S. (1957). „Fall of Parity: Recent Discoveries Related to Symmetry of Laws of Nature”. Science 125 (3249), 627–633. o. DOI:10.1126/science.125.3249.627. PMID 17810563.
- ↑ Fryer, C.L. (1999). „Mass Limits For Black Hole Formation”. The Astrophysical Journal 522 (1), 413–418. o. DOI:10.1086/307647.
- ↑ Parikh, M.K. (2000). „Hawking Radiation As Tunneling”. Physical Review Letters 85 (24), 5042–5045. o. DOI:10.1103/PhysRevLett.85.5042. PMID 11102182.
- ↑ Hawking, S.W. (1974). „Black hole explosions?”. Nature 248 (5443), 30–31. o. DOI:10.1038/248030a0.
- ↑ Halzen, F. (2002). „High-energy neutrino astronomy: the cosmic ray connection”. Reports on Progress in Physics 66 (7), 1025–1078. o. DOI:10.1088/0034-4885/65/7/201.
- ↑ Ziegler, J.F. (1998). „Terrestrial cosmic ray intensities”. IBM Journal of Research and Development 42 (1), 117–139. o. DOI:10.1147/rd.421.0117.
- ↑ Sutton, C.. „Muons, pions and other strange particles”, New Scientist, 1990. augusztus 4.. [2011. június 23-i dátummal az eredetiből archiválva] (Hozzáférés: 2008. augusztus 28.)
- ↑ Wolpert, S.. „Scientists solve 30-year-old aurora borealis mystery”, University of California, 2008. július 24.. [2008. augusztus 17-i dátummal az eredetiből archiválva] (Hozzáférés: 2008. október 11.)
- ↑ Gurnett, D.A. (1976). „Electron Plasma Oscillations Associated with Type III Radio Bursts”. Science 194 (4270), 1159–1162. o. DOI:10.1126/science.194.4270.1159. PMID 17790910.
- ↑ Martin, W.C.: Atomic Spectroscopy: A Compendium of Basic Ideas, Notation, Data, and Formulas. National Institute of Standards and Technology, 2007. [2007. február 8-i dátummal az eredetiből archiválva]. (Hozzáférés: 2007. január 8.)
- ↑ Fowles, G.R.. Introduction to Modern Optics. Courier Dover, 227–233. o. (1989). ISBN 0-486-65957-7
- ↑ Staff: The Nobel Prize in Physics 1989. The Nobel Foundation, 2008. [2008. szeptember 28-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. szeptember 24.)
- ↑ Ekstrom, P. (1980). „The isolated Electron”. Scientific American 243 (2), 91–101. o. [2008. október 2-i dátummal az eredetiből archiválva]. DOI:10.1038/scientificamerican0880-104. (Hozzáférés: 2008. szeptember 24.)
- ↑ Mauritsson, J.: Electron filmed for the first time ever. Lund University. [2009. március 25-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. szeptember 17.)
- ↑ Mauritsson, J. (2008). „Coherent Electron Scattering Captured by an Attosecond Quantum Stroboscope”. Physical Review Letters 100 (7), 073003. o. [2017. június 23-i dátummal az eredetiből archiválva]. DOI:10.1103/PhysRevLett.100.073003. PMID 18352546. (Hozzáférés: 2016. március 21.)
- ↑ Damascelli, A. (2004). „Probing the Electronic Structure of Complex Systems by ARPES”. Physica Scripta T109, 61–74. o. DOI:10.1238/Physica.Topical.109a00061.
- ↑ Elmer, J.: Standardizing the Art of Electron-Beam Welding. Lawrence Livermore National Laboratory, 2008. március 3. [2008. szeptember 20-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. október 16.)
- ↑ Schultz, H.. Electron Beam Welding. Woodhead Publishing, 2–3. o. (1993). ISBN 1-85573-050-2
- ↑ Benedict, G.F.. Nontraditional Manufacturing Processes, Manufacturing engineering and materials processing. CRC Press, 273. o. (1987). ISBN 0-8247-7352-7
- ↑ Ozdemir, F.S. (1979. június 25.). „Electron beam lithography”.: 383–391, San Diego, CA, USA: IEEE Press. Hozzáférés: 2008. október 16.
- ↑ Madou, M.J.. Fundamentals of Microfabrication: the Science of Miniaturization, 2nd, CRC Press, 53–54. o. (2002). ISBN 0-8493-0826-7
- ↑ Jongen, Y. (1996. május 2.). „Electron Beam Scanning in Industrial Applications”., Amerikai Fizikai Társaság.
- ↑ Mobus G. et al. (2010). Journal of Nuclear Materials, v. 396, 264–271, doi:10.1016/j.jnucmat.2009.11.020
- ↑ Beddar, A.S. (2001). „Mobile linear accelerators for intraoperative radiation therapy”. AORN Journal 74 (5), 700. o. DOI:10.1016/S0001-2092(06)61769-9.
- ↑ Gazda, M.J.: Principles of Radiation Therapy, 2007. június 1. [2013. november 2-i dátummal az eredetiből archiválva]. (Hozzáférés: 2013. október 31.)
- ↑ Chao, A.W.. Handbook of Accelerator Physics and Engineering. World Scientific, 155, 188. o. (1999). ISBN 981-02-3500-3
- ↑ Oura, K.. Surface Science: An Introduction. Springer, 1–45. o. (2003). ISBN 3-540-00545-5
- ↑ Ichimiya, A.. Reflection High-energy Electron Diffraction. Cambridge University Press, 1. o. (2004). ISBN 0-521-45373-9
- ↑ Heppell, T.A. (1967). „A combined low energy and reflection high energy electron diffraction apparatus”. Journal of Scientific Instruments 44 (9), 686–688. o. DOI:10.1088/0950-7671/44/9/311.
- ↑ McMullan, D.: Scanning Electron Microscopy: 1928–1965. University of Cambridge, 1993. [2018. január 22-i dátummal az eredetiből archiválva]. (Hozzáférés: 2009. március 23.)
- ↑ Slayter, H.S.. Light and electron microscopy. Cambridge University Press, 1. o. (1992). ISBN 0-521-33948-0
- ↑ Cember, H.. Introduction to Health Physics. McGraw-Hill Professional, 42–43. o. (1996). ISBN 0-07-105461-8
- ↑ Erni, R. (2009). „Atomic-Resolution Imaging with a Sub-50-pm Electron Probe”. Physical Review Letters 102 (9), 096101. o. DOI:10.1103/PhysRevLett.102.096101. PMID 19392535.
- ↑ Bozzola, J.J.. Electron Microscopy: Principles and Techniques for Biologists. Jones & Bartlett Publishers, 12, 197–199. o. (1999). ISBN 0-7637-0192-0
- ↑ Flegler, S.L.. Scanning and Transmission Electron Microscopy: An Introduction, Reprint, Oxford University Press, 43–45. o. (1995). ISBN 0-19-510751-9
- ↑ Bozzola, J.J.. Electron Microscopy: Principles and Techniques for Biologists, 2nd, Jones & Bartlett Publishers, 9. o. (1999). ISBN 0-7637-0192-0
- ↑ Freund, H.P.. Principles of Free-Electron Lasers. Springer, 1–30. o. (1996). ISBN 0-412-72540-1
- ↑ Kitzmiller, J.W.. Television Picture Tubes and Other Cathode-Ray Tubes: Industry and Trade Summary. DIANE Publishing, 3–5. o. (1995). ISBN 0-7881-2100-6
- ↑ Staff: The History of the Integrated Circuit. The Nobel Foundation, 2008. [2008. december 1-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. október 18.)
További információk[szerkesztés]
- Dávid Gyula: A szilárd anyag szilárdítója - avagy univerzális elektronika. Lejátszás, Vetítés.
Fordítás[szerkesztés]
Ez a szócikk részben vagy egészben az Electron című angol Wikipédia-szócikk fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.





