Kristályszerkezet

A kristályszerkezet a kristályos anyagban lévő atomok, ionok vagy molekulák szerkezete, amely szabályos, térbeli rendezettséggel bír.[1][2] A kristályszerkezetet a tér minden irányában periodikusan ismétlődő elemi cella alkotja. A kristályszerkezet vizsgálata a kristálytan tudományágának a tárgya. A kristálytan a kristályok külső alakját és belső szerkezeti felépítését vizsgálja.
Alapfogalmak
[szerkesztés]A kristályok vizsgálata során használt, alapvető kifejezések terén széleskörű zavar mutatkozik: gyakran összekeverik a kristályrendszert a kristálycsaláddal, a rácsrendszert a kristályrendszerrel, illetve a kristályszerkezetet a kristályráccsal. Emiatt fontos a jelentésbeli különbségtétel a fogalmak között.
A kristályszerkezet a kristályos anyagban lévő részecskék szabályos elrendeződése a háromdimenziós térben.[3] Ezzel szemben a kristályrács csak képzeletbeli pontok tömbje, bár a kristályrácspontok hagyományosan az elemi cella sarkaiba vannak helyezve, ezért könnyű összekeverni a két kifejezést.[2]
A kristályrács olyan matematikai koncepció, amelyben a rácspontok szabályos, geometriai elrendeződésben vannak, és periodikusan ismétlődnek. A kristályrácsban lévő rácspontok megfeleltethetők az adott kristályos anyag részecskéivel.[2][4]
A Bravais-rács a kristálytan egy geometriai modellje, amelyet kristályok szerkezetének leírásához alkalmaznak. A kristályrács általános fogalmához egy csoportosítási módszert ad, segítségével a kristályok szimmetriái, és az azzal kapcsolatos törvényszerűségek írhatók le. A Bravais-rácsokat hét rácsrendszer és négy rácstípus kombinációja adja az ekvivalens rácsok kiszűrése után. Ennek értelmében a háromdimenziós térben a Bravais-rácsnak 14 lehetséges típusa fordulhat elő, melyekbe minden kristályos anyag besorolható.[3]
A kristálycsalád a tércsoportok legalapabb készlete, mely tartalmazza a 32 kristályosztály mindegyikét. A kristálycsaládokat rácsok és pontcsoportok határozzák meg. Térbeli vonatkozásban a kristálycsaládok és kristályrendszerek megegyeznek, kivéve a hexagonális és trigonális kristályrendszereket, melyek ugyanabba a hexagonális kristálycsaládba vannak egyesítve. Összesen hat kristálycsalád létezik: monoklin, triklin, ortorombos, tetragonális, hexagonális és köbös.
A kristályrendszer a kristályrácsok elemi cellája alapján besorolt hét rendszer (monoklin, triklin, ortorombos, trigonális, tetragonális, hexagonális, köbös) valamelyike.[5]
Az anyagok kristályos és amorf szerkezete
[szerkesztés]Az ásványok alaktani és fizikai tulajdonságaik alapján kétfélék lehetnek.
- Alaktalanok vagyis amorfok, melyeknek semmiféle jellegzetes alakjuk nincs és fizikai tulajdonságaik minden irányban megegyeznek, ezek izotrópok.
- Kristályosak, amelyeknek valamilyen törvényszerű, illetve szimmetrikus térrácsban helyezkednek el az alkotórészek, ebből következően kifejlődésük is felismerhető szabályossággal rendelkezik.
A kristályok többségének fizikai sajátosságai csak a párhuzamos irányokban azonosak, a különböző irányokban eltérőek, ezeket anizotrópnak nevezzük. Az ásványok zöme anizotróp tulajdonságú kristályokból épül fel, vagyis jellemzőjük a kristályszerkezet, az alkotóelemek térbeli elhelyezkedése, vagyis az a kristályrács, ami különböző szimmetriákban nyilvánul meg, és egyes ásványfajtákon belül különböző is lehet.
Illeszkedés a kristályokban
[szerkesztés]A részecskék illeszkedését a kristályrácsokban kristályilleszkedésnek hívják, amelyet két fő törekvés szabályoz. Egyrészt a legszorosabb illeszkedés elve alapján a rácsot alkotó molekulák úgy helyezkednek el, hogy közöttük a lehető legkisebb üres tér maradjon. Másrészt pedig a legnagyobb vonzás elve arra készteti a rácsban lévő részecskéket, hogy elhelyezkedésükkel elősegítsék a minél nagyobb vonzás létrejöttét. Ez leginkább akkor tud érvényesülni, ha a részecskék töltéssel vagy polaritással rendelkeznek, és úgy rendeződnek, hogy az ellentétes töltések minél közelebb legyenek egymáshoz, ezáltal ionkötést vagy hidrogénkötést kialakítva.[6]
A kristályrácsok típusai
[szerkesztés]A kristályrácsot atomok, ionok, és molekulák is alkothatják. A rácspontokon elhelyezkedő kristályrácsalkotók közötti kötés jellege szerint négy különböző kristályrácstípust ismerünk: atom-, ion-, molekula- és fémrácsot. A kristályrács felépítése során a rácspontba beépülő elemek energiát adnak le, ezért a kristályrács felbomlásához energiabefektetés szükséges.
Hét kristályrendszer
[szerkesztés]A kristályszerkezet alapján hét kristályrendszert és ezeken belül 32 kristályosztályt különböztetnek meg. A hét kristályrendszer egyben önálló koordináta-rendszer is, tengelykeresztjük meghatározó jelentőségű, mert tartalmazza a lehetséges szimmetriaelemeket. Egyes ásványok többféle kristályrendszerben is előfordulnak (például kén).
Triklin (háromhajlású) kristályrendszer
[szerkesztés]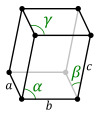
A tengelykeresztek különböző egységhosszúak és különböző szögeket zárnak be egymással. A legkevesebb szimmetriaelemmel rendelkezik, jellemző szimmetriatengelye nincs, minden kristálylap különálló és egyedi. A triklin rendszer két osztályt tartalmaz:
- pedionos
- véglapos
Fontosabb ásványai: kaolinit, rodonit, türkiz, cianit, timsócsoport, kalkantit.
Monoklin (egyhajlású) rendszer
[szerkesztés]
A rendszerben a tengelyarányok különbözőek, a hajlásszögük egymáshoz képest egy kivételével derékszögű, kevés szimmetriaelemet tartalmaz. A rendszer osztályai:
- szfenoidos
- dómás
- prizmás.
Fontosabb ásványai: gipsz, azurit, kén, lazulit, malachit, manganit, muszkovit, ortoklász, szóda, talk, timsócsoport, csillámok.
Rombos rendszer
[szerkesztés]

A három koordinátatengely egymásra merőleges, de különböző egységhosszúságú. Szimmetriaelemeinek száma több, mint három. A rendszer három osztályt tartalmaz:
- biszfenoidos
- piramisos
- bipiramisos.
Fontosabb ásványa: anhidrit, aragonit, antimonit, barit, enargit, kalkozin, kén, markazit, nagyágit, olivincsoport, topáz, csillámok.
Tetragonális (négyzetes) rendszer
[szerkesztés]
A három tengely egymásra merőleges, de csak kettő azonos egységhosszúságú, így a főtengely kitüntetett szerepű. Főtengelyes kristályrendszernek is nevezik. Több főtengelyi, melléktengelyi és síkszimmetriával (tükörszimmetria) is rendelkezik. A rendszerbe hét osztály tartozik:
- piramisos
- bipiramisos
- trapezoéderes
- ditetragonális piramisos
- ditetragonális bipiramisos
- biszfenoidos
- szkaleonéderes
Fontosabb ásványai: anatáz, bornit, cirkon, kalkopirit, kassziterit, rutil, torit, vezuvián.
Trigonális rendszer
[szerkesztés]
A főtengely a melléktengelyekkel derékszöget zárnak be, a melléktengelyek egymáshoz képest nem derékszögűek, a főtengely és a melléktengelyek egységhossza különböző. Sok tengely-, lap- és tükörszimmetriával rendelkezik. Hét kristályosztály tartozik ide:
- piramisos
- romboéderes
- trapezoéderes
- ditrigonális piramisos
- ditrigonális szkalenoéderes
- dipiramisos
- ditrigonális dipiramisos
Fontosabb ásványai: alunit, ankerit, cinnabarit, dolomit, kalcit, korund, kvarc, magnezit, rodokrozit, sziderit, tellúr, turmalincsoport.
Hexagonális (hatszöges) rendszer
[szerkesztés]
Hasonló a trigonális rendszerhez, de szimmetriájában döntően a hatszöges elemek az elsőrendűek. Ide tartozó kristályosztályok:
- piramisos
- dipiramisos
- trapezoéderes
- dihexagonális piramisos
- dihexagonális dipiramisos
Fontosabb ásványai: apatit, grafit, kalkozin, kvarc, molibdenit, nefelin, nikkelin, vanadinit.
Köbös (szabályos) kristályrendszer
[szerkesztés]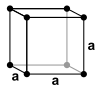


Tengelykeresztjeiből mindhárom egyenértékű, egymásra merőlegesek, egymással felcserélhetők. Ez arra utal, hogy a tulajdonságok jelentős része az iránytól független. Ez a kristályrendszer szabályosságáról könnyen felismerhető, de osztályai nehezen különböztethetőek meg. A rendszer osztályai:
- tetraéderes pentagon-dodekaéderes
- diszdodekaéderes
- pentagonikozi-tetraéderes
- hexakisztetraéderes
- hexakiszoktaéderes
Fontosabb ásványai: arany, argentit, arzenolit, ezüst, fluorit, galenit, gránátcsoport, gyémánt, kobaltin, kősó, krisztobalit, kuprit, lazurit, magnetit, pirit, platina, réz, szalmiák, szfalerit, timsócsoport, torianit.
Kapcsolódó szócikkek
[szerkesztés]Jegyzetek
[szerkesztés]- ↑ Solid State Physics, 2nd, Manchester Physics Series, John Wiley & Sons (2010. július 2.). ISBN 9780471928041
- ↑ a b c Jenny Pickworth Glusker, Kenneth N. Trueblood. Crystal Structure Analysis - A Primer, 3rd edition, United States: Oxford University Press (2010). ISBN 978-0-19-957635-7
- ↑ a b Walter Borchardt. Crystallography - An Introduction, 3rd edition, Springer (2012). ISBN 978-3-642-16452-1
- ↑ Balla Sándor, Bán Krisztián, Lovas Antal, Szabó Attila. Anyagismeret (2011). ISBN 978-963-279-586-7
- ↑ John Daintith. Dictionary of Chemistry, 6th edition, Oxford University Press (2008). ISBN 978-0-19-920463-2
- ↑ Náray-Szabó Gábor. Kémia. Akadémiai Kiadó (2006). ISBN 963 05 8240 6
Irodalom
[szerkesztés]- Boldizsár Tibor: Bányászati kézikönyv. Műszaki Könyvkiadó. Budapest. 1962.
- Bognár László: Ásványhatározó. Gondolat. Budapest. 1987.
- Bagyinszki Gyula. (2004): Gyártásismeret és technológia. Főiskolai tankönyv. 240 old. BGK-3010, Budapesti Műszaki Főiskola. Bánki Donát Gépészmérnöki Főiskolai Kar, Budapest
- Symes, R. F. (1994): Kőzetek és ásványok. Park Kiadó, Budapest
