RSV-vírus
| RSV-vírus | |
 | |
| BNO-9 | 079.6 |
| OMIM | 123400 |
| DiseasesDB | 11387 |
| MedlinePlus | 001564 |
A Wikimédia Commons tartalmaz RSV-vírus témájú médiaállományokat. | |
A légúti szinciciális vírus (RSV) (angolul: Respiratory syncytial virus), más néven humán légúti nagysejtes, vírus (hRSV) és humán ortopneumovírus olyan vírus, amely légúti fertőzéseket okoz. Ez egy negatív irányba forgató, egyszálú RNS-vírus.[1] A neve szincitium néven ismert nagy sejtekből származik, amelyek akkor keletkeznek, amikor a fertőzött sejtek egyesülnek.[1][2]
Az RSV a csecsemők légúti kórházi kezelése szükségességének gyakori oka, és az újrafertőződés a későbbi életkorban is gyakori marad, bár gyakran kevésbé súlyos következményekkel jár. Minden korcsoportban számottevő kórokozó. A fertőzések aránya jellemzően magasabb a téli hideg hónapokban, ami csecsemőknél bronchiolitist (hörgőgyulladás), felnőtteknél gyakori megfázásos megbetegedést, időseknél és immunhiányosoknál pedig súlyosabb légúti betegségeket, például tüdőgyulladást okozhat.[3]
Az RSV járványokat okozhat mind közösségben, mind kórházi környezetben. A szemen vagy orron keresztül történő kezdeti fertőzést követően a vírus megfertőzi a felső és alsó légutak hámsejtjeit, gyulladást, sejtkárosodást és légúti elzáródást okozva.[1] Számos módszer áll rendelkezésre az RSV-vírus kimutatására, beleértve az antigéntesztet, a molekuláris tesztelést és a víruskitenyésztést.[2]
A főbb megelőző intézkedések közé tartozik a gyakori kézmosás és a fertőzött személyekkel való szorosabb érintkezés elkerülése.[4] 2023 májusában az Egyesült Államok Élelmiszer- és Gyógyszerügyi Hivatala (FDA) jóváhagyta az első RSV-vakcinát, az Arexvyt (a GlaxoSmithKline fejlesztette ki) és az Abrysvót (Pfizer-termék).[5][6] A palivizumab vagy a nirsevimab profilaktikus alkalmazása (mindkettő monoklonális antitestkezelés) megelőzheti az RSV-fertőzést a magas kockázati hajlamú csecsemőknél.[4][7]
A súlyosabb megbetegedés kezelése elsősorban támogató jellegű, ideértve az oxigénterápiát és a légzéstámogatást folyamatos pozitív légúti nyomással (CPAP) vagy az orrban történő nagynyomású oxigénnel igényelhet, szükség esetén. Súlyos légzési elégtelenség esetén intubálásra és gépi lélegeztetésre is szükség lehet. A ribavirin egy vírusellenes gyógyszer, amelyet gyermekek RSV-kezelésére engedélyeztek.[8] Az RSV-fertőzés általában nem súlyos, de csecsemők, idősek és szív- vagy tüdőbetegségben szenvedők morbiditása és mortalitása jelentős lehet.
Története
[szerkesztés]Az RSV-t 1956-ban fedezték fel, amikor a kutatók a vírust izolálták légúti betegségben szenvedő csimpánzpopulációból. A vírust csimpánz coríza agensnek (CCA) nevezték el.[9] 1957-ben ugyanezt a vírust Robert M. Chanock azonosította légúti betegségben szenvedő gyermekeknél is.[10] Csecsemőknél és gyermekeknél humán antitestekkel végzett vizsgálatok kimutatták, hogy a fertőzés alacsonyabb életkorban gyakoribb volt.[11] A vírust később humán ortopneumovírusnak vagy humán légúti szinciciális vírusnak (hRSV) nevezték át.[12][13]
Számos más pneumovírus nagy hasonlóságot mutat a hRSV-vel. A szarvasmarha-RSV (bRSV) genomjának körülbelül 80%-a megegyezik a hRSV-vel. Ugyancsak növeli a hRSV-re való hajlamot a fiatalokban, és súlyosabb betegséget okozva a hat hónaposnál fiatalabb borjakban. Mivel a bRSV-vel fertőzött borjak tünetei szinte azonosak a hRSV-fertőzött gyerekekéivel, fontos állatmodellnek bizonyultak az RSV-kutatásban.[14]
Tünetei
[szerkesztés]Az RSV-fertőzés sokféle tünettel járhat, az enyhe felső légúti fertőzésektől (URTI) a súlyos és potenciálisan életveszélyes alsó légúti fertőzésekig (LRTI), amelyek kórházi kezelést és gépi lélegeztetést igényelhetnek.[14] Míg az RSV légúti fertőzéseket okozhat minden korosztályban, és a gyakori gyermekkori fertőzések közé tartozik, megjelenése gyakran korcsoportonként és immunállapotonként változik.[3] Az újrafertőződés egész életen át gyakori, de a csecsemők és az idősek továbbra is különösen ki vannak téve a tünetekkel járó fertőzés kockázatának.[14]
Gyermekek
[szerkesztés]Szinte minden gyermeknél az Egyesült Államokban tapasztalható legalább egy RSV-fertőzés két éves kora előtt.[15] A gyermekkori RSV-fertőzések általában önmaguktól meggyógyulnak olyan jellegzetes felső légúti tünetek mellett, mint például az orrdugulás, orrfolyás, köhögés és hőemelkedes.[3][15] A vizsgálat során az orrnyálkahártya (nátha) és a torok (pharyngitis) gyulladása, valamint a szem vörössége (kötőhártya-gyulladás) észlelhető.[2] A gyermekek körülbelül 15-50%-ánál súlyosabb alsó légúti fertőzések alakulnak ki, mint például a bronchiolitis, a vírusos tüdőgyulladás vagy a krupp.[14][16] A csecsemőknél a legnagyobb a betegség progressziójának kockázata.[2]
A bronchiolitis egy gyakori alsó légúti fertőzés, amelyet a tüdő kis légutainak gyulladása és elzáródása jellemez.[17] Míg számos vírus okozhat bronchiolitist, az esetek körülbelül 70%-áért az RSV a felelős.[3] Általában 2-4 napig tartó orrfolyással és náthával jár, amit súlyosbodó köhögés, zajos légzés, tachypnea (gyors légzés) és sípoló légzés követ.[15] Mivel a csecsemők nehezebben lélegeznek, légzési nehézségek jelei is megjelenhetnek rajtuk, például borda alatti behúzódások (amikor a has a bordaív alá húzódik), bordaközi behúzódások (amikor a bordák közötti izmok befelé húzódnak), morgás és orrtágulat.[14] Ha a gyermek nem tud megfelelően táplálkozni, a kiszáradás jelei is megjelenhetnek.[15] Láz is előfordulhat, de a magas láz nem gyakori.[14] Az auszkultáció során gyakran reccsenések és sípoló légzés hallható, és az oxigéntelítettség szintje csökkenhet.[17]
Hat hetesnél fiatalabb csecsemőknél, és különösen koraszülötteknél, a fertőzés jelei kevésbé specifikusak, minimális légúti érintettségük lehet. Ehelyett csökkent aktivitást, ingerlékenységet, rossz táplálkozást vagy légzési nehézségeket mutathatnak. Ezt apnoés rohamok vagy rövid légzési szünetek is kísérhetik.[3][18]
Felnőttek esetén
[szerkesztés]Az RSV-vel való újrafertőződés egész életen át gyakori marad. A felnőttkori újrafertőzés gyakran csak enyhe vagy közepes tüneteket okoz, amelyek megkülönböztethetetlenek a közönséges megfázástól vagy az orrmelléküreg-fertőzéstől.[3] A fertőzés tünetmentes is lehet. Ha jelen vannak, a tünetek általában a felső légutakra jellemzőek: orrfolyás, torokfájás, láz és rossz közérzet. Az esetek túlnyomó többségében az orrdugulás megelőzi a köhögés kialakulását.[2] Más felső légúti fertőzésekkel ellentétben, az RSV nagyobb valószínűséggel okoz ismétlődő zihálást felnőtteknél.[2] A fertőzött felnőttek körülbelül 25%-a súlyos alsó légúti fertőzéssé, például hörghurutba vagy tracheobronchitiszbe torkollik.
Míg az RSV nagyon ritkán okoz súlyos megbetegedéseket egészséges felnőtteknél, morbiditást és mortalitást okozhat az időseknél, valamint azoknál, akik immunhiányoak és/vagy szív- és tüdőbetegségben szenvednek. Az idősebb felnőtteknek hasonló tüneteik vannak, mint a fiatalabbaknak, de általában súlyosabbak, és fokozott az alsó légúti érintettség kockázata. Különösen az időseknél nagyobb valószínűséggel tapasztalnak tüdőgyulladást, légzési nehézséget és halált.[2]
Immunkompromittált
[szerkesztés]Mind a felnőttek, mind a gyermekek esetében az immunhiányos betegeknél fokozott az RSV-fertőzés kockázata. Az ebbe a csoportba tartozó fertőzött egyének nagyobb valószínűséggel haladnak a felső légúti érintettségtől az alsó légutak felé, és elhúzódó vírusürítésük van.[19] Úgy tűnik, hogy a tünetek súlyossága szorosan összefügg az immunszuppresszió mértékével. Különösen érzékenyek azok, akik hematopoetikus őssejt-transzplantáción (HSCT), intenzív kemoterápián és tüdőátültetésen estek át.[2][20] Úgy tűnik, hogy a csontvelő-transzplantáción átesett betegek vannak a legnagyobb kockázatnak kitéve, különösen a csontvelő-beültetés előtt lévők. Ebben a csoportban az RSV-fertőzésben közel 80%-os a tüdőgyulladás, ami a halálozás kockázatát hordozza magában.[2][21]
Komplikációk
[szerkesztés]| Népesség | Az RSV-fertőzés szövődményei |
|---|---|
| Gyermekek | A rövid távú kórházi kezelés alatt álló gyermekeknél fennáll a következő kockázatok kialakulása:[3]
Hosszú távon a gyermekeknél fennáll a következő krónikus betegségek kialakulásának kockázata, amelyek felnőttkorig is fennmaradhatnak: |
| Felnőttek | A következők gyakrabban fordulnak elő idős felnőtteknél, illetve azoknál, akiknél immunhiányos vagy kardiopulmonális állapotok állnak fenn: |
| Immunkompromittált | Egyes immunkompromittált csoportok nagyobb kockázatnak vannak kitéve bizonyos szövődmények kialakulásának, például: |
Kockázati tényezők
[szerkesztés]Az RSV-vel járó súlyos alsó légúti fertőzés kialakulásának kockázati tényezői populációnként változnak.
| Népesség | Az RSV által okozott alsó légúti fertőzés kialakulásának kockázati tényezői |
|---|---|
| Gyermekek[25] |
|
| Felnőttek és idősek[3] |
|
| Immunkompromittált[19][26] |
|
Virológia
[szerkesztés]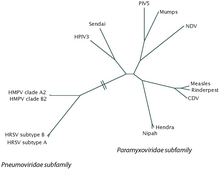
Taxonómia
[szerkesztés]Az RSV egy negatív irányba forgató, egyszálú RNS-vírus.[1] Ennek a vírusfajnak a tudományos neve humán ortopneumovírus. Ez egyet jelent a humán légúti szinciciális vírussal (hRSV), amelyet gyakran RSV-re rövidítenek.[27] Az Ortopneumovirus nemzetségbe, a Pneumoviridae családba, a Mononegavirales rendbe tartozik.[1] Neve onnan ered, hogy a vírus felszínén lévő F-fehérjék a szomszédos sejtmembránok összeolvadását okozzák, és nagy, többmagvú Szincitiumát hoznak létre.[2]
Antigén altípusok
[szerkesztés]Az RSV két antigén altípusra, A-ra és B-re oszlik, az F és G felszíni fehérjék monoklonális antitestekkel szembeni reaktivitása alapján.[1][2] Az altípusok általában egyidejűleg keringenek a helyi járványokon belül, bár az A altípus inkább elterjedt.[21] Általában úgy gondolják, hogy az RSV A altípus (RSVA) virulensebb, mint az RSV B (RSVB), nagyobb vírusterheléssel és kisebb átviteli idővel.[1][2] Eddig 16 RSVA és 22 RSVB-kládot azonosítottak.[1] Az RSVA között a GA1, GA2, GA5 és GA7 kládok dominálnak; A GA7 csak az Egyesült Államokban fordul elő.[1] Az RSVB között a BA-klád dominál világszerte.[1]
Genom
[szerkesztés]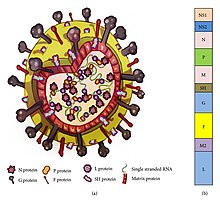
Az RSV-nek negatív forgatású RNS-genomja van.[1] A genom lineáris és körülbelül 15 000 nukleotid hosszúságú.[2] Nem szegmentált, ami azt jelenti, hogy az influenzával ellentétben az RSV nem tud részt venni a nagy világjárványokért felelős genetikai átrendeződésben és antigéneltolódásokban.[3] 10 génje van, amelyek 11 fehérjét kódolnak.[1][3] A génsorrend az NS1-NS2-NPM-SH-GF-M2-L, az NS1 és NS2 gén nem strukturális promoter génként szolgált.[28]

Felépítése és fehérjéi
[szerkesztés]
Az RSV egy közepes méretű (~150 nm) burkolt vírus. Bár sok részecske gömb alakú, fonalas fajokat is azonosítottak.[1][2] A genom egy helikális nukleokapszidban nyugszik, mátrixfehérje és vírus glikoproteineket tartalmazó burok veszi körül.[29] 11 fehérje létezik, amelyeket az alábbi táblázat ismertet.
| Helyszín a Virionban | Fehérje | Alternatív név | Funkció | további információ |
|---|---|---|---|---|
| Lipid burok (transzmembrán felszíni fehérjék) | G | Glikoprotein | A vírus kötődése a gazdaszervezet légútjának csillós sejtjeihez | Az F és G glikoproteinek a két fő felszíni fehérje, amelyek szabályozzák a vírus kötődését és a fertőzés kezdeti szakaszát. Az F- és G-fehérjék a természetes fertőzések során az antitestek semlegesítésének elsődleges célpontjai. |
| F | Fúziós fehérje | Vírus- és gazdasejt membránok fúziója; syncytium képződés | ||
| SH | Kisméretű hidrofób fehérje | Viroporin ; ion csatorna | Részt vesz a sejtfúzióban, de nem ismert semlegesítő epitóp | |
| Belső borítófelszín | M | Mátrix fehérje | Felepítés | |
| Ribonukleokapszid | N | Nuceloprotein | RNS-kötés | Részt vesz a genom transzkripciójában, az RNS-replikációban és a részecskék keletkezésében |
| P | Foszfoprotein | Foszforilezés | ||
| L | „Nagy” fehérje | RNS-függő RNS-polimeráz | ||
| M2-1 | - | Átírási folyamatképességi tényező | ||
| Szabályozó | M2-2 | - | A transzkripció / RNS-replikáció szabályozása | |
| Nem szerkezeti | NS-1 | - | Részt vesz a veleszületett immunrendszer kijátszásában | Az apoptózis gátlásával és az I-es típusú IFN jelátvitel gátlásával hat |
| NS-2 | - |
G-fehérje
[szerkesztés]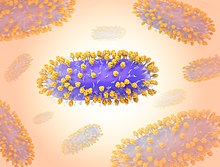
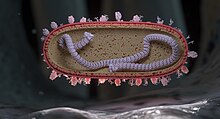
A felszíni protein G (glikoprotein) elsősorban a vírus gazdasejtekhez való kötődéséért felelős.[30] Ez a fehérje nagyon változatos a törzsek között.[21] A G-fehérje membránhoz kötött és szekretált formában egyaránt létezik.[2][30] A membránban található forma a gazdasejtek felszínén található glikozaminoglikánokhoz (GAG-okhoz), például heparán-szulfáthoz való kötődése révén felelős.[1][2][3] A szekretált forma csaliként működik, kölcsönhatásba lép az antigénprezentáló sejtekkel, hogy gátolja az antitestek által közvetített semlegesítést.[2][30] A G-fehérje egy CX3C fraktalkin-szerű motívumot is tartalmaz, amely a CX3C kemokin receptor 1-hez (CX3CR1) kötődik a csillós hörgő gazdasejtek felszínén.[1][3] Ez a kötődés megváltoztathatja a celluláris kemotaxist és csökkentheti az immunsejtek migrációját a fertőzött egyének tüdejébe.[30] A G-protein a gazdaszervezet immunválaszát is megváltoztatja azáltal, hogy gátolja a több toll-szerű receptor, köztük a TLR4 jelátvitelét.[3][30]
F-fehérje
[szerkesztés]A felszíni protein F (fúziós fehérje) felelős a vírus és a gazdasejt membránjainak fúziójáért, valamint a vírusrészecskék közötti szincicium képződéséért.[30] Szekvenciája erősen konzervált a törzsek között.[21] Míg úgy tűnik, hogy a vírus kötődése F- és G-fehérjéket is magába foglal, az F-fúzió G-től függetlenül megy végbe[30] Az F-fehérje többféle konformációs formában létezik.[1][3] A prefúziós állapotban (PreF) a fehérje trimer formában létezik, és tartalmazza a fő antigén Ø helyet,[1] amely elsődleges célpontja a szervezetben lévő antitestek semlegesítésének. Miután a gazdasejt felszínén lévő célpontjához kötődik (pontos liganduma nem tisztázott), a PreF konformációs változáson megy keresztül, amely során a Ø elvész.[1][3] Ez a változás lehetővé teszi, hogy a fehérje beépüljön a gazdasejt membránjába, és a vírus és a gazdasejt membránjainak fúziójához vezet.[1] A végső konformációs eltolódás a fehérje stabilabb és megnyúltabb formáját eredményezi (posztfúzió, PostF).[3] Az RSV G-fehérjével szemben az RSV F-fehérje a toll-like receptor 4-hez (TLR4) is kötődik, és aktiválja azt, elindítva a veleszületett immunválaszt és jelátvitelt.[1][30]
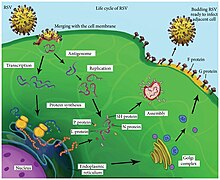
Replikációs ciklus
[szerkesztés]A vírus és a gazdasejt membránjainak fúzióját követően a vírus nukleokapszid (amely tartalmazza a vírus genomot) és a kapcsolódó vírus polimeráz a gazdasejt citoplazmájába kerül. A transzkripció és a transzláció egyaránt ott történik. Az RNS-függő RNS-polimeráz a genomot 10 hírvivő RNS (mRN) szegmensre írja át, amelyet a gazdasejt-mechanizmus strukturális fehérjékké alakít át. A negatív irányú vírusgenom replikációja során az RNS-függő RNS-polimeráz egy pozitív értelmű komplemenst szintetizál, amelyet antigenomnak neveznek. Ezt a komplementerszálat templátként használják a genomiális negatív forgatású RNS megalkotásához, amelyet nukleokapszidokba csomagolnak, és a plazmamembránra szállítanak az összeállítás és a részecskék kifejlődése céljából.[29]
Mechanizmusa
[szerkesztés]Terjedése
[szerkesztés]Az RSV rendkívül fertőző, és járványt okozhat mind közösségben, mind kórházban.[2] A becslések szerint minden egyes RSV-vel fertőzött személy esetében átlagosan 5-25 nem fertőzött ember fertőződik meg.[31] Az RSV akkor terjedhet, amikor egy fertőzött személy köhög vagy tüsszent, és szennyezett cseppeket bocsát ki a levegőbe. A cseppfertőzés általában akkor következik be, amikor ezek a cseppek egy másik személy szemébe, orrába vagy szájába kerülnek.[32] Az RSV akár 25 percig is élhet a szennyezett bőrön (pl. kezeken), és több órán keresztül más felületeken, például munkalapokon és ajtókilincseken.[2][31] Lappangási ideje 2-8 nap.[2] A fertőzés után az emberek általában 3-8 napig fertőzőek. Csecsemőknél és legyengült immunrendszerű embereknél azonban a vírus akár négy hétig is továbbterjedhet (még azután is, hogy már nem mutatnak tüneteket).[32]
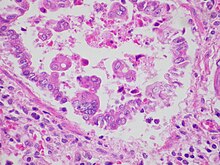
Patogenezis
[szerkesztés]Az orron vagy a szemen keresztül történő átvitelt követően az RSV megfertőzi a felső és alsó légutak csillós oszlopos hámsejtjeit.[2] Az RSV körülbelül 8 napig replikálódik ezekben a hörgősejtekben.[1] Az első néhány nap után az RSV-vel fertőzött sejtek gömbölyűbbé válnak, és végül az alsó légutak kisebb hörgőibe kerülnek.[1] Feltételezik, hogy ez a leválási mechanizmus felelős a vírusnak a felső légutakból az alsó légutakba történő terjedéséért is.[1] A fertőzés általános gyulladást okoz a tüdőben, beleértve a gyulladásos sejtek (például monociták és T-sejtek) migrációját és beszivárgását, a hámsejtfal nekrózisát, ödémát és fokozott nyálkahártya-termelést.[2] A gyulladás és a sejtkárosodás inkább foltos, mint diffúz.[2] A lecsöpögött hámsejtek, a nyálkahártyadugók és a felhalmozódott immunsejtek együttesen az alsó légutak elzáródását okozzák.[1][2]
Kórismézése
[szerkesztés]Laboratóriumi diagnózis
[szerkesztés]Az RSV-fertőzés diagnosztizálására számos laboratóriumi vizsgálat áll rendelkezésre. Míg az Amerikai Gyermekgyógyászati Akadémia (AAP) rutinszerűen nem javasolja laboratóriumi vizsgálatok alkalmazását az RSV-bronchiolitis diagnosztizálására (amelyre a kezelés is nagyrészt támogató),[4] az RSV-fertőzés megállapítása indokolt lehet a magas kockázatú csoportokban, ha az eredmény irányítja a klinikai döntéseket. Az általános azonosítási technikák közé tartozik az antigénteszt, a molekuláris tesztelés és a víruskitenyésztés.[2]
Antigénvizsgálat
[szerkesztés]Az antigénteszt az RSV-antigénfragmensek (vagy molekuláris vírusszerkezetek darabjainak) kimutatását foglalja magában, általában orrgarattamponból vagy aspirátumból. Ez megvalósítható a fluoreszcenssel jelölt antigének mikroszkóp alatti megtekintésével (direkt fluoreszcencia vizsgálat vagy DFA), vagy a kereskedelemben kapható gyors antigéndetektáló teszt (RADT) használatával.[2] Összességében az antigénteszt nagyon érzékeny kisgyermekeknél (80–90%), de lényegesen kevésbé megbízható idősebb gyermekeknél és felnőtteknél, akiknél kevésbé terjed a vírus.[2] Az antigéntesztek az RSV-csúcsszezonon kívül is magasabb hamis pozitív arányt mutatnak, például a nyári hónapokban. Ezekben a protokollokban a víruskultúra vagy a nukleinsavamplifikációs teszt (NAAT) alkalmazása segíthet a pontos diagnózisban.
- Az antigéngyorstesztet (RADT) általánosan a gondozási pontok vizsgálataként alkalmazzák könnyű használatuk és gyors átfutási idejük (akár 10 perc) miatt. Ezek közé tartoznak mind az enzim immunszorbens vizsgálatok (EIA), mind a kromatográfiás immunoassay (CIA).[2][33]
- A közvetlen fluoreszcencia vizsgálat (DFA) lehetővé teszi a vírussal fertőzött sejtek közvetlen mikroszkópos vizsgálatát. A DFA-teszt érzékenysége a megfelelő mintától függ.[33]
Molekuláris tesztelés
[szerkesztés]A molekuláris vizsgálatok, mint például a nukleinsav-amplifikációs tesztek (NAAT), lehetővé teszik nagyon kis mennyiségű vírus érzékeny kimutatását a nasopharyngealis tamponokban és aspirátumokban. A NAAT-tesztek, például a polimeráz láncreakció (PCR) a vírus-antigének helyett a vírusspecifikus genetikai anyagot mutatják ki. Érzékenységük és specificitásuk megközelíti a 100%-ot.[34] Azonban általában drágábbak és összetettebb berendezéseket igényelnek, mint más tesztelési módszerek, így kevésbé praktikusak a korlátozott erőforrásokkal rendelkező területeken. Az RSV molekuláris vizsgálata rutinszerűen nem javasolt minden légúti tünetekkel küzdő embernél. Azonban ajánlott lehet azoknak, akiknél magas az RSV szövődményeinek kockázata, például csecsemők, idősebb felnőttek és krónikus betegségekben szenvedőknél. Az RT-PCR érzékenysége 90-95%, specificitása 98-99%, míg a LAMP érzékenysége 95-100%, specificitása pedig 99-100%.
- A polimeráz-láncreakció (PCR) a NAAT olyan típusa, amely lehetővé teszi a genetikai anyag nagyon kis mintájának gyors amplifikálását milliós másolatokká tanulmányozás céljából. A PCR érzékenyebb, mint akár az antigénteszt, akár a vírustenyésztés.[34] Ezért használható a vírus kimutatására azoknál, akiknél alacsonyabb a vírusürítés, például idősebb gyermekeknél és felnőtteknél. Használható a betegség korábbi kimutatására is veszélyeztetett egyéneknél (például kórházi vagy immunhiányos betegeknél), amikor a vírusterhelés még túl alacsony ahhoz, hogy hagyományos technikákkal azonosítható legyen. Érzékenysége miatt a PCR gyakran tünetmentes hordozókat is képes kimutatni, és még napokkal a fertőzés klinikai megszűnése után is pozitív maradhat.[2][34]
- Több kórokozót tartalmazó panelek is rendelkezésre állnak, amelyek több vírusfertőzés (beleértve az RSV-t is) kimutatására képesek egyetlen személyben.[2]
Víruskultúrateszt
[szerkesztés]A hagyományos vírustenyészetben a vírus mintáját különböző sejtvonalakba juttatják, és hagyják replikálódni, hogy tanulmányozható legyen. Ennek a technikának az előnyei közé tartozik a genetikai jellemzés, a törzs tipizálás és a vírusellenes érzékenység vizsgálatának képessége. Ezt azonban korlátozza a meghosszabbított, 3–7 napos átfutási idő, így ritkábban fordul elő a betegellátásban, és gyakoribb a kutatási környezetben.[2]
Szerológiai vizsgálat
[szerkesztés]A szerológiát (a vírus-specifikus antitestek mérése a szérumban) nem gyakran használják az RSV-diagnosztikában. Az az idő, amelyre a szervezetnek jelentős szerológiai válaszreakció kifejtéséhez (és a szérumban kimutatható antitestek számának jelentős növekedéséhez) szükséges, általában nem hasznos a betegellátásban.[1] A dokumentált RSV-fertőzésben szenvedő betegek legfeljebb 30%-ának lesz negatív szerológiai eredménye.[34] Mint ilyen, ezt a módszert általában kutatási és felügyeleti vizsgálatokra tartják fenn.[1]
Képalkotó eljárások
[szerkesztés]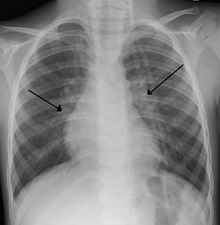
Az RSV-bronchiolitisben szenvedő gyermekek mellkasröntgenleletei általában nem specifikusak, és perihiláris jelöléseket, foltos hiperinflációt és atelektázist tartalmaznak.[15] Az Amerikai Gyermekgyógyászati Akadémia (AAP) azonban nem javasolja a rutin képalkotást a feltételezett RSV-bronchiolitisben szenvedő gyermekek számára, mivel az nem változtatja meg a klinikai eredményeket, és fokozott antibiotikum-használattal jár.[4][15] Néha a mellkasröntgen vizsgálatra kerül sor, ha a bronchiolitis diagnózisa nem egyértelmű, vagy ha váratlan rosszabbodás következik be.[4] Az RSV-fertőzésben szenvedő felnőtteknél a mellkasi felvételek gyakran normálisak, vagy a vírusos tüdőgyulladásnak megfelelő, nem specifikus elváltozásokat mutatnak, például foltos kétoldali beszűrődéseket.[35]
Differenciáldiagnózisa
[szerkesztés]A felső és alsó légúti fertőzés jeleit és tüneteit mutató egyének differenciáldiagnózisa magában foglalja az egyéb vírusfertőzéseket (például rhinovírus, metapneumovírus és influenza) és az elsődleges bakteriális tüdőgyulladást. Gyermekeknél általában figyelembe kell venni a belélegzett idegen testeket és a veleszületett állapotokat, például a cisztás fibrózist vagy az asztmát.[2]
Megelőzése
[szerkesztés]Általános megelőzési intézkedések
[szerkesztés]A fő megelőző intézkedés a fertőzött személyekkel való szoros érintkezés elkerülése.[4]
Védőoltások
[szerkesztés]Érdeklődés és kutatás mutatkozik az RSV-vakcinák felfedezése iránt, tekintettel a vírus betegségterhére és a betegségspecifikus terápiák hiányára. A vakcinák fejlesztése olyan akadályokba ütközött, amelyek meggátolták a fejlődést. Ezek közé tartoznak a csecsemőspecifikus tényezők, mint például az éretlen csecsemő immunrendszere és az anyai antitestek jelenléte, amelyek megnehezítik a csecsemőkori immunizálás.[2]
Az RSV-fertőzés kora gyermekkorban széles körben elterjedt, és jelentősen hozzájárul a globális betegségteherhez. A súlyos gyermekkori fertőzések és az azt követő légúti problémák közötti összefüggés nem teljesen ismert, különösen a bronchiolitis, a visszatérő csecsemőkori zihálás és a gyermekkori asztma közötti feltételezett kapcsolat. Más, vakcinával megelőzhető légúti kórokozókkal ellentétben az RSV kihívást jelent a vakcina kifejlesztése szempontjából. A folyamatos erőfeszítések a tartós védelmet biztosító vakcinák létrehozására irányulnak, a tereppróbákat pedig már alig várják. Jelenleg az RSV-betegség kezelésének alappillére a szupportív ellátás, mivel hatékony vakcinák és vírusellenes gyógyszerek várhatók. A vírusellenes szerek és védőoltások bevezetése fejlett diagnosztikai technikákkal párosulva ígéretes lehet az RSV globális hatásának csökkentésében az elkövetkező években. Ezek a beavatkozások megváltoztathatják a fertőzés dinamikáját, és gyengíthetik az RSV előfordulását a közösségekben világszerte.[2]
A kutatás alatt álló potenciális vakcinák öt nagy kategóriába sorolhatók: élő attenuált, fehérje alegység, vektor alapú, vírus részecske alegység és hírvivő RNS. Mindegyik más-más immunválaszt céloz meg, így alkalmasabb lehet a betegségek megelőzésére a különböző kockázati csoportokban. Az élő attenuált vakcinák bizonyos sikereket mutattak az RSV-vel nativ csecsemőknél. Más vakcinajelöltektől azt remélik, hogy életük során megcélozzák a veszélyeztetett populációkat, beleértve a terhes nőket és az időseket.[2][36]

Az elsődleges gyógyszerfejlesztők, a GlaxoSmithKline és a Pfizer megszerezték az Egyesült Államok Élelmiszer- és Gyógyszerügyi Hivatala (FDA) jóváhagyását a 60 évesnél idősebb felnőtteket célzó RSV-vakcinákhoz. A GSK Arexvy 94%-os hatékonyságot mutat a súlyos és 83%-ot a tünetekkel járó RSV ellen ebben a korcsoportban, míg a Pfizer Abrysvo 86%-os a súlyos tünetekkel szemben és 67%-os a tünetekkel járó betegségekkel szemben 60 éves és idősebb felnőtteknél.[39]
A Centers for Disease Control and Prevention (CDC) testülete az egészségügyi szolgáltatókkal egyeztetve RSV-oltást javasolt 60 év feletti felnőttek számára. A vakcinák várhatóan 2023-ban vagy 2024-ben lesznek elérhetők[39]
A nagyobb kihívást jelentő szempont, az újszülöttek vakcina iránti igényének kezelése érdekében a kutatók terhesség alatt beadható oltást alkalmaztak a csecsemők védelmére az első hat hónapban, amely az RSV-érzékenység kritikus időszaka.[39] Az FDA tanácsadó bizottsága jóváhagyta a Pfizer szülői RSV-oltóanyagát, elismerve annak 82%-os hatékonyságát a súlyos RSV ellen újszülötteknél három hónapos korig, és 69%-os hatékonyságát hat hónapig. Noha a bizottság egyhangúlag a hatékonyság mellett döntött, és 10:4 arányban szavazott a biztonság mellett, aggodalmát fejezve ki amiatt, hogy a beoltott csoportban valamivel magasabb a koraszülési arány. A GSK leállította saját vizsgálatát, mivel a vakcinacsoportban 38%-kal nagyobb volt a koraszülés valószínűsége.[39]

2023 májusában az Egyesült Államokban az FDA jóváhagyta az első RSV-vakcinákat, az Arexvyt (a GlaxoSmithKline fejlesztette ki) és az Abrysvót (a Pfizertől).[5][6] 2023-ban több RSV-vakcinavizsgálatot végeztek[39]
Immunprofilaxis
[szerkesztés]Passzív immunizálás áll rendelkezésre az RSV-fertőzés megelőzésére és a legmagasabb kockázatú csecsemők kórházi kezelésére. A múltban az RSV-specifikus intravénás immunglobint (IVIG) használták a passzív immunitás biztosítására. Ez magában foglalta a betegségből felépülő humán donoroktól származó RSV-semlegesítő antitestek (vagy immunglobinok) havi beadását. Míg ez az antitesttranszfer meglehetősen hatékony volt a veszélyeztetett csecsemők rövid távú immunizálásában, intravénás beadása és a költsége egyaránt korlátozta.[40]
Az RSV-IVIG-t azóta egy monoklonális antitest (MAb) váltotta fel, amely izomba injekcióval juttatható be. A palivizumab (Synagis) egy monoklonális antitest, amely az RSV-vírus felszíni fúziós (F) fehérje ellen irányul. 1998-ban engedélyezték, és hatékonyan biztosítja mind az RSV A, mind az RSV B elleni ideiglenes profilaxist. Havi injekció formájában adják be, amelyet közvetlenül az RSV-szezon előtt kezdenek, és általában öt hónapig folytatják. Kimutatták, hogy a palivizumab csökkenti a kórházi kezelések arányát és az összes okból bekövetkező halálozást a magas kockázatú gyermekek bizonyos csoportjaiban (például krónikus tüdőbetegségben, veleszületett szívbetegségben szenvedőknél és koraszülötteknél).[31][41] Költsége azonban korlátozza a használatát a világ számos részén. Azóta ennek az antitestnek a hatásosabb származékait fejlesztették ki (beleértve a motavizumabot is), de ezek jelentős mellékhatásokkal jártak.[42]
Az Amerikai Gyermekgyógyászati Akadémia (AAP 2014) az RSV-profilaxist javasolja palivizumabbal az RSV-szezonban:[4]
- ≤28 hetes 6 napos terhességi korban és 12 hónapnál fiatalabb csecsemők az RSV-szezon kezdetén
- 12 hónaposnál fiatalabb csecsemők krónikus koraszülöttkori tüdőbetegségében
- ≤12 hónapos csecsemők hemodinamikailag jelentős veleszületett szívbetegségben
- 24 hónaposnál fiatalabb csecsemők és koraszülöttek krónikus tüdőbetegségében, amely orvosi kezelést igényel
Az AAP irányelvei szerint a palivizumab profilaxis megfontolható a következő csecsemőknél is:[4]
- Veleszületett légúti rendellenesség
- Neuromuszkuláris rendellenesség
- Cisztás fibrózis
- Súlyos immunhiány
- Friss vagy közelgő szívátültetés
A nirsevimab (Beyfortus) egy másik antivirális monoklonális antitest, amelyet az RSV alsó légúti betegségeinek megelőzésére engedélyeztek újszülötteknél és csecsemőknél az első RSV-szezonban.[43] A nirsevimabnak csak egy adagra van szüksége, amely a teljes RSV-szezonra kitart, ellentétben a palivizumabbal, amelyet havonta egyszer kell beadni, legfeljebb négyszer, hogy hatásos maradjon.[7] A nirsevimabot 2022 novemberében engedélyezték orvosi használatra az Európai Unióban[44][45] és az Egyesült Királyságban[46], Kanadában pedig 2023 áprilisában[7]
Kezelése
[szerkesztés]Támogató ápolás
[szerkesztés]Az RSV-fertőzöttek kezelése elsősorban a szupportív (támogató) ellátásra koncentrál. Ez magába foglalhatja a páciens légzésének megfigyelését vagy leszívással a váladék eltávolítását a felső légutakból. Kiegészítő oxigén adagolását orrkanülön vagy arcmaszkon keresztül is, a légáramlás javítása érdekében. Súlyos légzési elégtelenség esetén intubálásra és gépi lélegeztetésre lehet szükség a légzés támogatására. Ha kiszáradás jelei mutatkoznának, a folyadék szájon át vagy intravénásan is adható.[40]
További szupportív kezeléseket vizsgáltak RSV-bronchiolitisszel kórházba került csecsemőknél. Ezek a következők:
- Kimutatták, hogy a porlasztott fiziológiás oldat csökkenti a kórházi kezelés időtartamát és csökkenti a klinikai súlyosságot vírusos bronchiolitisben szenvedő csecsemőknél. Egy lehetséges mechanizmus a csökkent légúti ödéma (vizenyő) és a nyálkahártya eltömődése a légúti elzáródás csökkentése érdekében.[47][48]
- A Heliox, az oxigén és a hélium keveréke, csökkentheti a légzési nehézséget a kezelés első órájában. Úgy működik, hogy csökkenti a légúti ellenállást és megkönnyíti a légzést. Azonban nem bizonyított, hogy befolyásolná a betegség általános kimenetelét.[49]
- A csecsemőknél alkalmazott mellkasi fizioterápia, beleértve a kényszerlélegeztetési technikákat, nem csökkenti a betegség súlyosságát vagy egyéb javulást nem okoz.[50] Az egyéb fizioterápiás megközelítéseket, köztük az instrumentális fizioterápiát és a rhinopharyngealis retrográd technikát (RRT) alátámasztó bizonyítékok nagyon korlátozottak. A hatások és az esetleges felhasználás további értékelést igényel a klinikai vizsgálatok során.[50] Nincs bizonyíték arra sem, hogy a mellkasi fizioterápiával kombinált fiziológiás sóterápia beválna.[50] Nagyon gyenge bizonyítékok vannak arra vonatkozóan, hogy a passzív, lassú kilégzési technikával végzett fizioterápia hozzájárulhat a bronchiolitis súlyosságának „enyhe vagy közepes” pozitív változásához a kórházban ápolt csecsemők esetében, azonban ennek a megközelítésnek az előnyei az ambuláns körülmények között kezelt csecsemők számára nem ismertek.[50]
- Az inhalált rekombináns humán dezoxiribonukleáz (rhDNáz) egy olyan enzim, amely megemészti a DNS-t, amely hozzájárult a nyálkahártya eltömődéséhez és a légúti elzáródáshoz, nem mutatott javító hatást ebben a csoportban.[51]
Vírusspecifikus terápiák
[szerkesztés]- A ribavirin egy vírusellenes gyógyszer, amelyet gyermekeknél az RSV kezelésére engedélyeztek.[8] Ez egy guanozin analóg, amely gátolja a vírus RNS-szintézisét és a cappingot. 1986-ban engedélyezték az RSV-fertőzés kezelésére. A ribavirin esetében azonban továbbra is ellentmondásos a hatékonyságára vonatkozó bizonyítékok, valamint a fertőzésnek kitett személyzet tagjait érintő toxicitás, valamint a költségek miatt.[8][52] Mint ilyen, a kezelési irányelvek nem adnak javaslatot gyermekeknél történő alkalmazására. Felnőtteknél a ribavirint az off-label gyógyszeralkalmazáson kívül alkalmazzák, és általában a súlyosan immunhiányos betegeknek, például a vérképző őssejt-transzplantáción átesetteknek tartják fenn.[2]
- A Presatovir, egy kísérleti vírusellenes gyógyszer ígéretes eredményeket mutatott a klinikai vizsgálatok során, de még nem hagyták jóvá orvosi felhasználásra. Fúziógátlóként hat az RSV F-fehérje gátlásával.[53]
- RSV-specifikus és nem specifikus immunglobulinokat is régen alkalmaztak RSV-vel kapcsolatos betegségekre. Azonban nem áll rendelkezésre elegendő bizonyíték az immunglobulinok alkalmazásának alátámasztására RSV-fertőzött gyermekeknél.[54]
Gyulladáscsökkentők
[szerkesztés]- A kortikoszteroidok (szisztémás vagy inhalációs) nem csökkentik a kórházi kezelés időtartamát vagy a betegség súlyosságát vírusos bronchiolitis esetén.[55] Használatuk meghosszabbíthatja a vírus terjedését is, ezért általában nem ajánlott. Kortikoszteroidok orális alkalmazása azonban továbbra is gyakori az RSV-vel összefüggő tüdőbetegség súlyosbodásában szenvedő felnőtteknél.[2]
- A leukotrién inhibitorokat, például a montelukasztot bronchiolitisben szenvedő csecsemők és gyermekek kezelésére alkalmazták. A használatukat alátámasztó bizonyítékok azonban továbbra sem következetesek, és nincs végleges következtetés a hatásosságukra vonatkozóan.[56]
Hörgőtágítók
[szerkesztés]A hörgőtágítókat, az asztma kezelésére általánosan használt gyógyszereket néha az RSV-fertőzéssel összefüggő zihálás kezelésére használják. Ezek a gyógyszerek (például az albuterol vagy a szalbutamol) béta-agonisták, amelyek ellazítják a légutak izmait, hogy javítsák a légáramlást. A hörgőtágítók azonban nem javítják a fertőzés klinikai súlyosságát vagy a kórházi kezelésre szorulók arányát az RSV-fertőzöttek körében. Tekintettel korlátozott előnyükre, valamint nemkívánatos eseményprofiljukra, rutinszerűen nem javasolták őket RSV-bronchiolitisben.[40][55]
Antibiotikumok
[szerkesztés]Az antibiotikumterápia nem megfelelő az RSV-vel összefüggő bronchiolitis vagy vírusos tüdőgyulladás kezelésére.[57] Az antibiotikumok a bakteriális kórokozókat célozzák meg, nem a vírusos kórokozókat, például az RSV-t. Az antibiotikumok alkalmazása azonban megfontolható, ha egyértelmű bizonyíték van arra, hogy másodlagos bakteriális fertőzés alakult ki. Fülgyulladások is bekövetkezhetnek kis számú RSV-bronchiolitiszben szenvedő csecsemőnél, amely esetben néha orális antibiotikumok is alkalmazhatók.[40]
A vakcinákon túl az AstraZeneca és a Sanofi bemutatta a nirsevimabot, egy profilaktikus monoklonális antitestet, amely 75%-os hatékonysággal rendelkezik az RSV-esetek ellen egy év alatti csecsemőknél. Európa 2022 novemberében hagyta jóvá a nirsevimabot, az FDA pedig 2023 júliusában követte példáját. A Merck-féle clesrovimab, egy hasonló monoklonális antitest, késői fejlesztési stádiumban van.[39]
Járványtana
[szerkesztés]Csecsemők és gyermekek
[szerkesztés]Világszerte az RSV a csecsemők és öt év alatti gyermekek bronchiolitisének és tüdőgyulladásának fő kórokozója. A súlyos fertőzés kockázata az élet első hat hónapjában a legmagasabb. Az RSV-vel fertőzöttek 2-3%-ánál bronchiolitis alakul ki, ami kórházi kezelést tesz szükségessé.[58] Évente körülbelül 30 millió akut légúti megbetegedést és több mint 60 000 gyermekkori halálesetet okoz az RSV világszerte. Becslések szerint a csecsemők 87%-a átesett RSV-fertőzésen 18 hónapos korukra, és majdnem minden gyermek haroméves korára. Az Egyesült Államokban az RSV az öt év alatti gyermekek akut légúti fertőzéses kórházi kezeléseinek akár 20%-áért felelős. Az RSV-vel összefüggő halálesetek túlnyomó többsége azonban olyan alacsony jövedelmű országokban következik be, ahol nem hozzáférhető az alapvető támogató ellátás.[2]
Felnőttek
[szerkesztés]Ritka az egészséges fiatal felnőtteknél az RSV miatti kórházi kezelést igénylő súlyos betegség. Mára azonban bizonyos felnőtt populációk – köztük az idősek és a szív- vagy tüdőbetegségben szenvedők – jelentős morbiditási és mortalitási okaként szerepel. Klinikai hatása időseknél a becslések szerint hasonló az influenzáéhoz.[21] Évente az idősotthonban élők körülbelül 5–10%-ánál lép fel RSV-fertőzés, jelentős tüdőgyulladás és halálozási arány mellett. Az RSV a felnőttkorú közösségben okohott tüdőgyulladások 2–5%-áért is felelős.[21]
Immunkompromittált kezelés
[szerkesztés]Felnőtteknél és gyermekeknél egyaránt az immunszuppresszió növeli az RSV-fertőzésre való hajlamot. A HIV-fertőzött gyermekeknél nagyobb valószínűséggel alakul ki akut betegség, és 3,5-szer nagyobb eséllyel szorulnak kórházi kezelésre, mint a csupán HIV-fertőzött gyermekek.[2] A csontvelő-átültetésen átesett betegek a-beültetés előtt különösen nagy kockázatnak vannak kitéve, mivel ebben a populációban a vírusfertőzések közel felét az RSV teszi ki. Erre a csoportra 80%-os halálozási arányt is kimutattak az RSV-tüdőgyulladásban szenvedők körében.[21] Míg a fertőzés előfordulhat a közösségen belül, a kórházban szerzett fertőzések az esetek 30-50%-át teszik ki az immunhiányos egyének körében.[21]
Szezonalitása
[szerkesztés]Az RSV szezonalitása az egész világon változó. Mérsékelt éghajlaton a fertőzések aránya általában a hideg téli hónapokban a legmagasabb. Ez gyakran a megnövekedett beltéri zsúfoltságnak és a megnövekedett vírusstabilitásnak tulajdonítható alacsonyabb hőmérsékleten. A trópusi és sarkvidéki éghajlaton azonban az éves ingadozás kevésbé pontosan mutatható ki, és úgy tűnik, hogy az esős évszakban jellemzőbb.[1][2] Az éves járványokat általában több különböző vírustörzs jelenléte okozza. Az A és B altípusú vírusok gyakran egyidejűleg keringenek egy adott földrajzi régión belül, bár az A csoportba tartozó vírusok a gyakoribbak.[21]
A COVID-19 kapcsán
[szerkesztés]A Covid19-ért felelős vírus, a SARS-CoV-2-fertőzések az RSV-fertőzés kockázatának növekedéséhez vezethetnek.[59] 2022 novemberében az RSV az újszülöttek kórházi kezelésében hétszerese volt a 2018-as rátának. Ez, az influenza terjedésének növekedésével párosulva, szükségállapot kihirdetéséhez vezetett az Egyesült Államok Oregon államában. A Gyermekkórházak Szövetsége és az Amerikai Gyermekgyógyászati Akadémia arra kérte Joe Biden amerikai elnököt, hogy hirdessen ki rendkívüli állapotot.[60]
Jegyzetek
[szerkesztés]- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab (2017. január 1.) „Respiratory Syncytial Virus: Infection, Detection, and New Options for Prevention and Treatment”. Clinical Microbiology Reviews 30 (1), 277–319. o. DOI:10.1128/CMR.00010-16. PMID 27903593. Forráshivatkozás-hiba: Érvénytelen
<ref>címke, „Griffiths_2017” nevű forráshivatkozás többször van definiálva eltérő tartalommal - ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an ao ap aq ar as at Chapter 5: Respiratory Syncytial Virus, SARS, MERS and other Viral Lung Infections, Wellcome Trust–Funded Monographs and Book Chapters. Sheffield (UK): European Respiratory Society (2016. június 1.). ISBN 978-1-84984-070-5. Hozzáférés ideje: 2020. október 29. Forráshivatkozás-hiba: Érvénytelen
<ref>címke, „Jha_2016” nevű forráshivatkozás többször van definiálva eltérő tartalommal - ↑ a b c d e f g h i j k l m n o p q (2019. október 1.) „Respiratory syncytial virus (RSV): a scourge from infancy to old age”. Thorax 74 (10), 986–993. o. DOI:10.1136/thoraxjnl-2018-212212. PMID 31383776. (Hozzáférés: Hiba: Érvénytelen idő.) Forráshivatkozás-hiba: Érvénytelen
<ref>címke, „Coultas_2019” nevű forráshivatkozás többször van definiálva eltérő tartalommal - ↑ a b c d e f g h (2014. november 1.) „Clinical practice guideline: the diagnosis, management, and prevention of bronchiolitis”. Pediatrics 134 (5), e14741–502. o. DOI:10.1542/peds.2014-2742. PMID 25349312. (Hozzáférés: Hiba: Érvénytelen idő.) Forráshivatkozás-hiba: Érvénytelen
<ref>címke, „Ralston_2014” nevű forráshivatkozás többször van definiálva eltérő tartalommal - ↑ a b Error on call to Template:cite press release: Parameter title must be specified
- ↑ a b „US FDA approves Pfizer's RSV vaccine”, Reuters, 2023. május 31. (Hozzáférés: 2023. június 1.)
- ↑ a b c Health Canada approves new antibody drug to help prevent serious RSV in babies. CTVNews, 2023. április 22. [2023. április 24-i dátummal az eredetiből archiválva]. (Hozzáférés: 2023. április 24.) Forráshivatkozás-hiba: Érvénytelen
<ref>címke, „ctv-202304” nevű forráshivatkozás többször van definiálva eltérő tartalommal - ↑ a b c (2015. március 1.) „Challenges and opportunities in developing respiratory syncytial virus therapeutics”. The Journal of Infectious Diseases 211 (suppl 1), S1–S20. o. DOI:10.1093/infdis/jiu828. PMID 25713060.
- ↑ (1956. július 1.) „Recovery of cytopathogenic agent from chimpanzees with coryza” (PDF). Proceedings of the Society for Experimental Biology and Medicine 92 (3), 544–549. o. [2023. február 2-i dátummal az eredetiből archiválva]. DOI:10.3181/00379727-92-22538. PMID 13359460. (Hozzáférés: 2023. február 2.)
- ↑ (1957. november 1.) „Recovery from infants with respiratory illness of a virus related to chimpanzee coryza agent (CCA). I. Isolation, properties and characterization”. American Journal of Hygiene 66 (3), 281–290. o. DOI:10.1093/oxfordjournals.aje.a119901. PMID 13478578.
- ↑ (1957. november 1.) „Recovery from infants with respiratory illness of a virus related to chimpanzee coryza agent (CCA). II. Epidemiologic aspects of infection in infants and young children”. American Journal of Hygiene 66 (3), 291–300. o. DOI:10.1093/oxfordjournals.aje.a119902. PMID 13478579.
- ↑ Chapter 160 Respiratory Syncytial Virus (RSV), Mandell, Douglas, and Bennett's Principles and Practice of Infectious Diseases, Eighth, Philadelphia: Elsevier, 1948–1960.e3. o.. DOI: 10.1016/B978-1-4557-4801-3.00160-0 (2015. január 1.). ISBN 978-1-4557-4801-3
- ↑ (2016. augusztus 1.) „Taxonomy of the order Mononegavirales: update 2016”. Archives of Virology 161 (8), 2351–2360. o. DOI:10.1007/s00705-016-2880-1. PMID 27216929.
- ↑ a b c d e f (2013. december 1.) „Respiratory syncytial virus--a comprehensive review”. Clinical Reviews in Allergy & Immunology 45 (3), 331–379. o. DOI:10.1007/s12016-013-8368-9. PMID 23575961. Forráshivatkozás-hiba: Érvénytelen
<ref>címke, „Borchers_2013” nevű forráshivatkozás többször van definiálva eltérő tartalommal - ↑ a b c d e f (2017. január 1.) „Respiratory Syncytial Virus Bronchiolitis in Children”. American Family Physician 95 (2), 94–99. o. [2021. április 16-i dátummal az eredetiből archiválva]. PMID 28084708. (Hozzáférés: 2020. november 3.) Forráshivatkozás-hiba: Érvénytelen
<ref>címke, „Smith_2017” nevű forráshivatkozás többször van definiálva eltérő tartalommal - ↑ Red book: 2018–2021 report of the Committee on Infectious Diseases [archivált változat], Thirty-first. ISBN 978-1-61002-147-0. OCLC 1035556489. Hozzáférés ideje: 2020. november 3. [archiválás ideje: 2022. április 30.]
- ↑ a b (2014. november 1.) „Bronchiolitis: Recommendations for diagnosis, monitoring and management of children one to 24 months of age”. Paediatrics & Child Health 19 (9), 485–498. o. DOI:10.1093/pch/19.9.485. PMID 25414585.
- ↑ RSV Symptoms and Care. U.S. Centers for Disease Control and Prevention (CDC), 2019. február 4. [2021. szeptember 3-i dátummal az eredetiből archiválva]. (Hozzáférés: 2020. október 28.)
- ↑ a b (2018. december 1.) „Respiratory Viral Infections in Patients With Cancer or Undergoing Hematopoietic Cell Transplant”. Frontiers in Microbiology 9, 3097. o. DOI:10.3389/fmicb.2018.03097. PMID 30619176. (Hozzáférés: Hiba: Érvénytelen idő.)
- ↑ (2017. március 1.) „Respiratory Syncytial Virus Infection: An Illness for All Ages”. Clinics in Chest Medicine 38 (1), 29–36. o. DOI:10.1016/j.ccm.2016.11.010. PMID 28159159.
- ↑ a b c d e f g h i (2000. július 1.) „Respiratory syncytial virus infection in adults”. Clinical Microbiology Reviews 13 (3), 371–384. o. DOI:10.1128/cmr.13.3.371-384.2000. PMID 10885982. Forráshivatkozás-hiba: Érvénytelen
<ref>címke, „Falsey_2000” nevű forráshivatkozás többször van definiálva eltérő tartalommal - ↑ (2017. október 18.) „Role of viral infections in the development and exacerbation of asthma in children”. The Journal of Allergy and Clinical Immunology 140 (4), 895–906. o. DOI:10.1016/j.jaci.2017.08.003. PMID 28987219.
- ↑ (2016. július 24.) „Risk and Protective Factors for Childhood Asthma: What Is the Evidence?”. The Journal of Allergy and Clinical Immunology. In Practice 4 (6), 1111–1122. o. DOI:10.1016/j.jaip.2016.05.003. PMID 27286779.
- ↑ (2021. december 1.) „Respiratory Syncytial Virus–Associated Neurologic Complications in Children: A Systematic Review and Aggregated Case Series”. The Journal of Pediatrics 239, 39–49.e9. o. DOI:10.1016/j.jpeds.2021.06.045. PMID 34181989.
- ↑ (2015. december 1.) „Risk factors for respiratory syncytial virus associated with acute lower respiratory infection in children under five years: Systematic review and meta-analysis”. Journal of Global Health 5 (2), 020416. o. DOI:10.7189/jogh.05.020416. PMID 26682048.
- ↑ (2019. július 1.) „Respiratory syncytial virus in hematopoietic cell transplant recipients and patients with hematologic malignancies”. Haematologica 104 (7), 1322–1331. o. DOI:10.3324/haematol.2018.215152. PMID 31221784.
- ↑ Respiratory syncytial virus | Johns Hopkins ABX Guide. www.hopkinsguides.com. [2020. november 1-i dátummal az eredetiből archiválva]. (Hozzáférés: 2020. október 29.)
- ↑ Genus: Orthopneumovirus – Pneumoviridae – Negative-sense RNA Viruses. International Committee on Taxonomy of Viruses (ICTV). [2021. június 3-i dátummal az eredetiből archiválva]. (Hozzáférés: 2020. október 29.)
- ↑ a b (2006. július 1.) „Unravelling the complexities of respiratory syncytial virus RNA synthesis”. The Journal of General Virology 87 (Pt 7), 1805–1821. o. DOI:10.1099/vir.0.81786-0. PMID 16760383.
- ↑ a b c d e f g h i Respiratory Syncytial Virus: Virology, Reverse Genetics, and Pathogenesis of Disease, Challenges and Opportunities for Respiratory Syncytial Virus Vaccines, Current Topics in Microbiology and Immunology, 3–38. o.. DOI: 10.1007/978-3-642-38919-1_1 (2013. július 24.). ISBN 978-3-642-38918-4
- ↑ a b c (2016. április 1.) „Best practice in the prevention and management of paediatric respiratory syncytial virus infection”. Therapeutic Advances in Infectious Disease 3 (2), 63–71. o. DOI:10.1177/2049936116630243. PMID 27034777.
- ↑ a b RSV Transmission. U.S. Centers for Disease Control and Prevention (CDC), 2019. február 4. [2020. október 29-i dátummal az eredetiből archiválva]. (Hozzáférés: 2020. november 9.)
- ↑ a b (2020. április 1.) „Recent advances in the detection of respiratory virus infection in humans”. Journal of Medical Virology 92 (4), 408–417. o. DOI:10.1002/jmv.25674. PMID 31944312.
- ↑ a b c d (2007. november 1.) „Diagnostic assays for respiratory syncytial virus disease” (amerikai angol nyelven). The Pediatric Infectious Disease Journal 26 (11 Suppl), S36–40. o. DOI:10.1097/INF.0b013e318157da6f. PMID 18090198. (Hozzáférés: Hiba: Érvénytelen idő.)
- ↑ (2000. március 1.) „Viral pneumonias. Epidemic respiratory viruses”. Postgraduate Medicine 107 (3), 41–42, 45–47, 51–52. o. DOI:10.3810/pgm.2000.03.941. PMID 10728134.
- ↑ (2019. április 1.) „Respiratory syncytial virus entry and how to block it”. Nature Reviews. Microbiology 17 (4), 233–245. o. DOI:10.1038/s41579-019-0149-x. PMID 30723301.
- ↑ a b Karron (2021. május 14.). „Preventing respiratory syncytial virus (RSV) disease in children” (angol nyelven). Science 372 (6543), 686–687. o. DOI:10.1126/science.abf9571. ISSN 0036-8075. PMID 33986169.
- ↑ Rossey (2018. március 1.). „Clinical Potential of Prefusion RSV F-specific Antibodies”. Trends in Microbiology 26 (3), 209–219. o. DOI:10.1016/j.tim.2017.09.009. ISSN 1878-4380. PMID 29054341.
- ↑ a b c d e f RSV Vaccines Are Nearly Here after Decades of False Starts - Decades of failed attempts have given way to several successful vaccines and treatments for the respiratory disease RSV. Scientific American. [2023. április 12-i dátummal az eredetiből archiválva]. (Hozzáférés: 2023. április 13.) Forráshivatkozás-hiba: Érvénytelen
<ref>címke, „sa-202303” nevű forráshivatkozás többször van definiálva eltérő tartalommal - ↑ a b c d Viral infections of humans: Epidemiology and control [archivált változat], Fifth, New York: Springer, 601–610. o. (2014). ISBN 978-1-4899-7448-8. OCLC 891646285. Hozzáférés ideje: 2020. november 12. [archiválás ideje: 2022. április 30.] Forráshivatkozás-hiba: Érvénytelen
<ref>címke, „Kaslow_2014” nevű forráshivatkozás többször van definiálva eltérő tartalommal - ↑ (2013. április 1.) „Monoclonal antibody for reducing the risk of respiratory syncytial virus infection in children”. The Cochrane Database of Systematic Reviews (4), CD006602. o. DOI:10.1002/14651858.CD006602.pub4. PMID 23633336. (Hozzáférés: Hiba: Érvénytelen idő.)
- ↑ (2019. május 2.) „The long road to protect infants against severe RSV lower respiratory tract illness”. F1000Research 8, 610. o. DOI:10.12688/f1000research.18749.1. PMID 31105933. (Hozzáférés: Hiba: Érvénytelen idő.)
- ↑ New medicine to protect babies and infants from respiratory syncytial virus (RSV) infection. European Medicines Agency, 2022. szeptember 16. [2022. szeptember 19-i dátummal az eredetiből archiválva]. (Hozzáférés: 2023. április 24.)
- ↑ Beyfortus. Union Register of medicinal products, 2022. november 3. [2022. november 6-i dátummal az eredetiből archiválva]. (Hozzáférés: 2022. november 6.)
- ↑ "Beyfortus approved in the EU for the prevention of RSV lower respiratory tract disease in infants". Sajtóközlemény.
- ↑ Medicines and Healthcare products Regulatory Agency (MHRA). "MHRA Grants Approval of Beyfortus (nirsevimab) for Prevention of RSV Disease in Infants". Sajtóközlemény.
- ↑ (2019. augusztus 1.) „Efficacy of 3% hypertonic saline in bronchiolitis: A meta-analysis”. Experimental and Therapeutic Medicine 18 (2), 1338–1344. o. DOI:10.3892/etm.2019.7684. PMID 31384334.
- ↑ (2013. július 31.) „Nebulised hypertonic saline solution for acute bronchiolitis in infants”. The Cochrane Database of Systematic Reviews (7), CD006458. o. DOI:10.1002/14651858.CD006458.pub3. PMID 23900970. (Hozzáférés: Hiba: Érvénytelen idő.)
- ↑ (2015. szeptember 1.) „Heliox inhalation therapy for bronchiolitis in infants”. The Cochrane Database of Systematic Reviews 2015 (9), CD006915. o. DOI:10.1002/14651858.CD006915.pub3. PMID 26384333.
- ↑ a b c d (2023. április 1.) „Chest physiotherapy for acute bronchiolitis in paediatric patients between 0 and 24 months old”. The Cochrane Database of Systematic Reviews 2023 (4), CD004873. o. DOI:10.1002/14651858.CD004873.pub6. PMID 37010196. (Hozzáférés: Hiba: Érvénytelen idő.)
- ↑ (2012. november 1.) „Nebulised deoxyribonuclease for viral bronchiolitis in children younger than 24 months”. The Cochrane Database of Systematic Reviews 11 (11), CD008395. o. DOI:10.1002/14651858.CD008395.pub2. PMID 23152257.
- ↑ (2007. január 1.) „Ribavirin for respiratory syncytial virus infection of the lower respiratory tract in infants and young children”. The Cochrane Database of Systematic Reviews (1), CD000181. o. DOI:10.1002/14651858.CD000181.pub3. PMID 17253446. (Hozzáférés: Hiba: Érvénytelen idő.)
- ↑ (2019. július 1.) „Advances in respiratory virus therapeutics – A meeting report from the 6th isirv Antiviral Group conference”. Antiviral Research 167, 45–67. o. DOI:10.1016/j.antiviral.2019.04.006. PMID 30974127.
- ↑ (2023. október 1.) „Immunoglobulin treatment for hospitalised infants and young children with respiratory syncytial virus infection”. The Cochrane Database of Systematic Reviews 2023 (10), CD009417. o. DOI:10.1002/14651858.CD009417.pub3. PMID 37870128. (Hozzáférés: Hiba: Érvénytelen idő.)
- ↑ a b (2014. június 1.) „Bronchodilators for bronchiolitis”. The Cochrane Database of Systematic Reviews 2014 (6), CD001266. o. DOI:10.1002/14651858.CD001266.pub4. PMID 24937099. Forráshivatkozás-hiba: Érvénytelen
<ref>címke, „Gadomski_2014” nevű forráshivatkozás többször van definiálva eltérő tartalommal - ↑ (2015. március 1.) „Leukotriene inhibitors for bronchiolitis in infants and young children”. The Cochrane Database of Systematic Reviews (3), CD010636. o. DOI:10.1002/14651858.cd010636.pub2. PMID 25773054. (Hozzáférés: Hiba: Érvénytelen idő.)
- ↑ (2014. október 1.) „Antibiotics for bronchiolitis in children under two years of age”. The Cochrane Database of Systematic Reviews 2014 (10), CD005189. o. DOI:10.1002/14651858.CD005189.pub4. PMID 25300167. (Hozzáférés: Hiba: Érvénytelen idő.)
- ↑ (2009. február 1.) „The burden of respiratory syncytial virus infection in young children”. The New England Journal of Medicine 360 (6), 588–598. o. DOI:10.1056/NEJMoa0804877. PMID 19196675.
- ↑ Wang (2023. október 1.). „Association of COVID-19 with respiratory syncytial virus (RSV) infections in children aged 0–5 years in the USA in 2022: a multicentre retrospective cohort study” (angol nyelven). Family Medicine and Community Health 11 (4), e002456. o. DOI:10.1136/fmch-2023-002456. ISSN 2305-6983. PMID 37832975.
- ↑ „Children's hospitals call on Biden to declare emergency in response to 'unprecedented' RSV surge”, 2022. november 18.. [2022. november 21-i dátummal az eredetiből archiválva] (Hozzáférés: 2022. november 20.)
Fordítás
[szerkesztés]- Ez a szócikk részben vagy egészben a Respiratory syncytial virus című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
| Az itt található információk kizárólag tájékoztató jellegűek, nem minősülnek orvosi szakvéleménynek, nem pótolják az orvosi kivizsgálást és kezelést. A cikk tartalmát a Wikipédia önkéntes szerkesztői alakítják ki, és bármikor módosulhat. |

