Nemesgázok

Balról jobbra: hélium, neon, argon, kripton és xenon
A nemesgázok a periódusos rendszer VIII-as főcsoportjában (IUPAC szerinti 18-as csoportjában) található elemek. A hélium (He), neon (Ne), argon (Ar), kripton (Kr), xenon (Xe) és a radon (Rn) tartozik ebbe a csoportba. Egyes feltételezések szerint a hetedik periódusban relativisztikus hatások miatt a széncsoportbeli fleróvium mutat a nemesgázokra jellemző tulajdonságokat a VIII. főcsoportbeli oganeszon helyett.[1][2] A nemesgázok sok hasonló tulajdonsággal bírnak. Standard hőmérsékleten és nyomáson színtelen, szagtalan, egyatomos gázok. Kémiailag közömbösek, reakcióba csak szélsőséges körülmények közt vihetők.
A nemesgázok tulajdonságai jól magyarázhatók az atomszerkezetre vonatkozó modern elméletekkel: ezek szerint a nemesgázok legkülső elektronhéja telített (a héliumnál 1s2, a többi nemesgáznál ns2np6) és az így kialakult stabilis elektronkonfiguráció a felelős az igen kis mértékű reakciókészségükért. A gázatomok közt csak gyenge van der Waals-féle erők hatnak, ezért forráspontjuk az összes elem közül a legalacsonyabb. Olvadás- és forráspontjuk között mindössze néhány foknyi eltérés van, ezért csak egy szűk hőmérséklet-tartományban léteznek folyadékként.
A neont, argont, kriptont és xenont a levegőből nyerik ki cseppfolyósítást követő frakcionált desztillációval. A héliumot a földgázból nyerik, amelynek héliumtartalma helyenként a 7%-ot is elérheti, kriogén szétválasztási technikákkal, a radont pedig rendszerint oldott rádium-, tórium- vagy uránvegyületek radioaktív bomlásából izolálják. Közömbösségük miatt számos olyan területen alkalmazhatók, ahol a kémiai reakciókat el szeretnék kerülni. Például izzólámpákat gyakran töltenek meg kriptongázzal, hogy megakadályozzák a volfrámszál eloxidálódását, a mélytengeri búvárok pedig héliumot használnak légzőberendezéseikben az oxigén mellé keverve, hogy csökkentsék a nagy nyomáson, normál levegő használatával fellépő nitrogénnarkózis (a nitrogén nagy parciális nyomása okozta euforikus állapot), a keszonbetegség és az oxigéntoxicitás esélyét. Korábban a gyúlékony hidrogén helyett léghajók töltésére is használták a héliumot, ma már ez az alkalmazása nem jelentős, viszont meteorológiai léggömbök töltésére még mindig használják.
Történet
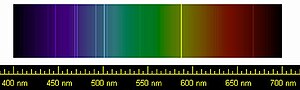

A nemesgáz kifejezés a német Edelgas szó tükörfordításából ered, melyet először Hugo Erdmann használt 1898-ban,[3] utalva ezzel az elemek rendkívül kicsi reaktivitására. A név analóg a nemesfém kifejezéssel, amely szintén az elemek kis reakciókészségére utal.
1784-ben az angol fizikus és kémikus Henry Cavendish a levegő összetételét vizsgálva megfigyelte, hogy a levegőmintában oxigénfeleslegben létrehozott ismételt elektromos kisüléssel sem sikerült reakcióba vinni a gáz egy részét, amelyről meghatározta, hogy az a levegőnek nem több mint 1/120-ad része.[4] Az 1868. augusztus 18-i napfogyatkozás alkalmával Pierre Janssen és Joseph Norman Lockyer a Nap kromoszférájának spektrumában egy sárga vonalat észleltek a nátrium D vonala mellett, ennek alapján egy új elemet feltételeztek. Az elemet a Nap görög neve (ήλιος, Helios) alapján héliumnak nevezték el.[5] Ugyanezt a spektrumvonalat később Luigi Palmieri is észlelte 1881-ben a Vezúvból kitörő vulkáni gázokban, majd végül William Ramsay erősítette meg földi jelenlétét az atmoszferikus gázok vizsgálata során.
1895-ben John William Strutt felfedezte, hogy a levegőből az oxigén, a szén-dioxid és a vízgőz eltávolításával nyert nitrogén sűrűsége nagyobb, mint az ammóniából kémiailag előállított nitrogéné. Ramsay-vel együtt azt feltételezte, hogy a levegőből kivont nitrogén valamilyen más gázzal volt keverve, ezért egy kísérletben a magnéziumot nitrogénben hevítette, és így kis mennyiségű egyatomos gáz maradt vissza, amit a görög αργός (argosz = lusta) szó után argonnak neveztek el.[4] Ezzel a felfedezéssel rájöttek, hogy egy teljes csoport hiányzott a periódusos rendszerből. Ramsay-nek az argonnal kapcsolatos kutatásai során elsőként sikerült héliumot előállítania a kleveit ásvány hevítésével. 1902-ben a héliumra és argonra vonatkozó bizonyítékokat elfogadva Mengyelejev hozzáadta a nemesgázokat 0. csoportként a táblázatához, amely később a periódusos rendszerré vált.[6]
Ramsay folytatta a nemesgázok keresését, és 1898-ig a cseppfolyós levegő alacsony hőmérsékleten frakcionált desztillációjával három további elemet sikerült elkülönítenie, amelyeket kriptonnak (κρυπτός – kriptosz = elrejtőzik, eltitkol), neonnak (νέος – neosz = új) és xenonnak (ξένος – xenosz = idegen, furcsa) nevezett el. A radont először Friedrich Ernst Dorn azonosította 1898-ban[7] és rádiumemanációnak nevezte, de nem tekintették nemesgáznak egészen 1904-ig, amikor megállapították, hogy tulajdonságai hasonlóak a többi nemesgázéhoz.[8] Strutt és Ramsay a nemesgázok felfedezéséért 1904-ben fizikai és kémiai Nobel-díjban részesült.[9][10]
A nemesgázok felfedezése nagyban segítette az atomszerkezet általános megértését. 1895-ben Henri Moissan francia kémikus megkísérelte az argont reakcióba vinni a legelektronegatívabb elemmel, a fluorral, sikertelenül. A tudósok egészen a 20. század végéig próbálkoztak sikertelenül argonvegyületek előállításával, de ezek a kísérletek hozzájárultak az atomszerkezetre vonatkozó új elméletek születéséhez. Ezen kísérletek alapján 1913-ban publikálta Niels Bohr az atom szerkezetére vonatkozó modelljét, miszerint az atommag körül az elektronok héjakba vannak szerveződve, és a nemesgázok külső elektronhéjai a hélium kivételével mindig nyolc elektront tartalmaznak.[8] 1916-ban Gilbert N. Lewis megfogalmazta az úgynevezett oktettszabályt, vagyis hogy a külső elektronhéjon kialakuló elektronoktett a legstabilabb elrendeződés bármely atom számára, és mindegyik elem ennek kialakítására törekszik. Ez magyarázattal szolgál a nemesgázok csekély reaktivitására, mivel nekik nem szükséges elektron felvétele vagy leadása, hogy kialakítsák az elektronoktettet.[11]
1962-ben Neil Bartlett felfedezte az első nemesgázvegyületet, a xenon-hexafluoroplatinátot.[12] Ezt rövid időn belül más nemesgázok vegyületeinek felfedezése követte: 1962-ben a radon-difluoridé,[13] majd 1963-ban a kripton-difluoridé.[14] Az argon első stabil vegyületéről 2000-ben számoltak be, amikor argon-fluorohidridet sikerült előállítani 40 K hőmérsékleten.[15]
1998-ban az Egyesített Atomkutató Intézet dubnai tudósai kalciummal bombáztak plutóniumot, hogy előállítsák a 114-es rendszámú elemet,[16] a fleróviumot.[17] Előzetes kémiai kísérletek azt jelzik, hogy ez lehet a szupernehéz elemek közül az első, amely nemesgázszerű tulajdonságokat mutat annak ellenére, hogy a széncsoport tagja a periódusos rendszerben.[18] 2006 októberében az Egyesített Atomkutató Intézet és a Lawrence Livermore Nemzeti Laboratórium tudósai mesterségesen előállították a VIII. főcsoport hetedik elemét, az ununoktiumot,[19] kalifornium kalciummal való bombázásával.[20]
Fizikai és atomi tulajdonságok

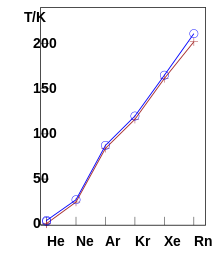
A nemesgázok atomjai közt csak gyenge másodrendű kötőerők lépnek fel, emiatt olvadás- és forráspontjuk rendkívül alacsony. Standard hőmérsékleten és nyomáson mind egyatomos gáz, köztük olyanok is, melyeknek atomtömege nagyobb, mint más normális esetben szilárd elemeknek.[8] Az olvadás- és forráspontértékek a csoportban lefelé haladva nőnek. A hélium más elemekkel összevetve számos különleges tulajdonsággal bír: forrás- és olvadáspontja az összes elem közül a legalacsonyabb, az egyetlen elem, amely szuperfolyékony tulajdonságot mutat, és az egyetlen elem, amelyet standard nyomáson nem lehet hűtéssel megszilárdítani – ehhez 25 atmoszféra nyomás szükséges 0,95 K hőmérsékleten.[21] A nemesgázoknak a xenonig terjedően több stabil izotópjuk is van. A radonnak ezzel szemben egy stabil izotópja sincs, a leghosszabb életű izotópja, a 222Rn felezési ideje 3,8 nap, és alfa-bomlással polóniummá alakul, ami tovább bomlik ólommá.[8]
A nemesgázok atomsugara a többi főcsoportbeli elemekhez hasonlóan fokozatosan nő a csoportokban lefelé haladva, az elektronhéjak számának növekedése miatt. Az atomméret sok másik tulajdonsággal áll összefüggésben. Például az ionizációs energia a rendszám növekedésével a nemesgázok között is csökkenő tendenciát mutat, ennek oka, hogy a nagyobb atomoknál a külső elektronok távolabb vannak az atommagtól, amely így nem gyakorol rájuk akkora vonzó hatást, ezért könnyebben leszakíthatók az atomról. A nehezebb nemesgázok ionizációs energiája kisebb is lehet, mint néhány második periódusbeli elemé, mint például a fluoré és az oxigéné, ez pedig a reakcióképességükön is megmutatkozik. Minden periódusban a nemesgázok ionizációs energiája a legnagyobb, ez is az elektronkonfiguráció stabilitását jelzi és összefüggésben áll az elemek kicsi reakciókészségével.[22] A nemesgázok nem képesek elektronfelvétellel stabil anion kialakítására, tehát elektronaffinitásuk pozitív.[* 1][23]
A nemesgázok makroszkopikus fizikai tulajdonságait az atomok közt fellépő, gyenge van der Waals-erők határozzák meg. A vonzó hatás az atomok méretével (vagyis a polarizálhatóság növekedésével és az ionizációs energia csökkenésével) növekszik. Ennek eredményeként a csoporton belül egyenletes változások figyelhetők meg: A rendszám növekedésével nő az olvadáspont, a forráspont, a párolgáshő és az oldhatóság. A sűrűségbeli növekedést az atomtömeg növekedése okozza.[22]
A nemesgázok közel ideális gázok, de az ideális gáztörvénytől való kis eltérésük kulcsot jelentett a molekuláris kölcsönhatások, a molekulapályák tanulmányozásában. A Lennard-Jones-potenciált, melyet gyakran alkalmaznak részecskék közti kölcsönhatások modellezésére, John Lennard-Jones az argonnal kapcsolatos kísérleti adatokból vezette le 1924-ben, még mielőtt a kvantummechanika által kínált eszközök lehetővé tették a molekuláris erők megértését.[24] A nemesgázok – különösen a hélium – egy gyakorlati szempontból fontos tulajdonsága, hogy a laboratóriumokban használt többféle anyagon képesek átdiffundálni. Ilyen például a gumi és a PVC, de a hélium a legtöbb üvegen is átdiffundál.[22]
| Elem | Hélium (3He és 4He) | Neon | Argon | Kripton | Xenon | Radon | |
|---|---|---|---|---|---|---|---|
| Gázkisülés színe |  |
 |
 |
 |
 |
vörös[25] | |
| Emissziós színkép | |||||||
| Olvadáspont (1013 hPa)[26] | 0,319 K (−272,831 °C) (29,315 bar) |
0,775 K (−272,375 °C) (25,316 bar) |
24,57 K (−248,58 °C) |
84,0 K (−189,2 °C) |
116,2 K (−157,0 °C) |
161,4 K (−111,8 °C) |
kb. 202 K (kb. −71 °C) |
| Forráspont (1013 hPa)[26] | 3,1905 K (−269,9595 °C) |
4,224 K (−268,926 °C) |
27,09 K (−246,06 °C) |
87,295 K (−185,855 °C) |
119,79 K (−153,36 °C) |
165,03 K (−108,12 °C) |
211,9 K[27] (−61,3 °C) |
| Kritikus pont[26] |
|
|
|
|
|
|
|
| Hármaspont[26] | nem elérhető |
|
|
|
|
||
| Párolgáshő (kJ/mol) | 0,08 | 1,74 | 6,52 | 9,05 | 12,65 | 18,1 | |
| Oldhatóság vízben 20 °C-on (cm³/kg) | 8,61 | 10,5 | 33,6 | 59,4 | 108,1 | 230 | |
| Sűrűség (0 °C, 1013 hPa)[26] | 0,13448 kg/m³ | 0,17847 kg/m³ | 0,9000 kg/m³ | 1,7839 kg/m³ | 3,7493 kg/m³ | 5,8971 kg/m³ | 9,73 kg/m³ |
| Atomsugár (pm) | 31 | 38 | 71 | 88 | 108 | 120 | |
| Ionizációs energia (kJ/mol) | 2372 | 2080 | 1520 | 1351 | 1170 | 1037 | |
| Elektronegativitás[28] | 4,16 | 4,79 | 3,24 | 2,97 | 2,58 | 2,60 | |
| Szerkezet |  |
 |
 |
 |
 |

| |
| Kristályszerkezet | hatszöges | köbös | köbös | köbös | köbös | köbös | |
| Rácsállandó[29] |
|
a = 4,43 Å |
a = 5,26 Å |
a = 5,72 Å |
a = 6,20 Å |
a = 6,55 Å (számított)[30] | |
Vegyületek
Nem kovalens vegyületek

1962 előtt a nemesgázvegyületek közül egyedül a klatrátokat tudták izolálni, más vegyületeket, például koordinácios vegyületeket csak spektroszkópiai eszközökkel sikerült megfigyelni.[31] A klatrátok olyan vegyületek, ahol a nemesgázatomok kristályrácsba, vagy szerves és szervetlen vegyületekből létrejövő üregekbe vannak zárva. A vendég nemesgázatomok és a gazdamolekulák között csak gyenge van der Waals-erők hatnak, így a klatrátok nem sztöchiometrikusak. A klatrátok kialakulásához létfontosságú feltétel, hogy a nemesgázatom megfelelő méretű legyen és illeszkedjen a gazdamolekulák által alkotott üregbe. Például az argon, a kripton és a xenon kristályos β-hidrokinonnal képesek klatrátot alkotni, de a hélium és a neon túl kicsi ehhez, vagy nem polarizálható kellő mértékben a befogadáshoz.[32] A képződött vegyületek viszonylag stabilak, de oldódáskor vagy olvadáskor a gáz felszabadul.
Nemesgáz-hidrátok is képződhetnek, ha a víz nagynyomású gáz jelenlétében fagy meg. Ezek ideális összetétele G8(H2O)46, és az argon, kripton és xenongázzal képződnek. Legstabilabb közülük a Xe·5,75 H2O összetételű vegyület,[33] ennek az olvadáspontja 24 °C.[34] Ennek a hidrátnak a deuterált verzióját is előállították már.[35]

A nemesgázok fullerénnel endohedrális vegyületeket alkothatnak, amelyben a nemesgázatom a fullerénmolekula belsejébe van zárva. 1993-ban felfedezték, hogy ha a C60 fullerént héliummal vagy neonnal együtt nagy nyomásnak teszik ki, sajátságos vegyületek, például He@C60 képződhetnek (a @ azt jelöli, hogy a héliumatom a C60 belsejében található).[36] Azóta sikerült előállítani az argon, a kripton és xenon ilyen típusú vegyületét is.[37]
Kovalens vegyületek
A xenon vegyületei

A nemesgázok közül a xenon vegyületei mutatják a legnagyobb változatosságot.[38] A xenon oxidációs állapota vegyületeiben +2, +4, +6 és +8 lehet, és egy erősen elektronegatív atomhoz, például fluorhoz, vagy oxigénhez kapcsolódik. Ilyen vegyületek a xenon-difluorid (XeF2), a xenon-tetrafluorid (XeF4), a xenon-hexafluorid (XeF6), a xenon-tetroxid (XeO4), és a nátrium-perxenát (Na4XeO6). Az első xenonvegyületről 1962 júniusában számolt be Neil Bartlett, aki megfigyelte, hogy az erélyes oxidálószer platina-hexafluorid képes volt a O2-t O2+-á oxidálni. Tekintve, hogy a O2 O2+-á való oxidációjának ionizációs energiája (1165 kJ mol−1) közel azonos a xenon ionizációs energiájával (1170 kJ mol−1), Bartlett megkísérelte a reakciót xenonnal is véghezvinni. Ennek eredményeként egy narancssárga színű, kristályos anyag keletkezett, ennek jelölésére a Xe+[PtF6]− képletet javasolta.[31] Később megállapították, hogy a vegyület ennél összetettebb, és XeFPtF5-ot és XeFPt2F11-ot egyaránt tartalmaz.[39]
A xenon három különböző fluoridja az elemek közvetlen reakciójával előállítható a következő egyenletek szerint:
- Xe + F2 → XeF2
- Xe + 2F2 → XeF4
- Xe + 3F2 → XeF6
A tisztán történő előállításhoz fontos a feltételek pontos betartása. A XeF2 fluor xenongázfelesleg mellett nikkeledényben 400 °C-ra való melegítéssel, vagy napfénnyel történő besugárzással előállítható. A XeF4 előállításához xenon és fluorgáz 1:5 arányú elegyének 6 atmoszféra alatti nyomáson 400 °C-ra történő melegítése szükséges, a XeF6-hoz pedig 1:20 arányú xenon-fluor elegyet kell tartósan, 250–300 °C-on 50–60 atmoszféra nyomáson nikkeledényben tartani.[40] Mindhárom fluorid szilárd, kristályos anyag, erőteljes oxidáló- és fluorozószerek, főként a XeF2 széleskörűen használható.[41] A XeF2 vízben oldódik, és 25 g/dm3 koncentrációjú oldat készíthető belőle, de bázis jelenlétében pillanatszerűen bomlik:
- 2XeF2 + 2 H2O → 2 Xe + 4 HF + O2
A XeF4 és a XeF6 vízben azonnal és hevesen hidrolizál.[40] A xenon fluoridjai mellett előállították már oxifluoridjait (XeOF2, XeOF4, XeO2F2, XeO3F2, XeO2F4) és oxidjait (XeO2, XeO3 és XeO4) is. Ezek a vegyületek instabilak és gyakran robbanásveszélyesek. A xenon nitrogénnel, klórral és szénnel alkotott vegyületei szintén ismertek. Speciális körülmények között fémekkel, például arannyal vagy higannyal alkotott komplexek is előállíthatók.[42][43]
Más nemesgázok vegyületei

Elméletben a radon reaktívabb a xenonnál, ezért könnyebben kellene kötéseket kialakítania, mint a xenonnak. Ennek ellenére nagy radioaktivitása és rövid felezési idejű izotópjai miatt eddig csak pár fluoridját és oxidját sikerült gyakorlatban előállítani.[44]
A kripton kevésbé reaktív, mint a xenon, de már több +2-es oxidációs állapotú vegyületéről is beszámoltak.[42] Ezek közül a kripton-difluorid a legjelentősebb és a legkönnyebben jellemezhető. A KrF2 színtelen, könnyen párolgó szilárd anyag, amely −196 °C körüli hőmérsékleten, elektromos kisülés vagy nagy energiájú elektron- vagy röntgensugárzás hatására keletkezik a kripton–fluor gázelegyben:
- Kr + F2 → KrF2
A KrF2 termikusan nem stabil, szobahőmérsékleten lassan bomlik. A xenon-difluoridnál kisebb stabilitása miatt erősebb fluorozószer, és vízben lúg hozzáadása nélkül is gyorsan bomlik.[40] Kripton–nitrogén, illetve kripton–oxigén kötést tartalmazó vegyületeket is állítottak már elő,[45] de ezek csak rendre -60 °C és -90 °C alatt stabilak.[42]
Más nemfémekhez (hidrogén, klór, szén) illetve átmenetifémekhez (réz, ezüst, arany) kapcsolódó kriptont tartalmazó vegyületeket is megfigyeltek, de csak alacsony hőmérsékleten nemesgázmátrixban, vagy szuperszonikus nemesgázsugárban.[42] Hasonló körülményeket alkalmaztak az argon első néhány vegyületének előállítására 2000-ben, ezek közé tartozott az argon-fluorohidrid (HArF) és a rézzel, ezüsttel és arannyal alkotott vegyület.[42] A héliumnak vagy a neonnak eddig még nem fedezték fel stabil, semleges, kovalens vegyületét.[42]
A nemesgázok gázfázisban alkothatnak stabil összetett ionokat. Erre a legegyszerűbb példa az 1925-ben felfedezett hélium-hidrid-ion (HeH+).[46] Abból kiindulva, hogy az iont a világegyetemben megtalálható két leggyakoribb elem alkotja, feltételezik, hogy megtalálható a csillagközi térben, de eddig még nem sikerült kimutatni.[47] Ezeken az ionokon kívül a nemesgázok számos excimerje ismert, az ilyen vegyületek, mint az ArF vagy a KrF csak gerjesztett állapotban stabilak. Ezeknek a vegyületeknek excimerlézerekben veszik hasznát.
Előfordulás és előállítás
A nemesgázok gyakorisága az univerzumban a csoportban lefelé haladva általánosan csökken. A hélium a hidrogén utáni leggyakoribb elem a világegyetemben, annak körülbelül 24 tömegszázalékát teszi ki. A világegyetemben megtalálható hélium legnagyobb része az ősrobbanás során végbemenő nukleoszintézissel jött létre, de mennyisége azóta folyamatosan nő a csillagokban lejátszódó hidrogénfúzió (és kis részben a nagy tömegszámú elemek alfa-bomlása) miatt.[48][49] A földi mennyiségük más tendenciákat követ, például a hélium csak a harmadik leggyakoribb nemesgáz a légkörben. Ennek oka, hogy az atmoszférában nem található primordiális hélium, mivel kis atomtömege miatt a Föld gravitációs vonzóereje nem képes megtartani.[50] A Földön jelenlévő hélium ehelyett a földkéregben megtalálható nehéz elemek, például az urán és tórium alfa-bomlásakor keletkezik, és hajlamos a földgázforrásokban felhalmozódni.[50]
Az argon mennyisége ezzel szemben nagyobb a várhatónál a földkéregben jelen lévő 40K béta-bomlása miatt. A 40K bomlásának terméke a 40Ar, amely a Földön messze a leggyakoribb argonizotóp annak ellenére, hogy a Naprendszerben viszonylag ritka. Ez a folyamat az alapja a kálium–argon kormeghatározásnak.[51]
A xenon meglepően kis koncentrációban fordul elő a légkörben, ezt a hiányzó xenon problémájának is nevezték. Egy elmélet szerint a hiányzó xenon a földkéreg belsejében lévő ásványokba lehet zárva.[52] A xenon-dioxid felfedezése után egy kutatás kimutatta, hogy a xenon helyettesítheti a szilíciumot a kvarcban.[53]
A radon a litoszférában képződik a rádium alfa-bomlásakor. Képes beszivárogni az épületekbe az alapjaikon lévő repedéseken át és felgyűlni a rosszul szellőztetett helységekben. Nagy radioaktivitása miatt kockázatot jelent az egészségre: csak az Egyesült Államokban évente 21 000 tüdőrákos halálesetről mutatták ki, hogy azért a radon a felelős.[54]
| Előfordulás | Hélium | Neon | Argon | Kripton | Xenon | Radon |
|---|---|---|---|---|---|---|
| Naprendszerben (minden szilíciumatomra db)[55] | 2343 | 2,148 | 0,1025 | 5,515 × 10−5 | 5,391 × 10−6 | – |
| A Föld légkörében (térfogatarány ppm-ben)[56] | 5,20 | 18,20 | 9340,00 | 1,10 | 0,09 | (0,06–18) × 10−19[26] |
| Magmás kőzetekben (tömegarány ppm-ben)[22] | 3 × 10−3 | 7 × 10−5 | 4 × 10−2 | – | – | 1,7 × 10−10 |
| Gáz | 2004-es ár (USD/m³)[57] |
|---|---|
| Hélium (ipari célra) | 4,20–4,90 |
| Hélium (laboratóriumi célra) | 22,30–44,90 |
| Argon | 2,70–8,50 |
| Neon | 60–120 |
| Kripton | 400–500 |
| Xenon | 4000–5000 |
A neon, argon, kripton és xenon fő forrása az atmoszféra, ahonnan a levegő cseppfolyósítását követő frakcionált desztillációval nyerik őket. Valamennyi argont a szintetikus ammóniát gyártó üzemekben is termelnek, mivel szennyezőként feldúsul a hidrogén- és nitrogéntartalmú szintézisgázban.[40] Az argon világtermelése 1975-ben 700 000 tonna volt, ez 1993-ra jelentősen nőtt, ekkor csak az Egyesült Államokban 716 000 tonnát gyártottak belőle. A héliumot – bár mennyisége az atmoszférában ötszöröse a kriptonénak és hatszorosa a xenonénak – a földgáz frakcionált desztillációjával állítják elő, amelynek héliumtartalma helyenként akár a 7%-ot is elérheti.[58] A radont a rádiumvegyületek radioaktív bomlásából nyerik.[8] A nemesgázok ára arányos a természetes előfordulásukkal, így közülük az argon a legolcsóbb, a xenon a legdrágább.
Felhasználás
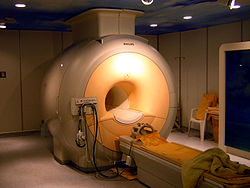


A nemesgázok rendkívül alacsony olvadás- és forráspontértékei lehetővé teszik kriogén hűtőközegként való alkalmazásukat.[59] Különösen a cseppfolyós héliumot (melynek olvadáspontja 4,2 K) használják szupravezető mágnesek hűtésére a mágnesesrezonancia-képalkotó készülékekben és NMR-készülékekben.[60] Néhány atomreaktorban hűtőközegként alkalmaznak héliumot. A cseppfolyós neont szintén használják kriogén célokra, mert bár nem hűthető olyan hidegre, mint a cseppfolyós hélium, egységnyi térfogatra számított párolgáshője azonban 40-szerese a folyékony héliuménak, és több mint háromszorosa a cseppfolyós hidrogénének.[26][* 2]
A héliumot légzőberendezésekben használják a nitrogén helyettesítésére, a folyadékokban – főleg a lipidekben – való kicsi oldhatósága miatt. Nagy nyomáson, például mélytengeri búvárkodásnál a gázok feloldódnak a vérben, és a nitrogénnarkózisnak nevezett euforikus állapotot idézik elő.[62] A narkotikus hatás csökkenthető, ha a légzőkészüléket mesterséges levegővel töltik meg, amelyben a nitrogént héliummal helyettesítik, mint a trimixben, vagy a helioxban.[63] Ilyen gázkeveréket használva a nyomáscsökkenés miatt fellépő dekompressziós betegség veszélye is csökken, mert a vérben oldott kevesebb gázból kevesebb gázbuborék válhat ki a nyomás csökkenésével.[8][64]
A Hindenburg léghajó 1937-es katasztrófája óta[65] a hidrogént léghajókban és meteorológiai léggömbökben a kevésbé gyúlékony héliummal helyettesítik, még ha ez a felhajtóerő 8,6%-os csökkenését is jelenti.[66]
Sok helyen használják a nemesgázokat inert atmoszféra biztosítására. Az argont levegőre, illetve nitrogénre érzékeny vegyületek szintézisekor használják. A szilárd argont nagyon instabil vegyületek, például reaktív intermedierek tanulmányozásánál is használják, úgy hogy a vegyületeket egy inert mátrixban ejtik csapdába nagyon alacsony hőmérsékleten.[67] A héliumot gázkromatográfiában alkalmazzák vivőgázként, hőmérők töltésére és sugárzásmérő eszközökben, például Geiger–Müller-számlálóban és buborékkamrában.[57] A héliumot és az argont gyakran használják ívhegesztésnél védőgázként, illetve más metallurgiai eljárásoknál, továbbá a félvezetőiparban a szilícium gyártása során.[26]
A nemesgázok egyik legfőbb felhasználási területe a világítás. Az argont, nitrogénnel keverve izzólámpák töltésére használják.[26] A kriptont nagy teljesítményű, nagyobb színhőmérsékletű és hatásfokú izzókban használják, ugyanis a kripton jobban csökkenti az izzószál párolgását, mint az argon. A halogénlámpákat általában kriptonnal töltik, amelyhez kis mennyiségű jód- vagy brómvegyületet adnak.[26] A nemesgázokat kisülési csövekben is használják, ilyenek például a „neoncsövek”. A gázkisülési cső által kisugárzott fény színe a használt gáz összetételétől függ. Felhasználják a nemesgázokat fluoreszcens lámpák töltésére is, de ekkor a lámpa színe nem a gáztól, hanem a cső falára felvitt fluoreszcens réteg minőségétől függ. A xenont gyakran használják xenon ívlámpákban. Ezeknek a lámpáknak közel folytonos színképe a napfényre emlékeztet, és filmvetítőkben vagy autók fényszórójában használják.[26]
A nemesgázokat excimerlézerekben is alkalmazzák. Ezek működése a rövid élettartamú, csak gerjesztett állapotban kötött állapotú excimermolekulákon alapszik. A lézerben használt excimerek lehetnek nemesgáz-dimerek, mint az Ar2, Kr2 vagy Xe2, de gyakoribb, hogy a nemesgázatom egy halogénhez kapcsolódik, mint például az ArF, a KrF, a XeF, vagy a XeCl esetében. Ezek a lézerek ultraibolya-sugarakat bocsátanak ki, így a rövid hullámhossz miatt (193 nm az ArF-nál és 248 nm a KrF-nál) alkalmasak nagy térbeli felbontású képalkotásra. Az excimerlézereknek számos ipari, orvosi és tudományos alkalmazása létezik. Felhasználják őket mikrolitográfiai és mikrogyártási folyamatokban, amelyek elengedhetetlenek az integrált áramkörök gyártásánál, emellett lézeres műtéteknél is használják őket, köztük az angioplasztikában és szemműtétekben is.[68]
Néhány nemesgáz közvetlenül is alkalmazható a gyógyászatban. A héliumot néha használják asztmás betegek légzésének megkönnyítésére.[26] A xenont altatószerként használják, mert a lipidekben való jó oldhatósága hatásosabbá teszi a szokványos dinitrogén-oxidnál, és mert könnyebben eltávozik a szervezetből, gyorsabb ébredést téve lehetővé.[69] A hiperpolarizált xenon mágnesesrezonancia-képalkotásban is használható.[70] A radont daganatos betegségek gyógyítására sugárterápiában[8] és fémöntvények minőségének ellenőrzésére használt radioaktív sugárforrások készítésére használják.
Megjegyzések
- ↑ Az elektronaffinitást többféleképpen szokták definiálni, jelen esetben a Magyarországon elterjedtebb értelmezést használjuk, vagyis azt az energiamennyiséget értjük alatta, mely egy mólnyi gázállapotú atom vagy molekula esetén egy elektron felvételéhez szükséges egyszeresen negatív töltésű ion létrehozásához. Így a pozitív elektronaffinitás azt jelenti, hogy a negatív ion képződéséhez energiabefektetés szükséges. Az angol nyelvterületen másképp definiálják az elektronaffinitást, ezért ott az elektronaffinitás-értékek ellentettjei a Magyarországon használatos értékeknek, vagyis a nemesgázok elektronaffinitása negatív.
- ↑ A hidrogén párolgáshője literenként 31,84 kJ, a héliumé 2,59 kJ, a neoné pedig 104,67 kJ.[61]
Hivatkozások
- ↑ Flerov laboratory of nuclear reactions. JINR. (Hozzáférés: 2009. augusztus 8.)
- ↑ Nash, Clinton S. (2005). „Atomic and Molecular Properties of Elements 112, 114, and 118”. J. Phys. Chem. A 109 (15), 3493–3500. o. DOI:10.1021/jp050736o. PMID 16833687.
- ↑ Renouf, Edward (1901). „Noble gases”. Science 13 (320), 268–270. o. DOI:10.1126/science.13.320.268.
- ↑ a b Ojima 2002, p. 1
- ↑ Oxford English Dictionary (1989), s.v. "helium". Retrieved December 16, 2006, from Oxford English Dictionary Online. Also, from quotation there: Thomson, W. (1872). Rep. Brit. Assoc. xcix: "Frankland and Lockyer find the yellow prominences to give a very decided bright line not far from D, but hitherto not identified with any terrestrial flame. It seems to indicate a new substance, which they propose to call Helium."
- ↑ Mendeleev 1903, p. 497
- ↑ Partington, J. R. (1957). „Discovery of Radon”. Nature 179 (4566), 912. o. DOI:10.1038/179912a0.
- ↑ a b c d e f g Noble Gas, Encyclopædia Britannica (2008)
- ↑ Cederblom, J. E.: The Nobel Prize in Physics 1904 Presentation Speech, 1904
- ↑ Cederblom, J. E.: The Nobel Prize in Chemistry 1904 Presentation Speech, 1904
- ↑ Gillespie, R. J.; Robinson, E. A. (2007). „Gilbert N. Lewis and the chemical bond: the electron pair and the octet rule from 1916 to the present day”. J Comput Chem 28 (1), 87–97. o. DOI:10.1002/jcc.20545. PMID 17109437.
- ↑ Bartlett, N. (1962). „Xenon hexafluoroplatinate Xe+[PtF6]−”. Proceedings of the Chemical Society (6), 218. o. DOI:10.1039/PS9620000197.
- ↑ Fields, Paul R.; Stein, Lawrence; Zirin, Moshe H. (1962). „Radon Fluoride”. Journal of the American Chemical Society 84 (21), 4164–4165. o. DOI:10.1021/ja00880a048.
- ↑ Grosse, A. V.; Kirschenbaum, A. D.; Streng, A. G.; Streng, L. V. (1963). „Krypton Tetrafluoride: Preparation and Some Properties”. Science 139 (3559), 1047–1048. o. DOI:10.1126/science.139.3559.1047. PMID 17812982.
- ↑ Khriachtchev, Leonid; Pettersson, Mika; Runeberg, Nino; Lundell, Jan; Räsänen, Markku (2000). „A stable argon compound”. Nature 406 (6798), 874–876. o. DOI:10.1038/35022551. PMID 10972285.
- ↑ Yu. Ts. Oganessian, V. Utyonkov, Yu. Lobanov, et al. (1999). „Synthesis of Superheavy Nuclei in the 48Ca + 244Pu Reaction”. Physical Review Letters 83, 3154–3157. o, Kiadó: American Physical Society. DOI:10.1103/PhysRevLett.83.3154.
- ↑ Woods, Michael: Chemical element No. 110 finally gets a name—darmstadtium. Pittsburgh Post-Gazette, 2003. május 6. (Hozzáférés: 2008. június 26.)
- ↑ Gas Phase Chemistry of Superheavy Elements (PDF). Texas A&M University. [2012. február 20-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. május 31.)
- ↑ Robert C. Barber, Paul J. Karol, Hiromichi Nakahara, Emanuele Vardaci, and Erich W. Vogt (2011). „Discovery of the elements with atomic numbers greater than or equal to 113 (IUPAC Technical Report)*”. Pure Appl. Chem. 83 (7), Kiadó: IUPAC. DOI:10.1515/ci.2011.33.5.25b. (Hozzáférés: 2014. május 30.)
- ↑ Yu. Ts. Oganessian, V. Utyonkov, Yu. Lobanov, et al. (2006). „Synthesis of the isotopes of elements 118 and 116 in the Sablon:SimpleNuclide and Sablon:SimpleNuclide + Sablon:SimpleNuclide fusion reactions”. Physical Review C 74 (4), 44602. o. DOI:10.1103/PhysRevC.74.044602.
- ↑ Solid Helium. University of Alberta. [2008. február 12-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. június 22.)
- ↑ a b c d Greenwood 1997, p. 891
- ↑ Wheeler, John C. (1997). „Electron Affinities of the Alkaline Earth Metals and the Sign Convention for Electron Affinity”. Journal of Chemical Education 74, 123–127. o. DOI:10.1021/ed074p123. ; Kalcher, Josef; Sax, Alexander F. (1994). „Gas Phase Stabilities of Small Anions: Theory and Experiment in Cooperation”. Chemical Reviews 94 (8), 2291–2318. o. DOI:10.1021/cr00032a004.
- ↑ Mott, N. F. (1955). „John Edward Lennard-Jones. 1894–1954”. Biographical Memoirs of Fellows of the Royal Society 1, 175–184. o. DOI:10.1098/rsbm.1955.0013.
- ↑ Klaus Hoffmann: Kann man Gold machen? Gauner, Gaukler und Gelehrte. Aus der Geschichte der chemischen Elemente. Urania-Verlag, Leipzig · Jena · Berlin 1979, keine ISBN, S. 67.
- ↑ a b c d e f g h i j k l P. Häussinger, R. Glatthaar, W. Rhode, H. Kick, C. Benkmann, J. Weber, H.-J. Wunschel, V. Stenke, E. Leicht, H. Stenger: Noble Gases. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2006 (doi:10.1002/14356007.a17_485).
- ↑ a b c d e A. G. M. Ferreira, L. Q. Lobo: On the vapour pressure of radon. In: The Journal of Chemical Thermodynamics. 2007, 39, 10, S. 1404–1406, doi:10.1016/j.jct.2007.03.017
- ↑ Allen, Leland C. (1989). „Electronegativity is the average one-electron energy of the valence-shell electrons in ground-state free atoms”. Journal of the American Chemical Society 111 (25), 9003–9014. o. DOI:10.1021/ja00207a003.
- ↑ K. Schubert: Ein Modell für die Kristallstrukturen der chemischen Elemente. In: Acta Crystallographica. 1974, 30, S. 193–204, doi:10.1107/S0567740874002469.
- ↑ A. V. Grosse: Some physical and chemical properties of element 118 (Eka-Em) and element 86 (Em). In: Journal of Inorganic and Nuclear Chemistry. 1965, 27, 3, S. 509–519, doi:10.1016/0022-1902(65)80255-X.
- ↑ a b Holloway, John H.. Noble-Gas Chemistry. London: Methuen (1968). ISBN 0-416-03270-2
- ↑ Greenwood 1997, p. 893
- ↑ Pauling, L. (1961. november 1.). „A molecular theory of general anesthesia”. Science 134 (3471), 15–21. o. DOI:10.1126/science.134.3471.15. PMID 13733483. Reprinted as szerk.: Linus Pauling, Barclay Kamb: Linus Pauling: Selected Scientific Papers. World Scientific, 1328–1334. o. (2001. november 1.). ISBN 981-02-2940-2
- ↑ Henderson, W.. Main group chemistry. Great Britain: Royal Society of Chemistry, 148. o. (2000. november 1.). ISBN 0-85404-617-8
- ↑ Ikeda, Tomoko (2000. november 23.). „Distortion of Host Lattice in Clathrate Hydrate as a Function of Guest Molecule and Temperature”. Journal of Physical Chemistry A 104 (46), 10623–10630. o. DOI:10.1021/jp001313j.
- ↑ M. Saunders, H. A. Jiménez-Vázquez, R. J. Cross, R. J. Poreda (1993). „Stable compounds of helium and neon. He@C60 and Ne@C60”. Science 259 (5100), 1428–1430. o. DOI:10.1126/science.259.5100.1428. PMID 17801275.
- ↑ Martin Saunders, Hugo A. Jimenez-Vazquez, R. James Cross (1994). „Incorporation of helium, neon, argon, krypton, and xenon into fullerenes using high pressure”. J. Am. Chem. Soc. 116 (5), 2193–2194. o. DOI:10.1021/ja00084a089.
- ↑ Moody, G. J. (1974). „A Decade of Xenon Chemistry”. Journal of Chemical Education 51 (10), 628–630. o. DOI:10.1021/ed051p628. (Hozzáférés: 2007. október 16.)
- ↑ Graham, L. (2000). „Concerning the nature of XePtF6”. Coordination Chemistry Reviews 197, 321–334. o. DOI:10.1016/S0010-8545(99)00190-3.
- ↑ a b c d Greenwood 1997
- ↑ Marko Zupan, Jernej Iskra, Stojan Stavber (1998). „Fluorination with XeF2. 44. Effect of Geometry and Heteroatom on the Regioselectivity of Fluorine Introduction into an Aromatic Ring”. J. Org. Chem 63 (3), 878–880. o. DOI:10.1021/jo971496e. PMID 11672087.
- ↑ a b c d e f Grochala, Wojciech (2007). „Atypical compounds of gases, which have been called noble”. Chemical Society Reviews 36 (10), 1632–1655. o. DOI:10.1039/b702109g. PMID 17721587.
- ↑ Harding 2002, pp. 90–99
- ↑ Avrorin, V. V.; Krasikova, R. N.; Nefedov, V. D.; Toropova, M. A. (1982). „The Chemistry of Radon”. Russian Chemical Review 51 (1), 12–20. o. DOI:10.1070/RC1982v051n01ABEH002787.
- ↑ Lehmann, J (2002). „The chemistry of krypton”. Coordination Chemistry Reviews 233–234, 1–39. o. DOI:10.1016/S0010-8545(02)00202-3.
- ↑ Hogness, T. R.; Lunn, E. G. (1925). „The Ionization of Hydrogen by Electron Impact as Interpreted by Positive Ray Analysis”. Physical Review 26, 44–55. o. DOI:10.1103/PhysRev.26.44.
- ↑ Fernandez, J.; Martin, F. (2007). „Photoionization of the HeH2+ molecular ion”. J. Phys. B: At. Mol. Opt. Phys 40 (12), 2471–2480. o. DOI:10.1088/0953-4075/40/12/020.
- ↑ Weiss, Achim: Elements of the past: Big Bang Nucleosynthesis and observation. Max Planck Institute for Gravitational Physics. [2007. február 8-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. június 23.)
- ↑ Coc, A. (2004). „Updated Big Bang Nucleosynthesis confronted to WMAP observations and to the Abundance of Light Elements”. Astrophysical Journal 600 (2), 544–552. o. DOI:10.1086/380121.
- ↑ a b P. Morrison, J. Pine (1955). „Radiogenic Origin of the Helium Isotopes in Rock”. Annals of the New York Academy of Sciences 62 (3), 71–92. o. DOI:10.1111/j.1749-6632.1955.tb35366.x.
- ↑ Scherer, Alexandra: 40Ar/39Ar dating and errors. Technische Universität Bergakademie Freiberg, 2007. január 16. [2007. október 14-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. június 26.)
- ↑ Chrystèle Sanloup, C. Burkhard, Eva Maria Chamorro Schmidt, Albert Perez, et al. (2005). „Retention of Xenon in Quartz and Earth's Missing Xenon”. Science 310 (5751), 1174–1177. o. DOI:10.1126/science.1119070. PMID 16293758.
- ↑ Tyler Irving: Xenon Dioxide May Solve One of Earth's Mysteries. L’Actualité chimique canadienne (Canadian Chemical News), 2011. május 1. [2013. február 9-i dátummal az eredetiből archiválva]. (Hozzáférés: 2012. május 18.)
- ↑ A Citizen's Guide to Radon. U.S. Environmental Protection Agency, 2007. november 26. (Hozzáférés: 2008. június 26.)
- ↑ Lodders, Katharina (2003. július 10.). „Solar System Abundances and Condensation Temperatures of the Elements” (PDF). The Astrophysical Journal 591 (2), 1220–1247. o, Kiadó: The American Astronomical Society. [2015. november 7-i dátummal az eredetiből archiválva]. DOI:10.1086/375492. (Hozzáférés: 2017. március 12.)
- ↑ The Atmosphere. National Weather Service. (Hozzáférés: 2008. június 1.)
- ↑ a b Hwang, Shuen-Chen; Lein, Robert D.; Morgan, Daniel A.. Noble Gases, Kirk Othmer Encyclopedia of Chemical Technology. Wiley, 343–383. o.. DOI: 10.1002/0471238961.0701190508230114.a01 (2005)
- ↑ Winter, Mark: Helium: the essentials. University of Sheffield, 2008. (Hozzáférés: 2008. július 14.)
- ↑ Neon, Encarta (2008)
- ↑ Zhang, C. J.; Zhou, X. T.; Yang, L. (1992). „Demountable coaxial gas-cooled current leads for MRI superconducting magnets”. Magnetics, IEEE Transactions on 28 (1), 957–959. o, Kiadó: IEEE. DOI:10.1109/20.120038.
- ↑ Heat of Vaporization of the elements (angol nyelven). (Hozzáférés: 2017. április 7.)
- ↑ Fowler, B (1985). „Effects of inert gas narcosis on behavior—a critical review”. Undersea Biomed. Res. 12 (4), 369–402. o. [2010. december 25-i dátummal az eredetiből archiválva]. ISSN 0093-5387. PMID 4082343. (Hozzáférés: 2008. április 8.)
- ↑ Bennett 1998, p. 176
- ↑ Vann, R. D. (ed) (1989). „The Physiological Basis of Decompression”. 38th Undersea and Hyperbaric Medical Society Workshop 75(Phys)6-1-89, 437. o. [2010. január 5-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. május 31.)
- ↑ „Disaster Ascribed to Gas by Experts”, The New York Times, 1937. május 7., 1. oldal
- ↑ Freudenrich, Craig: How Blimps Work. HowStuffWorks, 2008. (Hozzáférés: 2008. július 3.)
- ↑ Dunkin, I. R. (1980). „The matrix isolation technique and its application to organic chemistry”. Chem. Soc. Rev. 9, 1–23. o. DOI:10.1039/CS9800900001.
- ↑ Basting, Dirk; Marowsky, Gerd. Excimer Laser Technology. Springer (2005). ISBN 3-540-20056-8
- ↑ Sanders, Robert D.; Ma, Daqing; Maze, Mervyn (2005). „Xenon: elemental anaesthesia in clinical practice”. British Medical Bulletin 71 (1), 115–135. o. DOI:10.1093/bmb/ldh034. PMID 15728132.
- ↑ Albert, M. S. (1998). „Development of hyperpolarized noble gas MRI”. Nuclear Instruments and Methods in Physics Research A 402 (2–3), 441–453. o. DOI:10.1016/S0168-9002(97)00888-7. PMID 11543065.
Fordítás
- Ez a szócikk részben vagy egészben a Noble gas című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Források
- Bennett, Peter B.. The Physiology and Medicine of Diving. SPCK Publishing (1998). ISBN 0-7020-2410-4
- Bobrow Test Preparation Services. CliffsAP Chemistry. CliffsNotes (2007. december 5.). ISBN 0-470-13500-X
- Greenwood, N. N.. Chemistry of the Elements, 2nd, Oxford:Butterworth-Heinemann (1997). ISBN 0-7506-3365-4
- Harding, Charlie J.. Elements of the P Block. Royal Society of Chemistry (2002). ISBN 0-85404-690-9
- Holloway, John H.. Noble-Gas Chemistry. London: Methuen Publishing (1968). ISBN 0-412-21100-9
- Mendeleev, D.. Osnovy Khimii (The Principles of Chemistry), 7th (orosz nyelven) (1903. november 1.)
- Ojima, Minoru. Noble Gas Geochemistry. Cambridge University Press (2002). ISBN 0-521-80366-7[halott link]
- Weinhold, F.. Valency and bonding. Cambridge University Press (2005). ISBN 0-521-83128-8
