Hármaspont

A hármaspont olyan hőmérséklet és nyomás, amely találkozási pontja három termodinamikai halmazállapotnak. Első megközelítésben ezek: a szilárd, a cseppfolyós és a légnemű. A Gibbs-féle fázistörvény írja le a fázisok, a komponensek és a szabadsági fokok számának összefüggését. Grafikai tekintetben a nyomás–hőmérséklet diagramon a halmazállapotokat (általánosabban fogalmazva: a fázisokat) vonalak választják el egymástól. Ha két fázis lenne, azokat egyetlen vonal választaná el egymástól. Tekintettel azonban arra, hogy három alapvető halmazállapot létezik, ezek szükségképpen egy pontban találkoznak.
A Gold Book értelmezése szerint valamennyi fázisátalakuláshoz rendelhető hármaspont. Példaképpen a kén módosulatait sorolja fel: a rombos és monoklin formák szilárd halmazállapotúak, de átalakulásuk hőmérsékleti és nyomásadatokkal írható le.[2][3]
A hármaspontok száma Nh kiszámítható a fázisok p számából:
Típusai[szerkesztés]
A kén hármaspontja 119 °C. Alacsonyabb hőmérsékleten szilárd halmazállapotban van, monoklin (β) kristályszerkezettel. Magasabb hőmérsékleten átmegy légnemű állapotba (gőz). Ha növekszik a nyomás, akkor az anyag átmegy cseppfolyós halmazállapotba. Van a kénnek más típusú hármaspontja is. 95,3 °C-on a monoklin kén átkristályosodik rombos formába. Itt tehát két szilárd és egy légnemű fázis találkozik. Magasabb nyomáson találunk egy további hármaspontot. 155 °C-on a kén lehet rombos, monoklin és cseppfolyós. Ezek a kén legismertebb fázisátalakulásait leíró jelenségek; a kénnek valójában 30-nál is több allotrop módosulata létezik. Ezeket görög betűkkel azonosítjuk, de a Young[1] közlemény eltérő jelölésmódot használ. Nem jelöli például a légnemű halmazállapotot (különlegessége, hogy még a légnemű halmazállapotnak is van két módosulata: S2 és S3). Alacsony hőmérsékleten túlhűtött folyadékként tárgyalják.[4] A kén hármaspontjának egyértelmű meghatározása bonyolult kérdés, mert különféle összetételű elegyként jelenik meg (S, S2, S3, S6, ciklusos stb.)[5] Jó minőségű fázisdiagram található Steven Zumdahl könyvében[6]
Az etil-alkoholnak több hármaspontja van.[7][8]
- 150 K: cseppfolyós–légnemű–szilárd (crystaline I)
- 127,5 K: crystaline II–folyadék
- 111,4 K: cystaline I–crystaline II (átkristályosodik). A crystaline II feltételezhetően az üvegesedési átmenet (glass transition)[9]
Butil-alkohol és más anyagok viselkedéséről filmfelvétel tekinthető meg a World News nevű szolgáltatónál,[10] illetve a youtube-on[11]
Hasonlóan többféle hármaspont jellemző a foszforra is. Például a foszfor hármaspontja 579°C, 44 bar. Ebben a pontban találkozik a fázisdiagramon a vörös foszfor, a fehér foszfor (mindkettő szilárd) a folyadékkal és a légnemű foszforral. Tehát a foszfor nem lehet cseppfolyós állapotú 579° alatti hőmérsékleten, de 44 bar nyomás alatt sem.
Termodinamikai állapotjelzők[szerkesztés]
A hagyományos nyomás–hőmérséklet diagramot kiegészítjük a harmadik állapotjelzővel. Ez a fajlagos térfogat (az ábrán: specific volume). Ezzel a gáztörvény valamennyi állapotjelzője értelmezhetővé válik. A szilárd halmazállapot (az ábrán: solid) térfogata a legkisebb. Olvadás közben az anyagok térfogata növekszik attól függően, hogy mekkora része olvadt már fel az anyagnak (az ábrán solid-liquid). A folyadékot ábrázoló területen (az ábrán: liquid) egy izotermát megrajzoltak. Ez függőleges a folyadékok összenyomhatatlansága miatt. Elérve a folyadék alsó határgörbét, elkezdődik a forrás, illetve párolgás (az ábrán: liquid-vapor). Attól függően, hogy az anyagnak mekkora része párolgott el, folyamatosan növekszik a térfogat. A felső határgörbét elérve telített gőzzé alakul. Ettől az állapottól jobbra (magasabb hőmérsékleten) az anyag gőz állapotban van (az ábrán: vapor). Gáznak csak akkor nevezzük, ha hőmérséklete magasabb a kritikus hőmérsékletnél. Az ábrán a gas felirat a kritikus izotermán szerepel.

A hármaspont (az ábrán: triple line) hőmérséklete alatt az anyag nem fordulhat elő cseppfolyós halmazállapotban. Ilyen körülmények között a szilárd anyag közvetlenül légnemű állapotba megy át. Ez a szublimáció. Attól függően, hogy az anyagnak mekkora része ment át légnemű állapotba, a térfogata nagy mértékben, arányosan növekszik (az ábrán: solid-vapor). A hármaspont hőmérséklete alatt a légnemű halmazállapotot gőznek nevezzük.
Triple Line[szerkesztés]
„Hármas vonal” – a magyar szakirodalom ezt a kifejezést nem használja, itt is csak tükörfordítása szerepel. Történeti előzménye a fázisdiagram, amely síkban ábrázolja a nyomás és a hőmérséklet adatait. A termodinamika számára viszont lényegessé vált annak a harmadik állapotjelzőnek a feltüntetése, amely az egyesített gáztörvény lényegi része: .
Ha ezt (a térfogatot) is tekintetbe vesszük, kiderül, hogy a hármaspont egyenessé bomlik, hiszen azonos nyomáson az anyag lehet akár szilárd, cseppfolyós és légnemű is, sőt: ezek elegye is. A vonal legkisebb térfogatú pontja általában a szilárd halmazállapot, legnagyobb térfogatú pontja a légnemű állapot. Halmazállapot változás közben (például szublimáció közben) az anyag folyamatosan növeli a térfogatát; a térfogat akár az ezerszeresére is növekedhet.
Ha a nyomást és a hőmérsékletet állapotjelzőként vesszük tekintetbe, intenzívként, akkor a térfogat számára is intenzív mennyiséget kell találnunk, amely független az anyagi mennyiségtől. Erre a célra két mennyiség áll rendelkezésünkre: a fajlagos térfogat (a térfogat és a tömeg hányadosa), illetve a moláris térfogat (a térfogat és az anyagmennyiség hányadosa). Moláris térfogatként itt most nem az ideális gáz elméleti térfogatát vesszük figyelembe, hanem az anyag aktuális, valóságos térfogatát.
Míg a hőmérséklet és a nyomás megadása meghatározatlan, a p V T (nyomás–térfogat–hőmérséklet) térben a termodinamikai állapot megadása egyértelmű és félreérthetetlen, még fázisátalakulások esetén is.
| Fajlagos és moláris térfogat a hármasponton | ||
| a víz adataival | m³/kg | m³/mol |
| szilárd | 0,0010908 | 1,965·10−5 |
| cseppfolyós | 0,001000 | 1,802·10−5 |
| légnemű | 205,9860 | 3,71090 |
| ideális gáz[* 1] | 205,9763 | 3,71072 |
Metrológiai fontossága[szerkesztés]
A hármaspont vonalának tulajdonságai:
- három jellemző pontja van: a szilárd, a cseppfolyós és a légnemű anyag fajlagos térfogata;
- a középső pont a folyadékállapot alsó határát jelöli ki;
- hőmérséklete csak egyetlen érték lehet, ettől bármilyen eltérés azt eredményezi, hogy a három halmazállapot valamelyike eltűnik;
- nem jósolható meg, hogy az anyagnak mekkora részaránya van szilárd, cseppfolyós, vagy légnemű állapotban; ezek mindegyike előfordul valamekkora mértékben. Tekintettel arra, hogy valamennyi fázisnak azonos a hőmérséklete, nincs hőáram, amely akár fagyást, olvadást, párolgást, vagy kondenzációt idézne elő.
Ezek a tulajdonságok teszik fontossá a hármaspont meghatározó készülékeket. Ezek közül legfontosabb a kelvin mértékegység kísérleti elrendezéssel történő definíciója: készülék, amelyben a víz mindhárom halmazállapotban jelen van (triple point cell),[12][13] hasonló szerepű, mint a gallium olvadáspont készülék.[14] Gallium hármaspont-meghatározó készülék működik a NIST-nél.[15]
Az Egyesült Királyság központi fizikai laboratóriumában (National Physical Laboratory) a higany hármaspont-meghatározó készülék mérési bizonytalansága 0,2 mK.[16] A mérés időtartama hat óra. Az Egyesült Államok mérésügyének hivatalos szerve, az American Society for Testing and Materials[17] a mintaelőkészítés módjától függően 0,05 mK mérési bizonytalanságot kínál. A NIST, illetve elődje, az amerikai Szabványügyi Hivatal, az NBS[18] oxigén hármaspont-meghatározó készüléket fejlesztett ki. A francia mérésügy jó eredményekkel végez méréseket a széndioxid hármaspont-meghatározó készülékkel.[19] A Pond Engineering argon hármaspont-meghatározó készülékének mérési bizonytalansága 0,5 mK.[20]
A víz hármaspontja[szerkesztés]
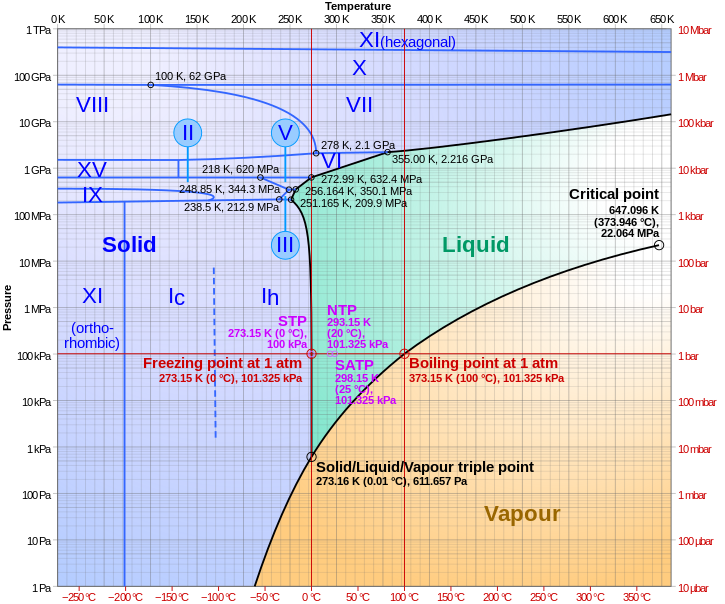
A víz hármaspontján a szilárd fázis Ih hexagonális kristályszerkezetű (az ábrán látható az Ic köbös változat is). Ennek fagyáspontja a hármasponton 0,01 °C, az atmoszferikus nyomáson 0 °C. Minimális fagyáspontja −21,965 °C, ahol JégIII tetragonális kristályszerkezetbe megy át. Jól megfigyelhető az ábrán, hogy a víz (hasonlóan más közegekhez) lehet szilárd halmazállapotú még a kritikus pont felett is. A víz esetén JégVII 15 GPa felett, JégX 62 GPa felett, és JégXI 500 GPa felett. A fázisátmenetek természetesen térfogatváltozással és hőközléssel járnak (izobár entrópiaváltozásként szokták számítani).[21]
A kritikus nyomás felett a szupersűrű folyadék helyezkedik el. Ha a nyomás is és a hőmérséklet is a kritikus pont felett van, az a szuperkritikus állapot tartománya.
A szuperkritikus víz[szerkesztés]
A víz 373 °C hőmérséklet és 220,6 bar nyomás fölött „szuperkritikussá” válik. Efölött a kritikus pont fölött nem nevezhető sem szilárdnak, sem folyadéknak, de gáz állapotúnak sem, leginkább „folyadékszerű gáz”-ként írható le. Ha a szuperkritikus víz szerves anyaggal érintkezik, felszakítja annak kémiai kötéseit, majd oxigén hatására reakció megy végbe, vagyis az anyag elég. Ez általában lángok nélkül történik. A reakció végén szén-dioxid és tiszta víz keletkezik, a más égések során keletkező káros melléktermékek nélkül.[22]
A folyamat jelentőségét az adja, hogy felhasználható szerves hulladékok, vagy szerves anyagokat is tartalmazó hulladékok, például szennyvíz környezetbarát megsemmisítésére.
A szuperkritikus víz tulajdonságainak vizsgálatával a Nemzetközi Űrállomás űrhajósai is foglalkoznak a japán kísérleti modulban (JEM). A francia űrügynökség, a CNES által kifejlesztett DECLIC nevű berendezés alkalmas a folyamat vizsgálatára mikrogravitációs környezetben (a gravitáció kiiktatásával a folyamat könnyebben kivitelezhető). Az egyetlen hátránya a folyamatnak, hogy a vízben lévő oldott sók könnyen kicsapódnak, amik a vízzel érintkező fémalkatrészek rozsdásodását okozzák.
A kísérletek az ISS-en 2013 júliusában kezdődtek, amiket nagyjából 2015 januárjáig terveztek befejezni.
Az Amerikai Haditengerészet néhány hadihajóját már felszerelte ilyen kísérleti berendezéssel, amit a gyakorlatban is használnak. Orlando városa szuperkritikus víz felhasználásával működő szennyvíztisztító építésébe kezdett (2014).[22][23]
Hármaspontok táblázata[szerkesztés]
A táblázat a három halmazállapot (szilárd, cseppfolyós, légnemű) érintkezési pontjának adatait tartalmazza. Az adatok legtöbbje a NIST Chemistry Webbook,[24] illetve jogelődje, az amerikai Szabványügyi Hivatal (National Bureau of Standards) közleményeiből származnak.[25]
| Név | T (K) | p (Pa) |
|---|---|---|
| Acetilén | 192,4 | 120 000 |
| Alumínium | 933,25 | |
| Ammónia | 195,40 | 6076 |
| Argon | 83,81 | 68 900 |
| Bután | 134,6 | 0,7 |
| Szén[26](grafit) | 4765 | 10 132 000 |
| Szén-dioxid | 216,55 | 517 000 |
| Szén-monoxid | 68,10 | 15 370 |
| Gallium | 302,92 | |
| Klór | 172,17 | 1390 |
| Kloroform | 175,43 | 870 |
| Hidrogén | 13,84 | 7 210 |
| Deutérium | 18,63 | 17 100 |
| Trícium | 20,62 | 21 600 |
| HD (deutérium-hidrid)[27] | 16,6 | 12 800 |
| Etán | 89,89 | 0,8 |
| Etanol | 150 | 0,43 × 10−3 |
| Etilén | 104,0 | 120 |
| Hangyasav | 281,40 | 2200 |
| Hélium-4 (lambda pont) | 2,19 | 5100 |
| Hexafluoretán R-116 | 173,08 | 26 600 |
| Hidrogén-klorid (vízmentes) | 158,96 | 13 900 |
| Jód[28] | 386,65 | 12 070 |
| Izobután R-600a | 113,55 | 1,9481 × 10−2 |
| Higany | 234,32 | 1,65 × 10−4 |
| Metán R-50 | 90,68 | 11 700 |
| Neon | 24,57 | 43 200 |
| Nitrogén-monoxid | 109,50 | 21 920 |
| Nitrogén | 63,18 | 12 600 |
| Dinitrogén-oxid | 182,34 | 87 850 |
| Oxigén | 54,36 | 152 |
| Palládium | 1825 | 3,5 |
| Platina | 2045 | 0,2 |
| Kén | 388,95 | 3,2 |
| Kén-dioxid | 197,69 | 1670 |
| Titán | 1941 | 5,3 |
| Urán-hexafluorid | 337,17 | 151 700 |
| Víz | 273,16 | 611,7 |
| Vas | 1811 | 3,63 |
| Xenon | 161,3 | 81 500 |
| Cink | 692,65 | 65 |
Megjegyzések[szerkesztés]
- ↑ Nem atmoszférikus, hanem 611 Pa nyomáson
Források[szerkesztés]
- ↑ a b David A. Young: Phase Diagrams of the Elements. Lawrence Livermore Laboratory, 1975. szeptember 11.
- ↑ IUPAC Gold Book - triple point. goldbook.iupac.org, 2012. [2013. június 1-i dátummal az eredetiből archiválva]. (Hozzáférés: 2012. június 4.)
- ↑ Triple point, A kémiai terminológia kompendiuma – Arany könyv (internetes kiadás). International Union of Pure and Applied Chemistry (1994)
- ↑ Eilene Theilig, NASA contractor: A primer on sulfur for the planetary geologist (pdf)
- ↑ szerk.: R. Streudel: Elemental Sulfurand Dulfur-Rich Compounds. Springer-Verlag. ISBN 3540401911 A könyv 114,5; illetve 119,3 °C-ot ad meg
- ↑ Zumdahl, Steven S.. Chemical Princiles. Houghton Miffin CompanyÄ id= ISBN 9780547004877 (2007) 842. oldal: a hármaspont 115,18 °C és 3,2 Pa
- ↑ Ethanol. webbook.nist.gov, 2012. (Hozzáférés: 2012. június 11.)
- ↑ Лебедев Б. В.; Николаев П. Н.; Рабинович И. Б.: Журн. физ. химии: Теплоемкость этиловых Н- и D- спиртов в интервале 80 - 250 К. lib.unn.ru, 1967. [2013. július 31-i dátummal az eredetiből archiválva]. (Hozzáférés: 2012. június 11.)
- ↑ TRT (Transition Temperature) of Ethanol. ddbonline.ddbst.de, 2012. [2016. március 4-i dátummal az eredetiből archiválva]. (Hozzáférés: 2012. június 11.) A méréseket adiabatikus vákuum-kaloriméterrel végezték
- ↑ Triple Point. wn.com, 2012. (Hozzáférés: 2012. június 7.)
- ↑ Triple Point Demo
- ↑ Thermometer and Temperature Calibration Using a Triple Point of Water. user.xmission.com, 2012. (Hozzáférés: 2012. június 6.)[halott link]
- ↑ National Metrology Institute of Japan: Temperature. nmij.jp, 2012. [2011. január 30-i dátummal az eredetiből archiválva]. (Hozzáférés: 2012. június 6.)
- ↑ Temperature Measurement Accuracy. seabird.com, 2001. [2010. december 17-i dátummal az eredetiből archiválva]. (Hozzáférés: 2012. június 6.)
- ↑ Magnum, B. W.; D. D. Thornton: met15-79.pdf Determination of the Triple Point Temperature of Gallium. nist.gov, 2012. (Hozzáférés: 2012. június 6.)
- ↑ Supply of temperature fixed-points and triple-point cells for the calibration of standard platinum resistance thermometers and thermocouples: National Physical Laboratory. npl.co.uk, 2012. [2012. augusztus 7-i dátummal az eredetiből archiválva]. (Hozzáférés: 2012. június 6.)
- ↑ ASTM E1750 - 10 Standard Guide for Use of Water Triple Point Cells. astm.org, 2012. (Hozzáférés: 2012. június 6.)
- ↑ George T. Furukawa (1986. Sptember-October). „The Triple Point of Oxygen in Seled Transportable Cells”. Journal of Research of the National Bureau of Standards 91 (5), 21. o. [2015. november 1-i dátummal az eredetiből archiválva]. (Hozzáférés: 2012. április 25.)
- ↑ Ahmed, Mohamed Gamal; Ali Khalid, Yves Hermier: Realisation and study of a CO2 triple point thermometric cell. metrologie-francaise.fr, 2007. (Hozzáférés: 2012. június 6.)
- ↑ Model K52 Argon Triple Point Cell and Maintenance System. pondengineering.com, 2005. [2015. október 17-i dátummal az eredetiből archiválva]. (Hozzáférés: 2012. június 6.) A közleményben látható a készülék szerkezeti felépítése
- ↑ Abascal, José L. F.; Eduardo Sanz, Carlos Vega: Triple points and coexistence properties of the dense phases of water calculated using computer simulation. cacharro.quim.ucm.es, 2009. [2012. június 14-i dátummal az eredetiből archiválva]. (Hozzáférés: 2012. június 7.)
- ↑ a b Starting Fire With Water (angol nyelven). NASA Science, 2014. január 10. (Hozzáférés: 2014. január 11.)
- ↑ Vízzel gyújtanak tüzet Archiválva 2014. január 11-i dátummal a Wayback Machine-ben 2014-01-09
- ↑ NIST Chemistry WebBook. webbook.nist.gov, 2012. (Hozzáférés: 2012. június 4.)
- ↑ Çengel, Yunus A., Robert H. Turner, John M.. Fundamentals of thermal-fluid sciences. Boston: McGraw-Hill, 78. o. (2012). ISBN 9780077422400
- ↑ Correa, A. Alfredo; Bonev, Stanimir A.; Galli, Giulia (2006. Jan). „Carbon under extreme conditions: phase boundaries and electronic properties from first-principles theory”. Proceedings of the National Academy of Sciences of the United States of America 103 (5), 1204–8. o. DOI:10.1073/pnas.0510489103. ISSN 0027-8424. PMID 16432191. A szén fémes állapotának hármaspontja 7400 K és 850 GPa
- ↑ Stróbl, Alajos: Hidrogénforrások és előállítáasi módszerek. e-met.hu, 2010. [2016. március 5-i dátummal az eredetiből archiválva]. (Hozzáférés: 2012. június 6.)
- ↑ Walas, S. M.. Chemical Process Equipment – Selection and Design. Amsterdam: Elsevier, 639. o. (1990). ISBN 0-7506-7510-1


