Metanol
| Metanol | |
 |

|
| IUPAC-név | Metanol |
| Más nevek | Metil-alkohol, faszesz, hidroximetán, karbinol |
| Kémiai azonosítók | |
|---|---|
| CAS-szám | 67-56-1 |
| RTECS szám | PC1400000 |
| Kémiai és fizikai tulajdonságok | |
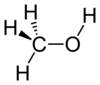
| Kémiai képlet | CH3OH |
| Moláris tömeg | 32,04 g/mol |
| Megjelenés | Színtelen folyadék |
| Sűrűség | 0,7918 g/cm³ |
| Olvadáspont | −97 °C |
| Forráspont | 64,7 °C |
| Oldhatóság (vízben) | Korlátlanul elegyedik |
| Viszkozitás | 0,59 mPa·s (20 °C-on) |
| Veszélyek | |
| EU osztályozás | |
| R mondatok | R11, R23/24/25, R39/23/24/25[1] |
| S mondatok | (S1/2), S7, S16, S36/37, S45[1] |
| Lobbanáspont | 11 °C |
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |
A metanol (metil-alkohol, faszesz, CH3OH) a legegyszerűbb telített alkohol (az alkoholok homológ sorának első tagja). A faszesz (triviális) elnevezés abból adódik, hogy korábban száraz fa lepárlásával állították elő, bár a faecet desztillálásával, függően a készülék minőségétől, metil-alkoholon kívül metil-acetát, aldehid és némi etil-alkohol is keletkezik.
Szótörténet[szerkesztés]
A metil szó a görög methu (μέθυ = bor) és hylé (ὕλη = fa, faanyag) összetétele. Az alkohol arab eredetű, lásd az alkoholok szócikkben. A metil-alkohol elnevezés Justus von Liebigtől származik.
A faszesz nevet Robert Boyle alkotta meg a görög/latin diaphorus spiritus lignorum kifejezésből, ami a fa száraz lepárlásakor keletkező folyadékot jelentette. Görögül diaphoros (διάφορος) sokféle, különböző. Spiritus latinul lélegzet, lélek. Lignum ugyancsak latinul fa.[2]
Fizikai tulajdonságai[szerkesztés]
Színtelen, jellegzetes szagú, (standard körülmények között) kis viszkozitású folyadék. Dipólus molekula, ezért vízzel jól elegyedik, maga is kiváló oldószer. Molekulája viszonylag kicsi. Könnyen összetéveszthető az etanollal, forráspontja azonban alacsonyabb az etanolénál.
Kémiai reakciói[szerkesztés]
- tökéletes égése
- 2 CH3OH + 3 O2 → 2CO2 + 4 H2O
- enyhe oxidációja során formaldehid keletkezik,
- erélyes oxidációja metánsav (hangyasav) képződéséhez vezet
Élettani hatása[szerkesztés]
Erősen mérgező, mert a szervezetben az alkohol-dehidrogenáz nevű enzim formaldehiddé alakítja, ami pedig komoly sejtméreg. Mivel könnyen összetéveszthető az etil-alkohollal, a denaturált szeszt (metanollal denaturált etil-alkoholt) alkoholos italok hamisítására is használják, ami rendkívül veszélyes a metil-alkohol májkárosító hatásai miatt és könnyen a fogyasztó halálához vezethet (50-75 g tiszta metanol elfogyasztása biztos halált okoz, de történt már haláleset 12 g elfogyasztása után is[3]), de még enyhébb mérgezés (a fenti dózis töredékének szervezetbe jutása) is okozhat teljes vakságot. A denaturált szeszt emiatt ma már gyakran kevésbé mérgező anyagokkal készítik, és az ízét is kellemetlenné teszik. (Érdekesség, hogy ha metil-alkohollal mérgezett beteggel etil-alkoholt itatnak elsősegélyként, akkor a beteg szervezete a két alkoholt párhuzamosan – ugyanazzal az enzimrendszerrel – kezdi bontani, így a formaldehid képződése lelassul, káros hatása mérséklődik.)
A metanol májkárosító hatása mellett veszélyes idegméreg is. A bőrön át is felszívódik, ezért hosszabb távon nem ajánlatos vele még a kezeket sem tisztítani.
Története[szerkesztés]
Az egyiptomiak halottaik bebalzsamozására fenyőfélék száraz desztillációjával kapott metanolos kátrányoldat, gyanták és egyéb adalékok keverékét használták.[4] Metanolt tisztán először Robert Boyle ír kémikus állított elő 1661-ben, puszpáng (Buxus sempervirens) száraz desztillációjával.
Felhasználása[szerkesztés]
A metanolt gyakran használják belső égésű motorok üzemanyagaként, a salakmotorok tisztán metanollal mennek.Különösen gyakori ilyen célú felhasználása különleges autóversenyeken, repülőmodellekben, de a bioetanol mellett a biometanol felhasználása is egyre inkább teret hódít magának egyes országokban. (Biometanolról akkor beszélhetünk, ha az üzemanyag alapanyaga fa, vagy valamilyen más mezőgazdasági termék, szerves anyag, vagy előállítása közvetlenül napenergiával, napelemmel és ahhoz kapcsolt metanol-cellával (DMFC) történik.) Hagyományos benzinmotorokban – módosításuk nélkül – csak 10–20% metanoltartalmú benzines üzemanyag-keverékek használhatóak, azonban a porlasztó beállítása nem túl nehéz, pl. a II. világháborúban a Wehrmacht 100%-os metanolt is használt Otto-motorokban.
Szintén használnak metanolt oldószerekben, valamint vízzel keverve fagyálló folyadékokban. Ilyen célú felhasználása azonban mérgező hatása miatt igen korlátozott.
A metanol leggyakoribb felhasználása azonban más vegyületek szintéziséhez, gyártásához mint alapanyag szolgál. Metanolból állítanak elő többek között formaldehidet, ecetsavat, dimetil-étert, metil-terc-butil-étert (MTBE), valamint különböző műanyagoknak, festékeknek stb. is az alapanyaga.
További felhasználási területe várható az üzemanyagcellák elterjedésével. Ezekben a metanol katalizátor segítségével ég el a levegő oxigénjében, és így közvetlenül (igen jó hatásfokkal) szolgáltat elektromos energiát, vagy – a cella irányközömbössége folytán – áram segítségével tömény szén-dioxidból és vízből metanol és oxigén állítható elő [US Patent No. 5,599,638; 5,928,806]. Várható ezen felhasználási mód elterjedése a hordozható elektromos készülékekben is, de a leglényegesebb felhasználási területe a napelemes áram tárolására szolgáló háztartási metanolcellák területén lesz, amelyekkel a teljes villamosenergia termelési-felhasználási rendszer környezetvédelmi szempontból tiszta (100%-ban CO2-kibocsátás-mentes és nagy mértékben kapcsolt hőfelhasználói) jellegűvé alakítható át a 2015-ös párizsi éghajlatvédelmi egyezménynek megfelelően.
Előállítása[szerkesztés]
Korábban a fa lepárlásával (pirolízissel és desztillálással) nyerték, de ma már legtöbbször szén-monoxidból és hidrogénből állítják elő katalizátor jelenlétében (a szén-monoxid és hidrogén gáz keverékét szintézisgáznak nevezzük, energiatakarékos előállítására lásd U. S. Pat. Appl. Publ. No.: US 2009/0014336 A1, filed jul. 11, 2008). Laboratóriumi előállítása lehetséges még klór-metán szubsztitúciós reakciójával (a klór-metánban a klórt hidroxi-csoportra cseréljük), még inkább észtereinek (pl. oxálsavas-dimetil-észter) lúgos hidrolízisével.
A metanolcellákban előállított metanol és szén-dioxid körforgásba szervezve képes tiszta technológia támogatására, ezért az így termelt metanol csak belső felhasználású (amennyi tömény szén-dioxidot lead az autós az áramszolgáltató metanolkútjánál, molárisan annyi metanolt vételezhet majd; amennyi metanolt lead a háztartás az áramszolgáltató gyűjtőkamionjának, molárisan annyi tömény szén-dioxidot kap helyette).
Jegyzetek[szerkesztés]
- ↑ a b c A metanol (ESIS)[halott link]
- ↑ Fülöp József: Rövid kémiai értelmező és etimológiai szótár. Celldömölk: Pauz–Westermann Könyvkiadó Kft. 1998. 98. o. ISBN 963 8334 96 7
- ↑ Kémia. [2016. március 4-i dátummal az eredetiből archiválva]. (Hozzáférés: 2018. november 18.)
- ↑ Johann Koller et al., Effective Mummification Compounds Used in Pharaonic Egypt: Reactivity on Bone Alkaline Phosphatase, Z. Naturforsch. 58b, 462-480 (2003)
Források[szerkesztés]
Kapcsolódó szócikkek[szerkesztés]
