„Sejtmag” változatai közötti eltérés
| [ellenőrzött változat] | [ellenőrzött változat] |
a Removing Link GA template (handled by wikidata) |
Nincs szerkesztési összefoglaló |
||
| 1. sor: | 1. sor: | ||
[[Image:HeLa Hoechst 33258.jpg|thumb|350px|right|[[Dezoxiribonukleinsav|DNS]]-hez kötődő [[Hoechst-festés|Hoechst-festékkel]] megfestett [[HeLa]] sejtek. A középső és jobboldali sejt [[Sejtciklus#Interfázis|interfázisban]] van, ezért sejtmagja diffúzan festődik, mag a baloldali éppen osztódik és [[Kromoszóma|kromoszómái]] kondenzáltak]] |
|||
[[Fájl:Diagram human cell nucleus hu.svg|right|320px|thumb|Az emberi sejtmag felépítése]] |
|||
{{Endomembrane system diagram}} |
|||
[[Fájl:NuclearPore crop hu.svg|thumb|right|320px|Magpórus keresztmetszete. 1. maghártya; 2. citoplazmatikus gyűrű; 3. küllők; 4. kosár; 5. filamentumok (elektronmikroszkópos felvételek alapján).]] |
|||
A '''sejtmag''' vagy '''nukleusz''' az [[Eukarióták|eukarióta]] [[sejt]]ekben megtalálható [[sejtszervecske]], mely a sejt [[genetika]]i anyagának legnagyobb részét tartalmazza. Két fő funkciója van: irányítani a [[citoplazma|citoplazmában]] zajló [[kémia]]i reakciókat és a [[sejtciklus|sejtosztódáshoz]] szükséges információkat tárolni. |
|||
A '''sejtmag''' ([[Latin nyelv|latinul]] ''nucleus'') kettős membránnal körülvett [[Sejtszervecske|organellum]] az [[Eukarióták|eukarióta]] [[Sejt|sejten]] belül. Elsődleges funkciója a sejt genetikai anyagának, a [[Kromoszóma|kromoszómáknak]] a tárolása és elkülönítése a [[Citoplazma|citoplazmától]], valamint a [[Gén|gének]] kifejeződésének szabályozása. Belső tartalmát a citoplazmától a [[maghártya]] - kettős lipidréteg - különíti el. Formáját a sejtmagváz, a nukleoszkeleton adja. |
|||
== Szerkezet == |
|||
A sejtmag átmérője 10 és 20 [[mikrométer (mértékegység)|mikrométer]] között váltakozhat. Dupla rétegű [[sejtmembrán|membrán]] veszi körül, melynek két rétege egymással néhol összeér, pórusokat hozva létre. Ezeken át zajlik a [[mag|magi transzport]], melynek fontos szerepe van a [[sejt]] működésében, hiszen az [[mRNS]]-ek a magban keletkeznek, de a citoplazmában szerelődnek össze, másrészt pedig a legtöbb kémiai reakció is a magon kívül zajlik. A külső membrán folyamatosan megy át a durva felszínű [[endoplazmatikus retikulum]]ba (DER), és [[riboszóma|riboszómák]] kapcsolódnak hozzá. A két membrán közötti teret [[mag|perinukleáris térnek]] nevezzük, mely pedig a DER terével folytonos. A magmembrán belülre néző oldalán számos filamentum látható, ezek hozzák létre a [[nukleáris lamina|nukleáris laminát]]. |
|||
A fehérjék, nukleinsavak és egyéb molekulák maghártyán való átjutása a bonyolult szerkezetű [[magpórus|magpórusokon]] keresztül történik és gondosan szabályozott folyamat. A sejtmagon belül más, membránnal elkülönített organellumok nincsenek, de belseje nem egyenletes, több, fehérjéből és RNS-ből álló szubnukleáris test is megfigyelhető; közülük legismertebb a [[Riboszóma|riboszómák]] összeállítását végző [[sejtmagvacska]] (nucleolus). |
|||
<!--[[Kép:nucleus_ER.png]] <br /> |
|||
Ábra a magról és az endoplazmás retikulumról.<br /> |
|||
(1) [[Magmembrán]]. (2) [[Riboszóma]]. (3) [[Nukleáris pórus]] komplexek. (4) [[Nukleolusz]] (magvacska).<br /> |
|||
(5) [[Kromatin]]. (6) Sejtmag. (7) [[Endoplazmatikus retikulum]]. (8) [[Magplazma]].<br /> |
|||
A teljes szerkezetet körülveszi a [[citoplazma]].<br />--> |
|||
==Felfedezése== |
|||
A sejtmagban elszórva találunk egy vagy néhány [[sejtszervecske|nukleoluszt]] (magvacskát), melyeket a [[mag|nukleoplazma]] nevű állomány vesz körül. A nukleoplazma folyékony, gélszerű állaggal rendelkezik (ilyen szempontból hasonlít a [[citoplazma|citoplazmára]], melyben számos vegyület van oldott állapotban. Ezen anyagok közé soroljuk a [[nukleinsav|nukleotid]] trifoszfátokat (például [[adenozin-trifoszfát|ATP]]), [[enzim]]eket, [[fehérje|fehérjéket]], [[transzkripció|transzkripciós faktorokat]]. Ezeken kívül találunk még egy rosthálózatot is, melyet [[mag|nukleáris mátrixnak]] nevezünk. |
|||
[[File:Leeuwenhoek1719RedBloodCells.jpg|thumb|left|upright=1.5|A sejtmagok legrégebbi ismert ábrázolása ([[Anton van Leeuwenhoek]], 1719)]] |
|||
[[Image:Flemming1882Tafel1Fig14.jpg|thumb|Szúnyog nyálmirigyének sejtje a benne lévő óriáskromoszómákkal ([[Walther Flemming]], 1882)]] |
|||
A sejtmag volt az első sejten belüli szervecske (organellum), amit felfedeztek. Az eddig ismert legrégebbi ábrázolása a mikroszkóp tökéletesítőjétől és az első mikrobiológustól, [[Anton van Leeuwenhoek]]-től származik, aki a lazac vörösvérsejtjeiben figyelt meg belső "űrt"<ref>Leeuwenhoek, A. van: Opera Omnia, seu Arcana Naturae ope exactissimorum Microscopiorum detecta, experimentis variis comprobata, Epistolis ad varios illustres viros. J. Arnold et Delphis, A. Beman, Lugdinum Batavorum 1719–1730. Cited after: Dieter Gerlach, Geschichte der Mikroskopie. Verlag Harry Deutsch, Frankfurt am Main, Germany, 2009. ISBN 978-3-8171-1781-9.</ref> (az emlősök vörösvértestjeitől eltérően a többi gerinces állat vérsejtjeinek van sejtmagjuk). 1804-ben [[Franz Bauer]] is leírta a sejtmagot<ref name="Harris">{{cite book | last =Harris | first =H | title =The Birth of the Cell | edition = | year =1999 | publisher =Yale University Press | location =New Haven | isbn =0-300-07384-4 }}</ref>, majd részletesebben 1831-ben a skót botanikus, [[Robert Brown (botanikus)|Robert Brown]] számolt be róla a [[Londoni Linné Társaság]] egyik ülésén. Brown orchideák virágjának külső sejtrétegében figyelt meg áttetsző különálló részt, melyet ő areolának vagy nucleusnak nevezett el<ref name="Robert Brown">{{cite journal | last = Brown | first = Robert | title = On the Organs and Mode of Fecundation of Orchidex and Asclepiadea | journal = Miscellaneous Botanical Works I | volume = | pages = 511–514 | year = 1866}}</ref>, de nem kötötte azt valamilyen sejtfunkcióhoz. 1838-ban a német [[Matthias Schleiden]] felvetette, hogy a sejtmag az új sejtek létrehozásában játszik szerepet és a citoblaszt (sejtépítő) elnevezést javasolta és azt állította, hogy sikerült megfigyelnie a "citoblasztok" körül csoportosuló kis sejteket. [[Franz Meyen]] határozottan ellenezte ezt az elképzelést, mert korábban leírta a sejtosztódást és nézete szerint sok sejtnek egyáltalán nem volt magja. Az újonnan, semmiből létrejövő sejtek elmélete [[Robert Remak]] (1852) és [[Rudolf Virchow]] (1855) eredményeinek is ellentmondott, akik szerint sejt csak sejtből jöhet létre (''Omnis cellula e cellula''). A sejtmag funkciója ekkor még ismeretlen maradt<ref name="Cremer">{{cite book | last =Cremer| first =Thomas | title =Von der Zellenlehre zur Chromosomentheorie | edition = | year =1985 | publisher =Springer Verlag | location =Berlin, Heidelberg, New York, Tokyo | isbn = 3-540-13987-7}} Online Version [http://www.t-cremer.de/main_de/cremer/personen/info_T_Cremer.htm#book here]</ref>. |
|||
1877-78-ban [[Oscar Hertwig]] több közleményben publikálta megfigyeléseit a [[Tengerisünök|tengeri sünök]] [[petesejt|petesejtjének]] megtermékenyüléséről. Kimutatta, hogy a spermium sejtmagja behatol a petesejtbe és ott egyesül annak sejtmagjával; emellett bebizonyította hogy az élőlények egyetlen, nukleusszal rendelkező sejtből fejlődnek ki. Ezzel ellentmondott [[Ernst Haeckel]] korábbi elméletének, miszerint az egyedfejlődés teljes mértékben megismétli a törzsfejlődési utat, beleértve azt, hogy a kiindulási sejt egy strukturálatlan masszából ("Urschleim") jön létre. Az elméletét ért támadások után Hertwig bebizonyította, hogy a sejtmagra a [[puhatestűek]] és [[kétéltűek]] megtermékenyülésénél is feltétlenül szükség van. [[Eduard Strasburger]] 1884-ben ugyanerre jutott a növények tanulmányozása során. Fokozatosan felismerték, hogy a sejtmag az öröklődésben játszik fontos szerepet. 1873-ban [[August Weismann]] kimondta, hogy az öröklődés során az apai és anyai ivarsejtek egyenlő jelentőséggel bírnak. Miután megfigyelték a [[Mitózis|mitózist]] és a 20. század elején újra felfedezték [[Gregor Mendel|Mendel]] törvényeit, egyértelművé vált, hogy a sejtmag a genetikai információk hordozója<ref name ="Cremer"/>. |
|||
== Genetikai anyag == |
|||
A [[genetika]]i anyag, a [[DNS (biológia)|DNS]] [[hiszton]] fehérjékkel alkotott komplexben, a [[kromatin]]ban található. A DNS egységekben, [[kromoszóma|kromoszómákban]] van jelen, melyeket pedig [[gén]]ekre és nem kódoló régiókra oszthatunk. |
|||
== |
==Felépítés== |
||
A sejtmag az állati sejt legnagyobb organelluma<ref name="Lodish">{{cite book | last = Lodish | first = H |author2=Berk A|author3=Matsudaira P|author4=Kaiser CA|author5=Krieger M|author6=Scott MP|author7=Zipursky SL|author8=Darnell J. | title = Molecular Cell Biology | publisher = WH Freeman | edition = 5th | year = 2004 | location = New York | isbn = 0-7167-2672-6}}</ref>. Az emlőssejt nukleuszának átmérője kb. 6 mikrométer és a sejt térfogatának 10%-át foglalja el<ref name="MBoC">{{cite book | year = 2002 | title = Molecular Biology of the Cell, Chapter 4, pages 191–234 | editor = Bruce Alberts, Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, Peter Walter | publisher = Garland Science | edition = 4th}}</ref>. Belsejét viszkózus folyadék, a magplazma (nukleoplazma vagy karioplazma) tölti ki, amelynek összetétele hasonló a [[Citoszol|citoszoléhoz]]<ref>{{cite journal |author=Clegg JS |title=Properties and metabolism of the aqueous cytoplasm and its boundaries |journal=Am. J. Physiol. |volume=246 |issue=2 Pt 2 |pages=R133–51 |date=February 1984 |pmid=6364846 |url=http://ajpregu.physiology.org/cgi/pmidlookup?view=reprint&pmid=6364846}}</ref>. Alakja többnyire gömbszerű, de számos szabálytalan sejtmagforma is ismert (korong, pálca, karéjozott, stb.). |
|||
===A maghártya és a magpórusok=== |
|||
* Elődi Pál: Biokémia (Akadémiai Kiadó, Budapest 1980) ISBN 963-05-1792-2 |
|||
* De Robertis E. D. P.– Nowinski W. W. – Saez A. S.: Sejtbiológia (Akadémiai Kiadó – Budapest 1970) |
|||
* Don W. Fawcett: An Atlas of Fine Structure THE CELL Its Organelles and Inclusions (W. B. Saunders Company,Philadelphia and London 1966) |
|||
* Eldra P. Solomon - Richard R. Schmidt - Peter J. Adragna: Human Anatomy & Physiology Ed. 2nd 1990 (Sunders College Publishing, Philadelphia) ISBN 0-03-011914-6 |
|||
* Törő Imre, Ed.: Az élet alapjai (Gondolat Kiadó, Budapest 1989) ISBN 963-282-181-5 |
|||
{| align="right" valign="top" |
|||
{{fő|Sejtszervecske}} |
|||
| [[Image:Diagram human cell nucleus.svg|thumb|280px|right|Eukarióta sejt magja. Látható a riboszómákkal telehintett külső maghártya, a DNS-tartalmú kromatin és a sejtmagvacska. A magot a nukleoplazma tölti ki]] |
|||
| [[Image:NuclearPore crop.svg|thumb|right|250px|Magpórus keresztmetszete. 1) maghártya 2) külső gyűrű 3) küllők 4) kosár 5) filamentumok]] |
|||
|} |
|||
A [[maghártya]] két, egymás mellett elhelyezkedő [[Sejtmembrán|sejtmembránból]], a külső és belső membránból áll, amelyeket egy 10-50 nanométeres rés választ el egymástól. A maghártya feladata, hogy elválassza a sejt genetikai anyagát, a kromoszómákat az őt körülvevő citoplazmától és megakadályozza a makromolekulák szabad átjárását a citoplazma és a nukleoplazma között<ref name="Paine">{{cite journal | author = Paine P, Moore L, Horowitz S | title = Nuclear envelope permeability | journal = Nature | volume = 254 | issue = 5496 | pages = 109–114 | year = 1975 | pmid = 1117994 | doi = 10.1038/254109a0 }}</ref>. A külső membrán közvetlenül kapcsolódik a durva felszínű [[Endoplazmatikus retikulum|endoplazmatikus retikulumhoz]] és hozzá hasonlóan [[Riboszóma|riboszómákkal]] van teleszórva<ref name="Paine" />. A két membrán közötti rés a perinukleáris űr és közvetlenül folytonos az endoplazmatikus retikulum belső terével. |
|||
== Lásd még == |
|||
A maghártyán keresztül történő transzport a [[magpórus|magpórusokon]] át zajlik. A pórusok bonyolult szerkezetű képződmények, amelyek 50 (élesztőben) vagy néhány száz (gerincesekben) fehérjéből tevődnek össze és atomsúlyuk eléri a 125 millió daltont. <ref name="Lodish" />. A pórus teljes átmérője 100 nm, de a tényleges tér, ahol a molekulák szabadon átdiffundálhatnak, alig 9 nm. Ezáltal a kis, vízoldékony vegyületek szabadon átjárnak, de a pórus meggátolja a nagy makromolekulák - [[Fehérje|fehérjék]], [[Nukleinsavak|nukleinsavak]] - irányítatlan közlekedését. A nagy molekulák aktív transzporttal kerülnek be a sejtmagba, vagy ki a sejtmagból. Egy átlagos emlőssejtmag felületén mintegy 3-4 ezer pórus található<ref name="Rhoades">{{cite book | year = 1996| title = Human Physiology | editor = Rodney Rhoades, Richard Pflanzer | publisher = Saunders College Publishing | chapter = Ch3 | edition = 3rd}}</ref>. A pórus egy nyolcszoros szimmetriájú, gyűrűszerű szerkezet, amely mellett a külső és belső membránok egybeolvadnak<ref name="Shulga">{{cite journal | author = Shulga N, Mosammaparast N, Wozniak R, Goldfarb D | title = Yeast nucleoporins involved in passive nuclear envelope permeability | journal = J Cell Biol | volume = 149 | issue = 5 | pages = 1027–1038 | year = 2000 | pmid = 10831607 | doi = 10.1083/jcb.149.5.1027 | pmc=2174828}}</ref>. A gyűrűhöz belülről (a nukleoplazma felől) egy kosárnak nevezett szerkezet kapcsolódik, míg a másik oldalon szálszerű filamentumok nyúlnak a citoplazmába. Mindkét struktúra a transzportfehérjék kötődésére szolgál<ref name="Lodish" />. |
|||
* [[Kromoszóma]] |
|||
* [[Kromatin]] |
|||
* [[Gén]] |
|||
* [[DNS (biológia)|DNS]] |
|||
* [[Sejtmembrán]] |
|||
A legtöbb fehérjét, riboszómaalegységet és egyes DNS-eket a [[karioferin|karioferinnek]] nevezett transzportproteinek viszik át a pórusokon. A sejtmagba befelé történő szállítást szabályozó karioferineket [[importin|importinnak]], a kifelé történőt [[exportin|exportinnak]] nevezzük. A legtöbb karioferin közvetlenül kapcsolódik a szállítmányához, bár bizonyos esetekben adaptor proteineket is használnak<ref name="Pemberton">{{cite journal | author = Pemberton L, Paschal B | title = Mechanisms of receptor-mediated nuclear import and nuclear export | journal = Traffic | volume = 6 | issue = 3 | pages = 187–198 | year = 2005 | pmid = 15702987 | doi = 10.1111/j.1600-0854.2005.00270.x }}</ref>. Az olyan lipidoldékony szteroidhormonok, mint a [[hidrokortizon]] vagy az [[aldoszteron]] képesek átdiffundálni a sejthártyán és a citoplazmában ún. [[nukleáris receptor|nukleáris receptorokhoz]] kötik meg őket, amelyek ezután aktív transzporttal a sejtmagba vándorolnak ahol a génkifejeződést szabályozzák: a hormonnal kapcsolódva serkentik, anélkül gátolják az adott gén átírását<ref name="Lodish"/>. |
|||
===Nukleáris lamina=== |
|||
Az állati sejtekben két, [[Intermedier filamentum|intermedier filamentumokból]] álló állványzat biztosítja a sejtmag alakjának megtartását. A [[nukleáris lamina]] a maghártya belső felén alkot jól szervezett hálózatot, míg a hártya külső, citoplazma felőli oldalán egy kevésbé sűrű filamentumegyüttes támasztja meg. Mindkét rendszer segít a maghártya alakjának megőrzésében és kapcsolódási pontokat nyújt a kromoszómáknak és a pórusoknak<ref name="MBoC" />. |
|||
A nukleáris lamina főleg a [[lamin]] fehérjéből áll. A többi proteinhez hasonlóan a lamin is a citoplazmában szintetizálódik, majd transzporttal bekerül a sejtmagba, ahol beépül a nukleáris lamina már meglévő hálózatába<ref name="Sturrman">{{cite journal | author = Stuurman N, Heins S, Aebi U | title = Nuclear lamins: their structure, assembly, and interactions | journal = J Struct Biol | volume = 122 | issue = 1–2 | pages = 42–66 | year = 1998 | pmid = 9724605 | doi = 10.1006/jsbi.1998.3987 }}</ref><ref name="Goldman">{{cite journal | author = Goldman A, Moir R, Montag-Lowy M, Stewart M, Goldman R | title = Pathway of incorporation of microinjected lamin A into the nuclear envelope | journal = J Cell Biol | volume = 119 | issue = 4 | pages = 725–735 | year = 1992 | pmid = 1429833 | doi = 10.1083/jcb.119.4.725 | pmc=2289687}}</ref>. A maghártya külső oldalára irányított laminok (pld. az [[emerin]] és a [[nesprin]]) a citoszkeletonhoz kapcsolódva rögzítik a sejtmagot. Laminokat a nukleoplazmában is találhatunk, ahol az ún. nukleoplazmatikus fátylat hozzák létre<ref name="RGoldman">{{cite journal | author = Goldman R, Gruenbaum Y, Moir R, Shumaker D, Spann T | title = Nuclear lamins: building blocks of nuclear architecture | doi = 10.1101/gad.960502| url=http://www.genesdev.org/cgi/content/full/16/5/533 | journal = Genes Dev | volume = 16 | issue = 5 | pages = 533–547 | year = 2002 | pmid = 11877373}}</ref>, amely [[Fluoreszcens mikroszkóp|fluoreszcens mikroszkópban]] jól megfigyelhető. A fátyol funkciója ismeretlen, de a sejtmagvacskában nincs jelen és a két sejtosztódás közötti interfázisban lehet megfigyelni<ref name="Moir">{{cite journal | author = Moir RD, Yoona M, Khuona S, Goldman RD. | title = Nuclear Lamins A and B1: Different Pathways of Assembly during Nuclear Envelope Formation in Living Cells | journal = Journal of Cell Biology | year = 2000 | volume = 151 | issue = 6 | pages = 1155–1168 | pmid = 11121432 | doi = 10.1083/jcb.151.6.1155 | pmc=2190592}}</ref>. A fátyol a kromoszómákhoz kapcsolódik és ha ezt a kötődést meggátoljuk, akkor a gének átírása megszűnik<ref name="Spann">{{cite journal | authors = Spann TP, Goldman AE, Wang C, Huang S, Goldman RD. | journal = Journal of Cell Biology | title = Alteration of nuclear lamin organization inhibits RNA polymerase II–dependent transcription | year = 2002 | volume = 156 | issue = 4 | pages = 603–608 | pmid = 11854306 | doi = 10.1083/jcb.200112047 | pmc=2174089}}</ref>. |
|||
A többi intermedier filamentumhoz hasonlóan a lamin alapegysége, fehérjemonomerje alfa-hélix szerkezetű. Két ilyen alegység egymás köré tekeredve alkot egy dimert, majd két dimer egymás mellett, fej-láb elhelyezkedéssel a protofilamentumnak nevezett tetramert hozza létre. Nyolc egymáshoz kapcsolódott protofilamentum alkotja a csavart, kötélszerű filamentumot, melynek hossza a kapcsolódó, illetve leváló alegységek miatt folyamatosan változhat<ref name="MBoC" />. |
|||
A lamin egyes mutációi elégtelen szálösszeálláshoz vezethetnek és a ritka, laminopátia nevű öröklődő betegségcsoportot okozzák. A legismertebb ilyen betegség a [[progeria]], amely a betegek korai, akár kisgyerekkori testi öregedésével jár. Nem teljesen ismert, hogy a biokémiai változások hogyan vezetnek az öregedés külső szimptómáihoz<ref name="Mounkes">{{cite journal |author=Mounkes LC, Stewart CL| title = Aging and nuclear organization: lamins and progeria | journal = Current Opinion in Cell Biology | year = 2004 | volume = 16 | pages = 322–327 | pmid = 15145358 | doi = 10.1016/j.ceb.2004.03.009 | issue=3}}</ref>. |
|||
===Kromoszómák=== |
|||
[[Image:MouseChromosomeTerritoriesBMC Cell Biol6-44Fig2e.jpg|thumb|200px|Egér fibroblaszt sejtmagja. A DNS-t kékre festették, míg a 2. kromoszómához vörös, a 9. kromoszómához pedig zöld fluoreszcens festék kötődik]] |
|||
A sejtmag tartalmazza a sejt genetikai információjának döntő többségét (valamennyi a [[Mitokondrium|mitokondriumokban]] és a növényi [[Kloroplasztisz|kloroplasztiszokban]] is található). Az információ hosszú, lineáris [[Dezoxiribonukleinsav|DNS]]-molekulákban van kódolva, melyek a kromoszómákat alkotják. Minden egyes kromoszóma egyetlen, hosszú DNS-szálat tartalmaz, illetve osztódáskor, amikor megduplázódik, akkor kettőt, ezek adják a [[kariotípus|kariotípusból]] ismert X-formát. Minden emberi sejt kb. két méternyi DNS-t tartalmaz. A kromoszóma anyaga a [[kromatin]], a DNS és a hozzá kapcsolódó szabályozó és struktúrfehérjék ([[Hiszton|hisztonok]]) együttese. |
|||
A kromatinnak két fajtája ismert. Az eukromatin lazább szerkezetű és azokat a géneket tartalmazza, amelyekre a sejtnek gyakran van szüksége, sokszor átír<ref name="Ehrenhofer">{{cite journal | author = Ehrenhofer-Murray A | title = Chromatin dynamics at DNA replication, transcription and repair | journal = Eur J Biochem | volume = 271 | issue = 12 | pages = 2335–2349 | year = 2004 | pmid = 15182349 | doi = 10.1111/j.1432-1033.2004.04162.x }}</ref>. A heterokromatin viszont jóval kompaktabb és a kevéssé használt DNS-szakaszok tartoznak hozzá. A heterokromatin további két részre osztható, a fakultatív heterokromatinra, amelynek génjeit időnként azért átírják (például a szervezet bizonyos fejlődési stádiumában), illetve az állandó heterokromatinra, amelyhez az olyan strukturális régiók tartoznak, mint a [[Telomer|telomerek]] és [[Centromer|centromerek]]<ref name="Grigoryev">{{cite journal | author = Grigoryev S, Bulynko Y, Popova E | title = The end adjusts the means: heterochromatin remodelling during terminal cell differentiation | journal = Chromosome Res | volume = 14 | issue = 1 | pages = 53–69 | year = 2006 | pmid = 16506096 | doi = 10.1007/s10577-005-1021-6 }}</ref>. Az [[Sejtciklus|interfázis]] alatt a fellazult, normál fénymikroszkópban nem látható kromoszómák adott "kromoszómaterületen" helyezkednek el<ref name="Schardin">{{cite journal | last = Schardin | first = Margit | authorlink = | title = Specific staining of human chromosomes in Chinese hamster x man hybrid cell lines demonstrates interphase chromosome territories | journal = Human Genetics | volume = 71 | issue = 4 | pages = 281–287 | publisher = Springer Berlin / Heidelberg |date=December 1985 | url = http://www.springerlink.com/content/lv101t8w17306071/ | doi = 10.1007/BF00388452 | pmid = 2416668 | last2 = Cremer | first2 = T | last3 = Hager | first3 = HD | last4 = Lang | first4 = M}}</ref> <ref name="Lamond">{{cite journal | last = Lamond | first = Angus I. |author2=William C. Earnshaw | title = Structure and Function in the Nucleus | journal = Science | volume = 280 | pages = 547–553 | date = 1998-04-24 | pmid =9554838 | doi = 10.1126/science.280.5363.547 | issue=5363}}</ref>. Az aktív, eukromatikus gének ilyenkor többnyire a terület határán találhatóak<ref name="Kurz">{{cite journal | last = Kurz | first = A | title = Active and inactive genes localize preferentially in the periphery of chromosome territories | doi = 10.1083/jcb.135.5.1195 | journal = The Journal of Cell Biology | volume = 135 | issue = 5| pages = 1195–1205 | publisher = The Rockefeller University Press | year = 1996 | url = http://intl.jcb.org/cgi/content/abstract/135/5/1195 | pmid =8947544 | last2 = Lampel | first2 = S | last3 = Nickolenko | first3 = JE | last4 = Bradl | first4 = J | last5 = Benner | first5 = A | last6 = Zirbel | first6 = RM | last7 = Cremer | first7 = T | last8 = Lichter | first8 = P | pmc = 2121085 }}</ref>. |
|||
Egyes [[Autoimmun betegség|autoimmun betegségekben]], mint a [[szisztémás lupus erythematodes|szisztémás lupus erythematodesben]], a kromatin alegységeihez, a [[nukleoszóma|nukleoszómákhoz]] kötődő ellenanyagok képződnek<ref name="Rothfield">{{cite journal | author = NF Rothfield, BD Stollar | title = The Relation of Immunoglobulin Class, Pattern of Antinuclear Antibody, and Complement-Fixing Antibodies to DNA in Sera from Patients with Systemic Lupus Erythematosus | journal = J Clin Invest | year = 1967 | volume = 46 | issue = 11 | pages = 1785–1794 | pmid = 4168731 | doi = 10.1172/JCI105669 | pmc = 292929 }}</ref>. Hasonló nukleáris ellenanyagokat [[Sclerosis multiplex|sclerosis multiplexben]] is megfigyeltek és kapcsolatba hozták az immunrendszer általános zavarával<ref name="Barned">{{cite journal | author = S Barned, AD Goodman, DH Mattson | title = Frequency of anti-nuclear antibodies in multiple sclerosis | journal = Neurology | year = 1995 | volume = 45 | issue = 2 | pages = 384–385 | pmid = 7854544 | doi = 10.1212/WNL.45.2.384}}</ref>. A progeriához hasonlóan, nem világos hogyan vezet az ellenanyagok termelődése a betegségek konkrét tüneteihez. |
|||
Bár korábban úgy gondolták, hogy az autoimmun betegségekben az [[autoantitest|autoantitestek]] nem képesek behatolni a sejtmagokba, újabban bizonyíték van ennek ellenkezőjére<ref>Böhm I. IgG deposits can be detected in cell nuclei of patients with both lupus erythematosus and malignancy. ''Clin Rheumatol'' 2007;26(11) 1877-1882</ref>. |
|||
===Sejtmagvacska=== |
|||
[[Image:Micrograph of a cell nucleus.png|thumb|left|200px|Sejtmag elektronmikroszkópos képe. Jól látszik a sötét nukleólusz]] |
|||
[[File:Blausen 0212 CellNucleus.png|thumb|A sejtmag szerkezete, középen a lila sejtmagvacskával]] |
|||
A [[sejtmagvacska]] vagy nukleólusz (nucleolus) egy különálló, sötéten festődő struktúra a sejtmagon belül. Nem veszi körül külön membrán is néha szuborganellumként emlegetik. A sejtmagvacska a kromoszómák [[riboszomális RNS]]-t (rRNS) kódoló régiói körül formálódik; ezek a gének nagyon sok példányban vannak jelen egymás mellett. A nukleólusz fő funkciója a riboszomális RNS szintézise és a [[Riboszóma|riboszómák]] összeállítása. Struktúrájának tömörsége aktivitásától függ, a riboszóma-összeszerelés fokozza a sejtmagvacska komponenseinek ideiglenes összekapcsolódását, amely még hatékonyabb riboszóma-készítéshez vezet. Megfigyelték, hogy ha inaktiválják az r-RNS-t, a sejtmagvacska struktúrái összekuszálódnak<ref name="Hernandez-Verdun">{{cite journal |
|||
| last = Hernandez-Verdun |
|||
| first = Daniele |
|||
| title = Nucleolus: from structure to dynamics |
|||
| journal =Histochem. Cell. Biol |
|||
| issue = 1–2 |
|||
| pages = 127–137 |
|||
| year = 2006 |
|||
| doi = 10.1007/s00418-005-0046-4 |
|||
| volume = 125 |
|||
| pmid = 16328431 }}</ref>. |
|||
A riboszóma-összeszerelés első lépéseként az [[RNS-polimeráz|RNS-polimeráz I]] a DNS-ről átírja az rRNS génjét, miáltal egy hosszú pre-rRNS keletkezik. Ennek feldarabolódásával jönnek létre az alegységek 5,8S, 18S és 28S rRNS-ei.<ref name="Lamond-Sleeman">{{cite journal |
|||
| last = Lamond |
|||
| first = Angus I. |
|||
|author2=Judith E. Sleeman |
|||
| title = Nuclear substructure and dynamics |
|||
| journal = current biology |
|||
| volume = 13 |
|||
| issue = 21 |
|||
| pages = R825–828 |
|||
| pmid = 14588256 |
|||
| accessdate = | doi = 10.1016/j.cub.2003.10.012 |
|||
| date=October 2003}}</ref>. Az átírás (transzkripció), feldarabolás és a riboszóma-alegységek összeállítása a sejtmagvacskában történik a kis nukleoláris RNS (snoRNS) segítségével. Utóbbiak részben a riboszómák funkcióihoz kapcsolódó gének [[Hírvivő RNS|mRNS]]-einek kivágott intronjaiból származnak. Az összeállított riboszóma-alegységek a legnagyobb struktúrák, amelyek átférnek a maghártya pórusain<ref name="Lodish" />. |
|||
[[Elektronmikroszkóp]] alatt a neukleóluszban három régió különböztethető meg. A legbelső fibrilláris centrumokat (FC) az elektrondenz fibrilláris komponens (''dense fibrillar component'', DFC) veszi körül, amelyet viszont a granuláris komponens (''granular component'', GC) határol. Az rRNS transzkripciója az FC régióban vagy at FC-DFC határon zajlik, így ha a sejt igénye megnő a riboszómákra, a sejtmagvacskában több FC-t lehet megfigyelni. A pre-rRNS szétvágása és utólagos módosítása a DFC-ben, a fehérjék hozzákapcsolása az alegységek elkészítéséhez pedig a GC-ben történik<ref name=Lamond-Sleeman />. |
|||
===További struktúrák=== |
|||
{| class="wikitable" style="float:right; font-size:100%; margin-left:15px;" |
|||
|- bgcolor="#efefef" |
|||
|+ '''Szubnukleáris struktúrák''' |
|||
|- bgcolor="#efefef" |
|||
! style="width: 120px" abbr="name" |'''Név''' |
|||
! style="width: 130px" abbr="diameter" |'''Átmérő''' |
|||
|- |
|||
| Cajal-testek || 0,2–2,0 µm || <ref name="Cioce">{{cite journal | author = Cioce M, Lamond A | title = Cajal bodies: a long history of discovery | journal = Annu Rev Cell Dev Biol | volume = 21 | issue = | pages = 105–131 | year = 2005| pmid = 16212489 | doi = 10.1146/annurev.cellbio.20.010403.103738 }}</ref> |
|||
|- |
|||
| PIKA || 5 µm || <ref name="Pollard">{{cite book |
|||
| last = Pollard |
|||
| first = Thomas D. |
|||
|author2=William C. Earnshaw |
|||
| title = Cell Biology |
|||
| publisher = Saunders |
|||
| year = 2004 |
|||
| location = Philadelphia |
|||
| isbn = 0-7216-3360-9}}</ref> |
|||
|- |
|||
| PML-testek || 0,2–1,0 µm || <ref name="Dundr">{{cite journal |
|||
| last = Dundr |
|||
| first = Miroslav |
|||
|author2=Tom Misteli |
|||
| title = Functional architecture in the cell nucleus |
|||
| journal = Biochem. J. |
|||
| issue = Pt 2 |
|||
| pages = 297–310 |
|||
| year = 2001 |
|||
| pmid = 11368755 |
|||
| volume=356 |
|||
| pmc=1221839 |
|||
| doi=10.1042/0264-6021:3560297 |
|||
}}</ref> |
|||
|- |
|||
| Parafoltok || 0,2–1,0 µm || <ref name="rtspara">{{cite interview |
|||
| last = Fox |
|||
| first = Archa |
|||
| interviewer = R. Sundby |
|||
| title =Paraspeckle Size |
|||
| city = E-mail Correspondence |
|||
| date = 2007-03-07 }}</ref> |
|||
|- |
|||
| Foltok || 20–25 nm || <ref name="Pollard" /> |
|||
|} |
|||
A sejtmagvacskán kívül a mag több kisebb, membránnal nem határolt testet tartalmaz. Ilyenek a [[Cajal-test|Cajal-testek]], az iker-spiráltestek, a polimorf interfázisbeli karioszomális halmaz (PIKA), a promielocitás leukémia (PML)-testek, a parafoltok és splicing-foltok. Sokukról nagyon kevés információ áll rendelkezésre, de egyértelművé teszik, hogy a nukleoplazma egyáltalán nem homogén, hanem funkcionális kisebb terekre oszlik<ref name="Dundr" />. |
|||
Egyes szubnukleáris struktúrák bizonyos betegségekben tűnnek fel. Miopathia nemalinica esetén kis pálcikaszerű testek jelennek meg a sejtmagban, ami feltehetően egy mutáció miatt megváltozott szerkezetű [[aktin]] vagy a [[citoszkeleton]] más fehérjéje<ref name="Goebel">{{cite journal | last =Goebel| first =H.H. |author2=I Warlow| date=January 1997 | title =Nemaline myopathy with intranuclear rods—intranuclear rod myopathy| journal =Neuromuscular Disorders | volume =7 | issue =1 | pages =13–19 | doi = 10.1016/S0960-8966(96)00404-X| pmid =9132135 | url = }}</ref>. |
|||
*'''Cajal-testek'''. Egy sejtmag átlagosan 1-10 Cajal-testnek vagy spiráltestnek nevezett kompakt struktúrát tartalmaz, melyek átmérője 0,2-2µm között változik, fajtól és sejttípustól függően<ref name="Cioce" />. Elektronmikroszkóp alatt gubancos fonalgombolyagnak látszanak<ref name="Pollard" /> és nagy mennyiségű coilin fehérjét tartalmaznak<ref name="MateraFrey">{{cite journal | author = Matera AG, Frey MA. | title = Coiled Bodies and Gems: Janus or Gemini? | journal = American Journal of Human Genetics | volume = 63 | issue = 2 | pages = 317–321 | year = 1998 | pmid = 9683623 | doi = 10.1086/301992 | pmc=1377332}}</ref>. A feladatuk a különböző RNS-ek ([[kis nukleoláris RNS]], [[kis nukleáris RNS]] és a [[hiszton]] mRNS) utólagos módosítása<ref name="Cioce" />. |
|||
A Cajal-testek mellett helyezkednek el az iker-spiráltestek (innen kapták a nevüket is), amelyeket mikroszkóp alatt nem is lehet megkülönböztetni tőlük<ref name="MateraFrey" />. A Cajal-testektől eltérően azonban nem tartalmaznak kis nukleáris ribonukleoproteint (snRP, a hírvivő RNS utólagos módosítását végzi); funkciójuk feltehetően az snRP szintézisének segítése a Cajal-testekben<ref name="Matera">{{cite journal |
|||
| last = Matera |
|||
| first = A. Gregory |
|||
| title = Of Coiled Bodies, Gems, and Salmon |
|||
| journal = [[Journal of Cellular Biochemistry]] |
|||
| issue = 2 |
|||
| pages = 181–192 |
|||
| year = 1998 |
|||
| pmid = 9671224 |
|||
| accessdate = | doi =10.1002/(sici)1097-4644(19980801)70:2<181::aid-jcb4>3.0.co;2-k |
|||
| volume=70}}</ref> though it has also been suggested from microscopy evidence that CBs and gems are different manifestations of the same structure.<ref name="MateraFrey" /> |
|||
*'''PIKA'''. A polimorf interfázisbeli karioszomális halmazokat (PIKA, vagy más néven RAFA-domén) először 1991-ben figyelték meg mikroszkóppal. Feladatuk ismeretlen, de valószínűleg nincs közük a DNS másolásához, átírásához vagy az RNS utólagos módosításához<ref name="Saunders">{{cite journal | author = Saunders WS, Cooke CA, Earnshaw WC | title = Compartmentalization within the nucleus: discovery of a novel subnuclear region. | journal = [[Journal of Cellular Biology]] | volume = 115 | issue = 4 | pages = 919–931 | year = 1991 | doi = 10.1083/jcb.115.4.919 }} PMID 1955462</ref>. Többnyire a PTF transzkripciós faktor (amely a kis nukleáris RNS, snRNS transzkripcióját segíti) halmazai közelében találhatóak<ref name="Pombo">{{cite journal | author = Pombo A, Cuello P, Schul W, Yoon J, Roeder R, Cook P, Murphy S | title = Regional and temporal specialization in the nucleus: a transcriptionally active nuclear domain rich in PTF, Oct1 and PIKA antigens associates with specific chromosomes early in the cell cycle | journal = The EMBO Journal| volume = 17 | issue = 6 | pages = 1768–1778 | year = 1998 | pmid = 9501098 | doi = 10.1093/emboj/17.6.1768 | pmc=1170524}}</ref>. |
|||
*'''PML-testek'''. A promielocitás leukémia-testek (PML-testek, más néven nukleáris domén 10 vagy Kremer-testek) a nukleoplazmában elszórtan található kerek, 0,1–1µm átmérőjű szerkezetek. Nevüket fő komponensükről a [[promielocitás leukémia protein|promielocitás leukémia proteinről]] kapták. Többnyire a Cajal-testek vagy spliceoszómák és egyéb hasonló struktúrák közelében láthatóak<ref name="Dundr"/>. A PML-testek feltehetően a sejtmag sok fontos funkciójában (DNS-másolás, transzkripció, génműködés-gátlás) van koordináló szerepe, melyet főleg SUMO-val (kis ubiquitin-szerő módosító protein) való összekapcsolással ér el. A PML-hiányos sejtek (amelyekben a génjüket mesterségesen kikapcsolták) nem fejlődnek és funkcionálnak normálisan, azaz feladatuk biztosan alapvető fontosságú. |
|||
* '''splicing-foltok''' (''splicing speckle'', más néven magfolt - ''nuclear speckle'' -, interkromatin granulumhalmaz, B-sznörposzóma<ref> |
|||
{{cite web |
|||
| title = Cellular component Nucleus speckle |
|||
| publisher = UniProt: UniProtKB |
|||
| url = http://www.uniprot.org/locations/SL-0186 |
|||
| accessdate = 2013-08-30}}</ref>). A splicing-foltok az emlőssejtek kromatinközi régiójában találhatóak és az mRNS utólagos módosítását, [[splicing]]-ját (ejtsd szplájszing) végző molekulák halmozódnak fel bennük. Fluoreszcens mikroszkóp alatt változó méretű és alakú, szabálytalan, pettyezett foltok; elektronmikroszkóppal szemcsés halmaznak látszanak. Szerkezetük és összetételük változó, RNS és fehérje-komponenseik gyakran más helyre vándorolnak, például aktívan átíródó génekhez. A foltok összetétele és elhelyezkedése a génexpresszió változásával összhangban változik<ref name="Handwerger">{{cite journal | last =Handwerger | first =Korie E. |author2=Joseph G. Gall | date=January 2006 | title =Subnuclear organelles: new insights into form and function | journal =TRENDS in Cell Biology | volume =16 | issue =1 | pages =19–26 | doi =10.1016/j.tcb.2005.11.005 | pmid = 16325406 }}</ref>. |
|||
*'''parafoltok''' (''paraspeckle''). A 2002-ben felfedezett parafoltok a kromatinközi térben található szabálytalan formájú alakzatok<ref name="para1">{{cite journal |author= Fox, Archa |year=2002|url=http://www.current-biology.com/content/article/abstract?uid=PIIS0960982201006327 |title=Paraspeckles:A Novel Nuclear Domain|journal=Current Biology |volume=12 |pages=13–25 |doi=10.1016/S0960-9822(01)00632-7 | pmid=11790299 | last2=Lam | first2=YW | last3=Leung | first3=AK | last4=Lyon | first4=CE | last5=Andersen | first5=J | last6=Mann | first6=M | last7=Lamond | first7=AI | issue=1}}</ref>. Először HeLa sejtekben mutatták ki őket, de azután észlelték valamennyi emberi sejttípusban, beleértve a laboratóriumban tenyésztett immortalizált sejtvonalakat is paraspeckles are now known to also exist in all human primary cells, transformed cell lines, and tissue sections.<ref name="para3">{{cite journal |author= Fox, A. |year= 2005 |url= http://www.molbiolcell.org/cgi/reprint/16/11/5304 |title= P54nrb Forms a Heterodimer with PSP1 That Localizes to Paraspeckles in an RNA-dependent Manner | doi = 10.1091/mbc.E05-06-0587 |journal= Molecular Biology of the Cell |volume=16 |pages=5304–5315 | pmid = 16148043 | pmc=1266428 | issue=11|display-authors=etal}}</ref>. Egy sejtmagban 10-30 van belőlük<ref name="para2">{{cite web |
|||
| last =Fox |
|||
| first =Archa |
|||
|author2=Wendy Bickmore |
|||
| title =Nuclear Compartments: Paraspeckles |
|||
| publisher = Nuclear Protein Database |
|||
| year = 2004 |
|||
| url =http://npd.hgu.mrc.ac.uk/compartments/paraspeckles.html |
|||
| accessdate = 2007-03-06 | archiveurl = http://web.archive.org/web/20060502134554/http://npd.hgu.mrc.ac.uk/compartments/paraspeckles.html| archivedate = May 2, 2006}}</ref>. Nevüket onnan kapták, hogy a splicing-foltok közelében, azokkal parallel módon helyezkednek el<ref name="para2"/>. Nagyságuk és elhelyezkedésük a sejt génexpressziójának függvényében változik. Létük az aktív génátírástól függ, ha a fehérjekódoló géneket átíró [[RNS-polimeráz|RNS-polimeráz II]] inaktív, akkor valamennyi parafolt eltűnik és fehérjekomponenseik a sejtmagvacskában tárolódnak. Ez a folyamat a sejtosztódás telofázisában is lezajlik, a génátírás ilyenkor is szünetel<ref name="para3"/>. |
|||
==Funkciója== |
|||
A sejtmag elválasztja a gének [[Transzkripció (biológia)|transzkripciójának]] helyét a fehérjeszintézistől, a [[Transzláció|transzlációtól]] és ezáltal a génszabályozásnak olyan lehetőségeit nyújtja, amire a [[Prokarióták|prokarióta]] sejtek nem képesek. A sejtmag fő feladata a génkifejeződés és a DNS-replikáció szabályozása a sejtciklus során. |
|||
===Génkifejeződés=== |
|||
[[File:Transcription label en.jpg||thumb|185px|left|Átíródó gének a ''Chironomus pallidivitatus'' légyfaj kromoszómáin]] |
|||
A gének kifejeződése [[Hírvivő RNS|mRNS]]-sé való átírásukkal indul, majd az mRNS sokféleképpen módosul és végül a riboszómákhoz kapcsolódva a transzláció révén fehérjék képződnek róla. Az utóbbi folyamat kivételével a többi tevékenység a sejtmagban zajlik<ref>{{cite book |title=Protein Synthesis and Ribosome Structure: Translating the Genome |last=Nierhaus |first=Knud H. |author2=Daniel N. Wilson |year=2004 |publisher=Wiley-VCH |isbn=3-527-30638-2 }}</ref>. A sejtmagban találhatóak a transzkripcióhoz közvetlenül és közvetve szükséges enzimek és az ezeket szabályzó [[transzkripciós faktor|transzkripciós faktorok]] is. Az enzimek közé tartoznak a [[helikáz|helikázok]], melyek szétcsavarják a kettős szálú DNS-t, az RNS-polimerázok, melyek az mRNS szintézisét végzik és a [[topoizomeráz|topoizomerázok]], amelyek a DNS széttekeredéséből származó fizikai feszültséget tüntetik el<ref>{{cite book |title=Genome Structure and Function: From Chromosomes Characterization to Genes Technology |last=Nicolini |first=Claudio A. |year=1997 |publisher=Springer |isbn=0-7923-4565-7 }}</ref>. |
|||
Az átírt mRNS többféleképpen módosítani kell, mielőtt "érett", transzlációra alkalmas lesz. Ezek közül a legfontosabbak az 5'cap ("sapka") és az adenozinokból álló poli(A) farok elhelyezése rajta, valamint a [[splicing]]. Az 5'cap-et a transzkripciós komplexhez tartozó enzim köti az mRNS-hez, a poli(A) farkat pedig közvetlenül az átírás után kapja meg. A splicing a [[spliceoszóma]] nevű komplexen belül zajlik és hosszú, sok [[Intron|intront]] tartalmazó mRNS-ek esetében már azelőtt elkezdődhet, hogy a transzkripció befejeződött<ref name="Lodish" />. Sok esetben a pre-mRNS-t többféleképpen állítják össze érett mRNS-sé, ez az ú. [[alternatív splicing]]; így keletkeznek például a rendkívül változatos ellenanyagok is. |
|||
===Kompartmentalizáció=== |
|||
A kompartmentalizáció a sejten belüli folyamatok fizikai elválasztását, különböző térrészekbe való elhelyezését jelenti. A maghártya elválasztja a genetikai anyagot a citoplazma többi részétől és lehetővé teszi, hogy attól elkülönülve kontrollálja a gének átírását. Az egyik általánosan elterjedt módszer szerint a megállítandó folyamat egyik közbenső molekuláját a sejtmagba traszportálják, ahol az transzkripciós faktorokhoz kötődve gátolja az adott reakciót katalizáló enzim génexpresszióját. Ilyen például a sejt energiaháztartásában alapvető [[glikolízis]]. Ennek első lépésében a [[hexokináz]] a [[Glükóz|glukózból]] [[glukóz-6-foszfát|glukóz-6-foszfátot]] generál, amiből pedig [[fruktóz-6-foszfát]] lesz. Ha az utóbbi koncentrációja túl magas, egy regulátor fehérje a sejtmagba viszi a hexokinázt<ref name="Lehninger">{{cite book | last =Lehninger | first =Albert L. |author2=Nelson, David L. |author3=Cox, Michael M. | title =Lehninger principles of biochemistry | edition =3rd | year =2000 | publisher =Worth Publishers | location =New York | isbn = 1-57259-931-6 }}</ref>, ahol az más proteinekkel olyan komplexumot formál, amely meggátolja a glikolízis enzimjeinek kifejeződését<ref name="Moreno">{{cite journal | author=Moreno F, Ahuatzi D, Riera A, Palomino CA, Herrero P. |year=2005 |title = Glucose sensing through the Hxk2-dependent signalling pathway. |journal=Biochem Soc Trans | volume = 33 | issue = 1 |pages = 265–268 | pmid = 15667322 | doi = 10.1042/BST0330265 }} PMID 15667322</ref>. |
|||
A génkifejeződést szabályozó transzkripciós faktorokat a sejt sokszor fizikailag elszeparálja a kromoszómáktól, hogy a minimális génátírást is megakadályozza. Ezek a faktorok csak akkor fejthetik ki működésüket, ha a megfelelő szignál aktiválja őket. Például a gyulladási folyamatokban szerepet játszó géneket aktiváló [[NF-κB]] faktor a citoplazmában található, amíg a sejt külső membránján lévő receptorokhoz nem csatlakozik valamilyen szignálmolekula (például a [[Tumor nekrózis faktor alfa|TNF-α]]), és a receptor aktiválja az NF-κB-t, amely ezután a rajta található [[nukleáris lokalizációs szignál]] révén a sejtmagba vándorol és megindítja a megfelelő gének transzkripcióját<ref name="MBoC" />. |
|||
A kompartmentalizáció tudja megakadályozni, hogy a génekről frissen átírt, módosítatlan pre-mRNS transzlációja azonnal megkezdődjék<ref name="Gorlich">{{cite journal | last = Görlich | first = Dirk |author2=Ulrike Kutay | title = Transport between the cell nucleus and the cytoplasm | journal = Ann. Rev. Cell Dev. Biol. | volume =15 | issue = 1 | pages = 607–660 | year = 1999 | pmid = 10611974 | doi = 10.1146/annurev.cellbio.15.1.607 }}</ref>. Az eukarióták génjeiben közbeszúrt szakaszok, intronok vannak, amelyeket el kell távolítani, mielőtt fehérjévé fordítanák át. A baktériumoknál a transzláció sokszor már ezelőtt elkezdődik, hogy a hírvivő RNS transzkripciója teljesen befejeződne, eukarióták esetében ez az intronok miatt hibás, használhatatlan fehérjék termelődéséhez vezetne. |
|||
===Nukleáris transzport=== |
|||
[[Image:RanGTPcycle.png|360px|Right|thumb|Makromolekulák aktív transzportja a pórusokon keresztül a GTP energiáját felhasználó Ran protein segítségével]] |
|||
A nagy molekulák mozgása a sejtmagba befelé és onnan kifelé szigorúan szabályozott és a pórusokon keresztül történik. Míg a kisméretű molekulák szabadon átjárhatnak<ref name="Watson">{{cite book | last = Watson | first = JD |author2=Baker TA|author3=Bell SP|author4=Gann A|author5=Levine M|author6=Losick R. | title = Molecular Biology of the Gene | publisher = Peason Benjamin Cummings; CSHL Press. | year = 2004 | edition = 5th | chapter = Ch9–10 | isbn = 0-8053-9603-9 }}</ref>, a fehérjék és nukleinsavak csak a [[karioferin|karioferinnek]] nevezett proteinhez kapcsolódva haladhatnak át a póruson. A befelé szállító karioferinek az importinok, a sejtmagból kifelé vivők az exportinok. A szállítandó fehérjén rövid aminosavszekvencia, ún. nukleáris lokalizációs szignál jelzi, hogy végcélja a sejtmag; ugyanez igaz a sejtmagból kiszállítandó polipeptidekre is. A póruson való átszállítás energiája [[guanozin-trifoszfát]] (GTP) hasításából származik, amit GTP-ázok végeznek. A nukleáris transzport legfontosabb GTP-áza a [[Ran (biológia)|Ran]] nevű protein. Az importinoknak a RanGTP komplexre ahhoz van szükségük, hogy elengedjék szállítmányukat, míg az exportinok esetében a kapcsolódás miatt elengedhetetlen a Ran jelenléte<ref name="Pemberton" />. |
|||
Nukleáris import esetén a citoplazmában található fehérjeszállítmányhoz odakötődik az importin és átviszi a póruson keresztül a magba. Odabent az importin a RanGTP segítségével leválasztja magáról a szállítmányt és visszatér a citoplazmába. Az exportálandó fehérjéhez az exportin köt hozzá a RanGTP energiája felhasználásával, átszállítja a póruson, leválik róla és visszatér a sejtmagba. |
|||
Az érett mRNS és [[Transzfer RNS|transzfer RNS]] (tRNS) kiszállítására külön exportproteinek specializálódtak. Ezek a sejten belüli "minőségellenőrző" rendszer részei, amely megakadályozza hogy a nem vagy csak részben érett mRNS a riboszómákhoz jusson. A rendszer a citoplazmába kijutó, nem teljesen módosított mRNS még azelőtt lebontja, hogy elkezdődhetne rajta a transzláció<ref name="Lodish" />. |
|||
==A sejtmag lebomlása és újjászerveződése== |
|||
[[File:Mitosis-fluorescent.jpg|thumb|left|230px|Fluoreszcens festékkel festett osztódó, metafázisban lévő sejt. Jól látható a zöld mitotikus orsó, amelynek szálai a halványkék kromoszómákhoz kapcsolódnak]] |
|||
A sejt [[Sejtciklus|életciklusának]] bizonyos szakaszaiban - a sejtosztódás és a programozott sejthalál, az [[apoptózis]] során a sejtmag megszűnik és az elkülönülését biztosító struktúrák, a maghártya és a nukleáris lamina tervezetten lebomlik. |
|||
A legtöbb sejtben a [[mitózis]] profázisának végén a mag membránjai szétesnek. Vannak kivételek, például egyes egysejtű eukarióták ([[Élesztőgomba|élesztő]]) ún. zárt mitózis révén osztódnak, amikor maghártyájuk épen marad. Ilyenkor a leánykromoszómák a sejtmag két ellenkező végére vándorolnak, majd a mag osztódik. A fejlettebb eukariótákra azonban a maghártya lebomlásával járó nyílt mitózis jellemző, ahol a leánykromoszómák a mitotikus orsó pólusaihoz mozognak és új sejtmag jön létre körülöttük. |
|||
A sejtosztódás után mindkét leánysejtnek teljes kromoszómakészletre van szüksége, azért a mitózis előtt a kromoszómák megkettőződnek, majd az osztódás során a [[mitotikus orsó]] fonalai (mikrotubulusai) hozzájuk kapcsolódnak és a leánykromoszómákat a sejt ellentétes végeibe, az orsó pólusához, a centroszómához húzzák. A legtöbb sejtben a centroszómák a magon kívül, a citoplazmában helyezkednek el, így ép maghártya esetén a mikrotubulusok nem férnének hozzá a kromoszómákhoz<ref name="Lippincott-Schwartz">{{cite journal | last = Lippincott-Schwartz | first = Jennifer | title = Cell biology: Ripping up the nuclear envelope | journal = Nature | volume = 416 | issue = 6876 | pages = 31–32 | date = 2002-03-07 | doi =10.1038/416031a | pmid = 11882878 }}</ref>. Emiatt a mitózis korai szakaszában, a profázisban kezdve és a prometafázisban bfejeződve, a sejtmagot körülvevő membránokat szétbontják<ref name="RGoldman" />. Ugyanekkor szétesik a nukleáris lamina is; ez a folyamat a laminfehérjék foszforilálásával jár<ref name="Boulikas">{{cite journal | author = Boulikas T | title = Phosphorylation of transcription factors and control of the cell cycle | journal = Crit Rev Eukaryot Gene Expr | volume = 5 | issue = 1 | pages = 1–77 | year = 1995 | pmid = 7549180}}</ref>. A sejtosztódás végén a maghártya újból összeáll, akárcsak az immár defoszforilált laminokból álló lamina<ref name="Boulikas" />. |
|||
A [[Páncélos ostorosok|dinoflagellátáknál]] a centroszóma szintén a citoplazmában van, azonban a maghártya ép marad és a kromoszómák [[Centromer|centromerjei]] beépülnek a sejtmag membránjába, hogy a mikrotubulusok hozzájuk kapcsolódhassanak (ún. extranukleáris orsó). Sok más egysejtűnél ([[csillósok]], [[Apicomplexa|sporozoák]], egyes gombák) a centroszómák a magon belül találhatóak és a mag nem bomlik fel a sejtosztódáskor. |
|||
Az [[apoptózis]] a sejt ellenőrzött, előre programozott pusztulása. Ennek során mélyreható változások történnek, a [[kromatin]] kondenzálódik, a maghártya és a lamina szétesik. A lamina hálózatának szétbontását a [[kaszpáz]] nevű proteázok (fehérjebontó enzimek) végzik, amelyek szétvágják a laminokat. A kaszpázaktikivitást laboratóriumi tesztekben a korai apoptózis kimutatására használják<ref name="RGoldman" />. Léteznek mutáns sejtvonalak, melyek laminja ellenálló a kaszpázokkal szemben, ezekben nem zajlik le a sejtmag apoptotikus bomlása<ref name="RGoldman" />. |
|||
A maghártya a [[Vírus|vírusok]] behatolását és meggátolja. Egyes vírusok szaporodásához a sejtmagban található proteinekre van szükség. Egyes DNS-vírusok (például a [[Herpeszvírus|herpeszvírusok]]) a sejtmagban szaporodnak és állítják össze új virionjaikat. Ezek úgy szabadulnak ki, hogy lebontják a belső laminát és a maghártyán át bimbózással távoznak, miközben annak egy darabját burokként magukkal viszik<ref name="RGoldman" />. |
|||
==Mag nélküli és többmagvú sejtek== |
|||
A sejteknek általában egy nukleuszuk van, de egy esetekben több is lehet, esetleg egy sem. Ez lehet előre tervezett folyamat eredménye (például az emlősök [[Vörösvértest|vörösvértestjei]]) vagy hibás sejtosztódás következménye.[[Image:redbloodcells.jpg|thumb|230px|right|Az ember vörösvértestjeinek nincs sejtmagvuk]] |
|||
A sejtmag nélküli sejtek nem képesek osztódni. Legismertebb példájuk az emlősök vörösvértestje (eritrocitája), amelyből az egyéb organellumok (pld. mitokondriumok) is hiányoznak és gyakorlatilag csak az oxigénszállító [[hemoglobin]] tartályául szolgálnak. Az eritrociták a vörös [[Csontvelő|csontvelőben]] való érésük során veszítik el magjukat, riboszómáikat és organellumaikat. A sejtmag akkor tűnik el, amikor a kiindulási eritroblasztból [[Csontvelő#A vörösvértest-képződés fejlődési alakjai|retikulocita]] (az érett vörösvértest prekurzora) lesz<ref name="Skutelsky">{{cite journal | last =Skutelsky | first =E. |author2=Danon D. | date =June 1970 | title =Comparative study of nuclear expulsion from the late erythroblast and cytokinesis | journal =J Cell Biol | issue =60(3) | pages =625–635 | pmid =5422968 | doi = 10.1016/0014-4827(70)90536-7 | volume=60}}</ref>. Egyes mutagének hatására éretlen, mikronukleusszal rendelkező eritrociták is kikerülhetnek a véráramba<ref name="Torous">{{cite journal | last =Torous | first =DK |author2=Dertinger SD|author3=Hall NE|author4=Tometsko CR. | date = | year =2000 | title =Enumeration of micronucleated reticulocytes in rat peripheral blood: a flow cytometric study | journal =Mutat Res | volume = 465| issue =465(1–2) | pages =91–99 | doi = 10.1016/S1383-5718(99)00216-8| pmid =10708974 | url = }}</ref><ref name="Hutter">{{cite journal | last =Hutter | first =KJ |author2=Stohr M. | year =1982 | title =Rapid detection of mutagen induced micronucleated erythrocytes by flow cytometry | journal =Histochemistry | volume =75 |issue=3 | pages =353–362 | pmid =7141888 | url = | doi = 10.1007/bf00496738}}</ref>. Mag nélküli sejtek hibás sejtosztódás során is keletkezhetnek, amikor az egyik leánysejtnek két sejtmagja lesz, a másiknak pedig egy sem. |
|||
Ezzel szemben a [[sugárállatkák]] [[Acantharea]] csoportjának tagjai<ref name="Zettler">{{cite journal | last =Zettler | first =LA |author2=Sogin ML|author3=Caron DA | date = | year =1997 | title =Phylogenetic relationships between the Acantharea and the Polycystinea: A molecular perspective on Haeckel's Radiolaria | journal =Proc Natl Acad Sci USA | volume =94 | issue=21 | pages =11411–11416 | pmid =9326623 | url = | doi = 10.1073/pnas.94.21.11411 | pmc=23483 }}</ref> és egyes mikorrhizás gombák több sejtmaggal is rendelkeznek sejtenként<ref name="Horton">{{cite journal | last =Horton | first =TR | year =2006 | title =The number of nuclei in basidiospores of 63 species of ectomycorrhizal Homobasidiomycetes | journal =Mycologia | volume =98 |issue=2 | pages =233–238 | pmid =16894968 | doi = 10.3852/mycologia.98.2.233}}</ref>. De a [[Giardia]] egysejtű bélparazitának is két magja van <ref>{{cite journal |author=Adam RD |title=The biology of Giardia spp |journal=Microbiol. Rev. |volume=55 |issue=4 |pages=706–32 |date=December 1991 |pmid=1779932 |pmc=372844 |url=http://mmbr.asm.org/cgi/pmidlookup?view=long&pmid=1779932}}</ref>. Az emberben a [[Izom#Vázizom/Harántcsikolt izom|harántcsíkolt izom]] sejtjei, a miociták összeolvadnak és [[Szincitium|szincíciumot]] alkotnak; eközben az eredeti sejtmagok megmaradnak<ref name="Lodish" />. Betegségek és kórképek kísérőjelensége is lehet a többmagvú sejtek megjelenése, például a [[gyulladás]] esetén időnként [[monocita|monociták]] és [[makrofág]]ok összeolvadásából származó óriás többmagvú sejtek figyelhetők meg<ref name="McInnes">{{cite journal | last =McInnes | first =A |author2=Rennick DM | date = | year =1988 | title =Interleukin 4 induces cultured monocytes/macrophages to form giant multinucleated cells | journal =J Exp Med | issue =2 | pages =598–611 | pmid =3258008 | doi =10.1084/jem.167.2.598 | volume=167 | pmc=2188835}}</ref> és tumorképződésben is előfordulhatnak<ref name="Goldring">{{cite journal | last =Goldring | first =SR |author2=Roelke MS|author3=Petrison KK|author4=Bhan AK | year =1987 | title =Human giant cell tumors of bone identification and characterization of cell types | journal =J Clin Invest | volume =79 |issue=2 | pages =483–491 | pmid =3027126 | doi = 10.1172/JCI112838 | pmc=424109}}</ref>. Bizonyos vírusok, például a [[HIV]] burokfehérjéi a sejtmembránba épülve a sejtek összeolvadását és sokmagvú szincíciumok kialakulását okozzák<ref>[Brynmor A. Watkins et al:http://vir.sgmjournals.org/content/78/10/2513.full.pdf Syncytium formation induced by human immunodeficiency virus type 1 isolates correlates with affinity for CD4] Journal of General Virology (1997), 78, 2513–2522</ref>. |
|||
A [[Páncélos ostorosok|dinoflagelláták]] egyes fajainak két sejtmagva van<ref name=Imanian2012>{{cite journal | last1 = Imanian | first1 = B | last2 = Pombert | first2 = JF | last3 = Dorrell | first3 = RG | last4 = Burki | first4 = F | last5 = Keeling | first5 = PJ | year = 2012 | title = Tertiary endosymbiosis in two dinotoms has generated little change in the mitochondrial genomes of their dinoflagellate hosts and diatom endosymbionts | url = | journal = PLOS ONE | volume = 7 | issue = 8| page = e43763 | doi=10.1371/journal.pone.0043763}}</ref>, azonban ezek genetikai anyaga különbözik: az egyik az eredeti sejtmag, a másik pedig a vele szimbiózisban élő [[Kovamoszatok|kovamoszaté]]. |
|||
==Evolúciója== |
|||
A sejtmag megléte az egyik alapvető különbség a prokarióták és eukarióták között és kialakulására négy jelentősebb elmélet is született, de általános elfogadottsággal egyik sem bír<ref name="Pennisi">{{cite journal | author = Pennisi E.| title = Evolutionary biology. The birth of the nucleus | doi = 10.1126/science.305.5685.766| journal = Science | volume = 305 | issue =5685 | pages = 766–768 | year =2004 | pmid = 15297641}}</ref>. |
|||
Az első, az ún. szintropikus modell szerint egy [[Archeák|archea]] (ősbaktérium) és egy baktérium [[Szimbiózis|szimbiózisából]] jött létre a magot tartalmazó eukarióta sejt<ref>C.Michael Hogan. 2010. [http://www.eoearth.org/article/Archaea?topic=49496 ''Archaea''. eds. E.Monosson & C.Cleveland, Encyclopedia of Earth. National Council for Science and the Environment, Washington DC.]</ref>. Az elképzelés szerint a mai [[Metanogén baktériumok|metánbaktériumokhoz]] hasonló archea belsejében parazita vagy szimbionta prokarióta (pl. [[myxobaktérium]]) élt és idővel teljes mértékben akalmazkodtak egymáshoz. Ez az elmélet analóg a [[Mitokondrium|mitokondriumok]] és [[Kloroplasztisz|kloroplasztiszok]] bakteriális eredetét hirdető, a szakértők által általánosan elismert teóriával<ref name="Margulis">{{cite book | author= Margulis, Lynn | year= 1981 | title= Symbiosis in Cell Evolution | pages=206–227 | publisher= W. H. Freeman and Company | location=San Francisco | isbn = 0-7167-1256-3}}</ref>. Az ősbaktériumi eredetet támogatja, hogy az eukarióták és archeák génjei (pl. a hisztongének) sok tekintetben hasonlóak. Hasonlóan, a myxobaktériumok is sok olyan tulajdonsággal rendelkeznek (soksejtű komplexumokat alkotnak, mozgékonyak, [[G-protein|G-proteinjeik]] és kinázaik az eukariótákéra hasonlítanak), amely az eukariótákra jellemző<ref name="Lopez-Garcia">{{cite journal | author = Lopez-Garcia P, Moreira D. | title = Selective forces for the origin of the eukaryotic nucleus | doi = 10.1002/bies.20413| journal = BioEssays | volume = 28 | issue =5 | pages = 525–533 | year =2006 | pmid = 16615090}}</ref>. |
|||
A második elmélet endoszimbionta állapot nélküli evolúciós átmenetet tételez fel. Például a [[Planctomycetes]] baktériumcsoportot hozzák fel, amely membránnal és primitív pórusokkal ellátott sejtmagszerű organellummal rendelkezik<ref name="Fuerst">{{cite journal | author =Fuerst JA. | title = Intracellular compartmentation in planctomycetes | journal = Annu Rev Microbiol. | volume = 59 | issue = | pages = 299–328 | year =2005 | pmid = 15910279 | doi = 10.1146/annurev.micro.59.030804.121258 }}</ref>. Egy hasonló elképzelés szerint a proto-eukarióta sejt [[fagocitózis|fagocitózissal]] kebelezte be az archeákat vagy baktériumokat és szerezte meg génjeiket<ref name="Hartman">{{cite journal | author =Hartman H, Fedorov A. | title = The origin of the eukaryotic cell: a genomic investigation | doi = 10.1073/pnas.032658599| journal = Proc Natl Acad Sci U S A. | volume = 99 | issue =3 | pages = 1420–1425 | year =2002 | pmid = 11805300 | pmc =122206 }}</ref> |
|||
A leginkább vitatott modell, a virális eukariogenezis szerint az eukarióták megkülönböztető sajátosságai, közte a membránnal elkülönített sejtmag, vírusfertőzés következményei. Az elmélet alapja az eukarióták és egyes vírusok közötti hasonlóságok: a lineáris kromoszómák, az [[Hírvivő RNS|mRNS]] 5'cap-ja, sapkája és a DNS csomagolását végző hisztonok analógiája a vírusok nukleoproteinjeivel. Az elmélet egyik verziója szerint a sejtmag a fagocitózissal párhuzamosan fejlődött ki és a korai eukarióták egysejtű ragadozók voltak<ref name="Bell">{{cite journal |author=Bell PJ |title=Viral eukaryogenesis: was the ancestor of the nucleus a complex DNA virus? |journal=J. Mol. Evol. |volume=53 |issue=3 |pages=251–6 |date=September 2001 |pmid=11523012 |doi=10.1007/s002390010215 |url=}}</ref>. Egy másik változat szerint az eukarióták [[himlővírus|himlővírussal]] fertőzött ősbaktériumtól erednek, aminek az adja az alapját hogy ezeknek a vírusoknak a [[DNS-polimeráz|DNS-polimeráza]] hasonlít az eukariótákéra<ref name="Takemura">{{cite journal | author = Takemura M | year = 2001 | title = Poxviruses and the origin of the eukaryotic nucleus | url = | journal = J Mol Evol | volume = 52 | issue = 5| pages = 419–425 | pmid = 11443345 | doi=10.1007/s002390010171}}</ref><ref name="Villareal">{{cite journal | author = Villarreal L, DeFilippis V | title = A hypothesis for DNA viruses as the origin of eukaryotic replication proteins | doi = 10.1128/JVI.74.15.7079-7084.2000| journal = J Virol | volume = 74 | issue = 15 | pages = 7079–7084 | year = 2000 | pmid = 10888648 | pmc = 112226}}</ref>. A víruseredetet megpróbálták az ivaros szaporodás tisztázatlan eredetének magyarazására is<ref name="Bell2">{{cite journal |author=Bell PJ |title=Sex and the eukaryotic cell cycle is consistent with a viral ancestry for the eukaryotic nucleus |journal=J. Theor. Biol. |volume=243 |issue=1 |pages=54–63 |date=November 2006 |pmid=16846615 |doi=10.1016/j.jtbi.2006.05.015 |url=}}</ref>. |
|||
A legújabb elmélet, az exomembrán-hipotézis szerint az eukarióták őse egy olyan archea volt, amely egy második membránt fejlesztett az eredeti köré, amelyikből a maghártya lett és addigi membránkötött struktúráiból kialakultak a pórusok, hogy lehetővé tegyék a belül szintetizált termékei - pl. riboszómák - külső transzportját<ref name="deRoos">{{cite journal | author = de Roos AD| title = The origin of the eukaryotic cell based on conservation of existing interfaces| journal = Artif Life | volume = 12 | issue = 4 | pages = 513–523. | year =2006 | pmid = 16953783 | doi = 10.1162/artl.2006.12.4.513 }}</ref>. |
|||
==Jegyzetek== |
|||
{{reflist|2}} |
|||
==Irodalom== |
|||
* {{cite journal |
|||
| last = Goldman |
|||
| first = Robert D. |
|||
| title = Nuclear lamins: building blocks of nuclear architecture |
|||
| journal = Genes & Dev. |
|||
| issue = 5 |
|||
| pages = 533–547 |
|||
| year = 2002 |
|||
| doi = 10.1101/gad.960502 |
|||
| volume = 16 |
|||
| pmid = 11877373 |
|||
| last2 = Gruenbaum |
|||
| first2 = Y |
|||
| last3 = Moir |
|||
| first3 = RD |
|||
| last4 = Shumaker |
|||
| first4 = DK |
|||
| last5 = Spann |
|||
| first5 = TP |
|||
}} |
|||
* {{cite journal | last = Görlich | first = Dirk | title = Transport between the cell nucleus and the cytoplasm | journal = Ann. Rev. Cell Dev. Biol. | volume = 15| issue = | pages = 607–660 | year = 1999 | pmid =10611974 | doi = 10.1146/annurev.cellbio.15.1.607 | last2 = Kutay | first2 = U }} |
|||
* {{cite journal | last = Lamond | first = Angus I. | title = Structure and Function in the Nucleus | journal = Science | volume = 280 | pages = 547–553 | date = 1998-04-24 | pmid =9554838 | doi = 10.1126/science.280.5363.547 | last2 = Earnshaw | first2 = WC | issue = 5363}} |
|||
* {{cite journal | author = Pennisi E.| title = Evolutionary biology. The birth of the nucleus | doi = 10.1126/science.305.5685.766| journal = Science | volume = 305 | issue =5685 | pages = 766–768 | year =2004 | pmid = 15297641}} |
|||
* {{cite book |
|||
| last = Pollard |
|||
| first = Thomas D. |
|||
|author2=William C. Earnshaw |
|||
| title = Cell Biology |
|||
| publisher = Saunders |
|||
| year = 2004 |
|||
| location = Philadelphia |
|||
| isbn = 0-7216-3360-9}} |
|||
{{fordítás|en|Cell nucleus|oldid=664071287}} |
|||
{{Sejtszervecskék}} |
|||
{{Commonscat|Cell nucleus}} |
{{Commonscat|Cell nucleus}} |
||
{{portál|orvostudomány|i }} |
{{portál|orvostudomány|i }} |
||
{{portál|biológia}} |
|||
[[Kategória:Sejtbiológia]] |
[[Kategória:Sejtbiológia]] |
||
[[Kategória:Sejtszervecskék]] |
|||
A lap 2015. május 29., 18:58-kori változata
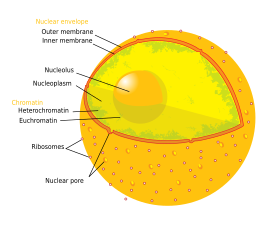
A sejtmag (latinul nucleus) kettős membránnal körülvett organellum az eukarióta sejten belül. Elsődleges funkciója a sejt genetikai anyagának, a kromoszómáknak a tárolása és elkülönítése a citoplazmától, valamint a gének kifejeződésének szabályozása. Belső tartalmát a citoplazmától a maghártya - kettős lipidréteg - különíti el. Formáját a sejtmagváz, a nukleoszkeleton adja.
A fehérjék, nukleinsavak és egyéb molekulák maghártyán való átjutása a bonyolult szerkezetű magpórusokon keresztül történik és gondosan szabályozott folyamat. A sejtmagon belül más, membránnal elkülönített organellumok nincsenek, de belseje nem egyenletes, több, fehérjéből és RNS-ből álló szubnukleáris test is megfigyelhető; közülük legismertebb a riboszómák összeállítását végző sejtmagvacska (nucleolus).
Felfedezése


A sejtmag volt az első sejten belüli szervecske (organellum), amit felfedeztek. Az eddig ismert legrégebbi ábrázolása a mikroszkóp tökéletesítőjétől és az első mikrobiológustól, Anton van Leeuwenhoek-től származik, aki a lazac vörösvérsejtjeiben figyelt meg belső "űrt"[1] (az emlősök vörösvértestjeitől eltérően a többi gerinces állat vérsejtjeinek van sejtmagjuk). 1804-ben Franz Bauer is leírta a sejtmagot[2], majd részletesebben 1831-ben a skót botanikus, Robert Brown számolt be róla a Londoni Linné Társaság egyik ülésén. Brown orchideák virágjának külső sejtrétegében figyelt meg áttetsző különálló részt, melyet ő areolának vagy nucleusnak nevezett el[3], de nem kötötte azt valamilyen sejtfunkcióhoz. 1838-ban a német Matthias Schleiden felvetette, hogy a sejtmag az új sejtek létrehozásában játszik szerepet és a citoblaszt (sejtépítő) elnevezést javasolta és azt állította, hogy sikerült megfigyelnie a "citoblasztok" körül csoportosuló kis sejteket. Franz Meyen határozottan ellenezte ezt az elképzelést, mert korábban leírta a sejtosztódást és nézete szerint sok sejtnek egyáltalán nem volt magja. Az újonnan, semmiből létrejövő sejtek elmélete Robert Remak (1852) és Rudolf Virchow (1855) eredményeinek is ellentmondott, akik szerint sejt csak sejtből jöhet létre (Omnis cellula e cellula). A sejtmag funkciója ekkor még ismeretlen maradt[4].
1877-78-ban Oscar Hertwig több közleményben publikálta megfigyeléseit a tengeri sünök petesejtjének megtermékenyüléséről. Kimutatta, hogy a spermium sejtmagja behatol a petesejtbe és ott egyesül annak sejtmagjával; emellett bebizonyította hogy az élőlények egyetlen, nukleusszal rendelkező sejtből fejlődnek ki. Ezzel ellentmondott Ernst Haeckel korábbi elméletének, miszerint az egyedfejlődés teljes mértékben megismétli a törzsfejlődési utat, beleértve azt, hogy a kiindulási sejt egy strukturálatlan masszából ("Urschleim") jön létre. Az elméletét ért támadások után Hertwig bebizonyította, hogy a sejtmagra a puhatestűek és kétéltűek megtermékenyülésénél is feltétlenül szükség van. Eduard Strasburger 1884-ben ugyanerre jutott a növények tanulmányozása során. Fokozatosan felismerték, hogy a sejtmag az öröklődésben játszik fontos szerepet. 1873-ban August Weismann kimondta, hogy az öröklődés során az apai és anyai ivarsejtek egyenlő jelentőséggel bírnak. Miután megfigyelték a mitózist és a 20. század elején újra felfedezték Mendel törvényeit, egyértelművé vált, hogy a sejtmag a genetikai információk hordozója[4].
Felépítés
A sejtmag az állati sejt legnagyobb organelluma[5]. Az emlőssejt nukleuszának átmérője kb. 6 mikrométer és a sejt térfogatának 10%-át foglalja el[6]. Belsejét viszkózus folyadék, a magplazma (nukleoplazma vagy karioplazma) tölti ki, amelynek összetétele hasonló a citoszoléhoz[7]. Alakja többnyire gömbszerű, de számos szabálytalan sejtmagforma is ismert (korong, pálca, karéjozott, stb.).
A maghártya és a magpórusok
A maghártya két, egymás mellett elhelyezkedő sejtmembránból, a külső és belső membránból áll, amelyeket egy 10-50 nanométeres rés választ el egymástól. A maghártya feladata, hogy elválassza a sejt genetikai anyagát, a kromoszómákat az őt körülvevő citoplazmától és megakadályozza a makromolekulák szabad átjárását a citoplazma és a nukleoplazma között[8]. A külső membrán közvetlenül kapcsolódik a durva felszínű endoplazmatikus retikulumhoz és hozzá hasonlóan riboszómákkal van teleszórva[8]. A két membrán közötti rés a perinukleáris űr és közvetlenül folytonos az endoplazmatikus retikulum belső terével.
A maghártyán keresztül történő transzport a magpórusokon át zajlik. A pórusok bonyolult szerkezetű képződmények, amelyek 50 (élesztőben) vagy néhány száz (gerincesekben) fehérjéből tevődnek össze és atomsúlyuk eléri a 125 millió daltont. [5]. A pórus teljes átmérője 100 nm, de a tényleges tér, ahol a molekulák szabadon átdiffundálhatnak, alig 9 nm. Ezáltal a kis, vízoldékony vegyületek szabadon átjárnak, de a pórus meggátolja a nagy makromolekulák - fehérjék, nukleinsavak - irányítatlan közlekedését. A nagy molekulák aktív transzporttal kerülnek be a sejtmagba, vagy ki a sejtmagból. Egy átlagos emlőssejtmag felületén mintegy 3-4 ezer pórus található[9]. A pórus egy nyolcszoros szimmetriájú, gyűrűszerű szerkezet, amely mellett a külső és belső membránok egybeolvadnak[10]. A gyűrűhöz belülről (a nukleoplazma felől) egy kosárnak nevezett szerkezet kapcsolódik, míg a másik oldalon szálszerű filamentumok nyúlnak a citoplazmába. Mindkét struktúra a transzportfehérjék kötődésére szolgál[5].
A legtöbb fehérjét, riboszómaalegységet és egyes DNS-eket a karioferinnek nevezett transzportproteinek viszik át a pórusokon. A sejtmagba befelé történő szállítást szabályozó karioferineket importinnak, a kifelé történőt exportinnak nevezzük. A legtöbb karioferin közvetlenül kapcsolódik a szállítmányához, bár bizonyos esetekben adaptor proteineket is használnak[11]. Az olyan lipidoldékony szteroidhormonok, mint a hidrokortizon vagy az aldoszteron képesek átdiffundálni a sejthártyán és a citoplazmában ún. nukleáris receptorokhoz kötik meg őket, amelyek ezután aktív transzporttal a sejtmagba vándorolnak ahol a génkifejeződést szabályozzák: a hormonnal kapcsolódva serkentik, anélkül gátolják az adott gén átírását[5].
Nukleáris lamina
Az állati sejtekben két, intermedier filamentumokból álló állványzat biztosítja a sejtmag alakjának megtartását. A nukleáris lamina a maghártya belső felén alkot jól szervezett hálózatot, míg a hártya külső, citoplazma felőli oldalán egy kevésbé sűrű filamentumegyüttes támasztja meg. Mindkét rendszer segít a maghártya alakjának megőrzésében és kapcsolódási pontokat nyújt a kromoszómáknak és a pórusoknak[6].
A nukleáris lamina főleg a lamin fehérjéből áll. A többi proteinhez hasonlóan a lamin is a citoplazmában szintetizálódik, majd transzporttal bekerül a sejtmagba, ahol beépül a nukleáris lamina már meglévő hálózatába[12][13]. A maghártya külső oldalára irányított laminok (pld. az emerin és a nesprin) a citoszkeletonhoz kapcsolódva rögzítik a sejtmagot. Laminokat a nukleoplazmában is találhatunk, ahol az ún. nukleoplazmatikus fátylat hozzák létre[14], amely fluoreszcens mikroszkópban jól megfigyelhető. A fátyol funkciója ismeretlen, de a sejtmagvacskában nincs jelen és a két sejtosztódás közötti interfázisban lehet megfigyelni[15]. A fátyol a kromoszómákhoz kapcsolódik és ha ezt a kötődést meggátoljuk, akkor a gének átírása megszűnik[16].
A többi intermedier filamentumhoz hasonlóan a lamin alapegysége, fehérjemonomerje alfa-hélix szerkezetű. Két ilyen alegység egymás köré tekeredve alkot egy dimert, majd két dimer egymás mellett, fej-láb elhelyezkedéssel a protofilamentumnak nevezett tetramert hozza létre. Nyolc egymáshoz kapcsolódott protofilamentum alkotja a csavart, kötélszerű filamentumot, melynek hossza a kapcsolódó, illetve leváló alegységek miatt folyamatosan változhat[6].
A lamin egyes mutációi elégtelen szálösszeálláshoz vezethetnek és a ritka, laminopátia nevű öröklődő betegségcsoportot okozzák. A legismertebb ilyen betegség a progeria, amely a betegek korai, akár kisgyerekkori testi öregedésével jár. Nem teljesen ismert, hogy a biokémiai változások hogyan vezetnek az öregedés külső szimptómáihoz[17].
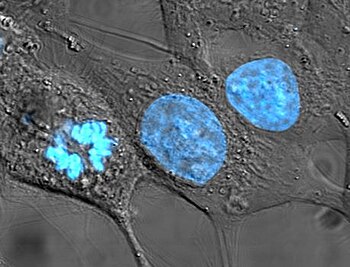
Kromoszómák

A sejtmag tartalmazza a sejt genetikai információjának döntő többségét (valamennyi a mitokondriumokban és a növényi kloroplasztiszokban is található). Az információ hosszú, lineáris DNS-molekulákban van kódolva, melyek a kromoszómákat alkotják. Minden egyes kromoszóma egyetlen, hosszú DNS-szálat tartalmaz, illetve osztódáskor, amikor megduplázódik, akkor kettőt, ezek adják a kariotípusból ismert X-formát. Minden emberi sejt kb. két méternyi DNS-t tartalmaz. A kromoszóma anyaga a kromatin, a DNS és a hozzá kapcsolódó szabályozó és struktúrfehérjék (hisztonok) együttese.
A kromatinnak két fajtája ismert. Az eukromatin lazább szerkezetű és azokat a géneket tartalmazza, amelyekre a sejtnek gyakran van szüksége, sokszor átír[18]. A heterokromatin viszont jóval kompaktabb és a kevéssé használt DNS-szakaszok tartoznak hozzá. A heterokromatin további két részre osztható, a fakultatív heterokromatinra, amelynek génjeit időnként azért átírják (például a szervezet bizonyos fejlődési stádiumában), illetve az állandó heterokromatinra, amelyhez az olyan strukturális régiók tartoznak, mint a telomerek és centromerek[19]. Az interfázis alatt a fellazult, normál fénymikroszkópban nem látható kromoszómák adott "kromoszómaterületen" helyezkednek el[20] [21]. Az aktív, eukromatikus gének ilyenkor többnyire a terület határán találhatóak[22].
Egyes autoimmun betegségekben, mint a szisztémás lupus erythematodesben, a kromatin alegységeihez, a nukleoszómákhoz kötődő ellenanyagok képződnek[23]. Hasonló nukleáris ellenanyagokat sclerosis multiplexben is megfigyeltek és kapcsolatba hozták az immunrendszer általános zavarával[24]. A progeriához hasonlóan, nem világos hogyan vezet az ellenanyagok termelődése a betegségek konkrét tüneteihez.
Bár korábban úgy gondolták, hogy az autoimmun betegségekben az autoantitestek nem képesek behatolni a sejtmagokba, újabban bizonyíték van ennek ellenkezőjére[25].
Sejtmagvacska


A sejtmagvacska vagy nukleólusz (nucleolus) egy különálló, sötéten festődő struktúra a sejtmagon belül. Nem veszi körül külön membrán is néha szuborganellumként emlegetik. A sejtmagvacska a kromoszómák riboszomális RNS-t (rRNS) kódoló régiói körül formálódik; ezek a gének nagyon sok példányban vannak jelen egymás mellett. A nukleólusz fő funkciója a riboszomális RNS szintézise és a riboszómák összeállítása. Struktúrájának tömörsége aktivitásától függ, a riboszóma-összeszerelés fokozza a sejtmagvacska komponenseinek ideiglenes összekapcsolódását, amely még hatékonyabb riboszóma-készítéshez vezet. Megfigyelték, hogy ha inaktiválják az r-RNS-t, a sejtmagvacska struktúrái összekuszálódnak[26].
A riboszóma-összeszerelés első lépéseként az RNS-polimeráz I a DNS-ről átírja az rRNS génjét, miáltal egy hosszú pre-rRNS keletkezik. Ennek feldarabolódásával jönnek létre az alegységek 5,8S, 18S és 28S rRNS-ei.[27]. Az átírás (transzkripció), feldarabolás és a riboszóma-alegységek összeállítása a sejtmagvacskában történik a kis nukleoláris RNS (snoRNS) segítségével. Utóbbiak részben a riboszómák funkcióihoz kapcsolódó gének mRNS-einek kivágott intronjaiból származnak. Az összeállított riboszóma-alegységek a legnagyobb struktúrák, amelyek átférnek a maghártya pórusain[5].
Elektronmikroszkóp alatt a neukleóluszban három régió különböztethető meg. A legbelső fibrilláris centrumokat (FC) az elektrondenz fibrilláris komponens (dense fibrillar component, DFC) veszi körül, amelyet viszont a granuláris komponens (granular component, GC) határol. Az rRNS transzkripciója az FC régióban vagy at FC-DFC határon zajlik, így ha a sejt igénye megnő a riboszómákra, a sejtmagvacskában több FC-t lehet megfigyelni. A pre-rRNS szétvágása és utólagos módosítása a DFC-ben, a fehérjék hozzákapcsolása az alegységek elkészítéséhez pedig a GC-ben történik[27].
További struktúrák
| Név | Átmérő | |
|---|---|---|
| Cajal-testek | 0,2–2,0 µm | [28] |
| PIKA | 5 µm | [29] |
| PML-testek | 0,2–1,0 µm | [30] |
| Parafoltok | 0,2–1,0 µm | [31] |
| Foltok | 20–25 nm | [29] |
A sejtmagvacskán kívül a mag több kisebb, membránnal nem határolt testet tartalmaz. Ilyenek a Cajal-testek, az iker-spiráltestek, a polimorf interfázisbeli karioszomális halmaz (PIKA), a promielocitás leukémia (PML)-testek, a parafoltok és splicing-foltok. Sokukról nagyon kevés információ áll rendelkezésre, de egyértelművé teszik, hogy a nukleoplazma egyáltalán nem homogén, hanem funkcionális kisebb terekre oszlik[30].
Egyes szubnukleáris struktúrák bizonyos betegségekben tűnnek fel. Miopathia nemalinica esetén kis pálcikaszerű testek jelennek meg a sejtmagban, ami feltehetően egy mutáció miatt megváltozott szerkezetű aktin vagy a citoszkeleton más fehérjéje[32].
- Cajal-testek. Egy sejtmag átlagosan 1-10 Cajal-testnek vagy spiráltestnek nevezett kompakt struktúrát tartalmaz, melyek átmérője 0,2-2µm között változik, fajtól és sejttípustól függően[28]. Elektronmikroszkóp alatt gubancos fonalgombolyagnak látszanak[29] és nagy mennyiségű coilin fehérjét tartalmaznak[33]. A feladatuk a különböző RNS-ek (kis nukleoláris RNS, kis nukleáris RNS és a hiszton mRNS) utólagos módosítása[28].
A Cajal-testek mellett helyezkednek el az iker-spiráltestek (innen kapták a nevüket is), amelyeket mikroszkóp alatt nem is lehet megkülönböztetni tőlük[33]. A Cajal-testektől eltérően azonban nem tartalmaznak kis nukleáris ribonukleoproteint (snRP, a hírvivő RNS utólagos módosítását végzi); funkciójuk feltehetően az snRP szintézisének segítése a Cajal-testekben[34] though it has also been suggested from microscopy evidence that CBs and gems are different manifestations of the same structure.[33]
- PIKA. A polimorf interfázisbeli karioszomális halmazokat (PIKA, vagy más néven RAFA-domén) először 1991-ben figyelték meg mikroszkóppal. Feladatuk ismeretlen, de valószínűleg nincs közük a DNS másolásához, átírásához vagy az RNS utólagos módosításához[35]. Többnyire a PTF transzkripciós faktor (amely a kis nukleáris RNS, snRNS transzkripcióját segíti) halmazai közelében találhatóak[36].
- PML-testek. A promielocitás leukémia-testek (PML-testek, más néven nukleáris domén 10 vagy Kremer-testek) a nukleoplazmában elszórtan található kerek, 0,1–1µm átmérőjű szerkezetek. Nevüket fő komponensükről a promielocitás leukémia proteinről kapták. Többnyire a Cajal-testek vagy spliceoszómák és egyéb hasonló struktúrák közelében láthatóak[30]. A PML-testek feltehetően a sejtmag sok fontos funkciójában (DNS-másolás, transzkripció, génműködés-gátlás) van koordináló szerepe, melyet főleg SUMO-val (kis ubiquitin-szerő módosító protein) való összekapcsolással ér el. A PML-hiányos sejtek (amelyekben a génjüket mesterségesen kikapcsolták) nem fejlődnek és funkcionálnak normálisan, azaz feladatuk biztosan alapvető fontosságú.
- splicing-foltok (splicing speckle, más néven magfolt - nuclear speckle -, interkromatin granulumhalmaz, B-sznörposzóma[37]). A splicing-foltok az emlőssejtek kromatinközi régiójában találhatóak és az mRNS utólagos módosítását, splicing-ját (ejtsd szplájszing) végző molekulák halmozódnak fel bennük. Fluoreszcens mikroszkóp alatt változó méretű és alakú, szabálytalan, pettyezett foltok; elektronmikroszkóppal szemcsés halmaznak látszanak. Szerkezetük és összetételük változó, RNS és fehérje-komponenseik gyakran más helyre vándorolnak, például aktívan átíródó génekhez. A foltok összetétele és elhelyezkedése a génexpresszió változásával összhangban változik[38].
- parafoltok (paraspeckle). A 2002-ben felfedezett parafoltok a kromatinközi térben található szabálytalan formájú alakzatok[39]. Először HeLa sejtekben mutatták ki őket, de azután észlelték valamennyi emberi sejttípusban, beleértve a laboratóriumban tenyésztett immortalizált sejtvonalakat is paraspeckles are now known to also exist in all human primary cells, transformed cell lines, and tissue sections.[40]. Egy sejtmagban 10-30 van belőlük[41]. Nevüket onnan kapták, hogy a splicing-foltok közelében, azokkal parallel módon helyezkednek el[41]. Nagyságuk és elhelyezkedésük a sejt génexpressziójának függvényében változik. Létük az aktív génátírástól függ, ha a fehérjekódoló géneket átíró RNS-polimeráz II inaktív, akkor valamennyi parafolt eltűnik és fehérjekomponenseik a sejtmagvacskában tárolódnak. Ez a folyamat a sejtosztódás telofázisában is lezajlik, a génátírás ilyenkor is szünetel[40].
Funkciója
A sejtmag elválasztja a gének transzkripciójának helyét a fehérjeszintézistől, a transzlációtól és ezáltal a génszabályozásnak olyan lehetőségeit nyújtja, amire a prokarióta sejtek nem képesek. A sejtmag fő feladata a génkifejeződés és a DNS-replikáció szabályozása a sejtciklus során.
Génkifejeződés

A gének kifejeződése mRNS-sé való átírásukkal indul, majd az mRNS sokféleképpen módosul és végül a riboszómákhoz kapcsolódva a transzláció révén fehérjék képződnek róla. Az utóbbi folyamat kivételével a többi tevékenység a sejtmagban zajlik[42]. A sejtmagban találhatóak a transzkripcióhoz közvetlenül és közvetve szükséges enzimek és az ezeket szabályzó transzkripciós faktorok is. Az enzimek közé tartoznak a helikázok, melyek szétcsavarják a kettős szálú DNS-t, az RNS-polimerázok, melyek az mRNS szintézisét végzik és a topoizomerázok, amelyek a DNS széttekeredéséből származó fizikai feszültséget tüntetik el[43].
Az átírt mRNS többféleképpen módosítani kell, mielőtt "érett", transzlációra alkalmas lesz. Ezek közül a legfontosabbak az 5'cap ("sapka") és az adenozinokból álló poli(A) farok elhelyezése rajta, valamint a splicing. Az 5'cap-et a transzkripciós komplexhez tartozó enzim köti az mRNS-hez, a poli(A) farkat pedig közvetlenül az átírás után kapja meg. A splicing a spliceoszóma nevű komplexen belül zajlik és hosszú, sok intront tartalmazó mRNS-ek esetében már azelőtt elkezdődhet, hogy a transzkripció befejeződött[5]. Sok esetben a pre-mRNS-t többféleképpen állítják össze érett mRNS-sé, ez az ú. alternatív splicing; így keletkeznek például a rendkívül változatos ellenanyagok is.
Kompartmentalizáció
A kompartmentalizáció a sejten belüli folyamatok fizikai elválasztását, különböző térrészekbe való elhelyezését jelenti. A maghártya elválasztja a genetikai anyagot a citoplazma többi részétől és lehetővé teszi, hogy attól elkülönülve kontrollálja a gének átírását. Az egyik általánosan elterjedt módszer szerint a megállítandó folyamat egyik közbenső molekuláját a sejtmagba traszportálják, ahol az transzkripciós faktorokhoz kötődve gátolja az adott reakciót katalizáló enzim génexpresszióját. Ilyen például a sejt energiaháztartásában alapvető glikolízis. Ennek első lépésében a hexokináz a glukózból glukóz-6-foszfátot generál, amiből pedig fruktóz-6-foszfát lesz. Ha az utóbbi koncentrációja túl magas, egy regulátor fehérje a sejtmagba viszi a hexokinázt[44], ahol az más proteinekkel olyan komplexumot formál, amely meggátolja a glikolízis enzimjeinek kifejeződését[45].
A génkifejeződést szabályozó transzkripciós faktorokat a sejt sokszor fizikailag elszeparálja a kromoszómáktól, hogy a minimális génátírást is megakadályozza. Ezek a faktorok csak akkor fejthetik ki működésüket, ha a megfelelő szignál aktiválja őket. Például a gyulladási folyamatokban szerepet játszó géneket aktiváló NF-κB faktor a citoplazmában található, amíg a sejt külső membránján lévő receptorokhoz nem csatlakozik valamilyen szignálmolekula (például a TNF-α), és a receptor aktiválja az NF-κB-t, amely ezután a rajta található nukleáris lokalizációs szignál révén a sejtmagba vándorol és megindítja a megfelelő gének transzkripcióját[6].
A kompartmentalizáció tudja megakadályozni, hogy a génekről frissen átírt, módosítatlan pre-mRNS transzlációja azonnal megkezdődjék[46]. Az eukarióták génjeiben közbeszúrt szakaszok, intronok vannak, amelyeket el kell távolítani, mielőtt fehérjévé fordítanák át. A baktériumoknál a transzláció sokszor már ezelőtt elkezdődik, hogy a hírvivő RNS transzkripciója teljesen befejeződne, eukarióták esetében ez az intronok miatt hibás, használhatatlan fehérjék termelődéséhez vezetne.
Nukleáris transzport

A nagy molekulák mozgása a sejtmagba befelé és onnan kifelé szigorúan szabályozott és a pórusokon keresztül történik. Míg a kisméretű molekulák szabadon átjárhatnak[47], a fehérjék és nukleinsavak csak a karioferinnek nevezett proteinhez kapcsolódva haladhatnak át a póruson. A befelé szállító karioferinek az importinok, a sejtmagból kifelé vivők az exportinok. A szállítandó fehérjén rövid aminosavszekvencia, ún. nukleáris lokalizációs szignál jelzi, hogy végcélja a sejtmag; ugyanez igaz a sejtmagból kiszállítandó polipeptidekre is. A póruson való átszállítás energiája guanozin-trifoszfát (GTP) hasításából származik, amit GTP-ázok végeznek. A nukleáris transzport legfontosabb GTP-áza a Ran nevű protein. Az importinoknak a RanGTP komplexre ahhoz van szükségük, hogy elengedjék szállítmányukat, míg az exportinok esetében a kapcsolódás miatt elengedhetetlen a Ran jelenléte[11].
Nukleáris import esetén a citoplazmában található fehérjeszállítmányhoz odakötődik az importin és átviszi a póruson keresztül a magba. Odabent az importin a RanGTP segítségével leválasztja magáról a szállítmányt és visszatér a citoplazmába. Az exportálandó fehérjéhez az exportin köt hozzá a RanGTP energiája felhasználásával, átszállítja a póruson, leválik róla és visszatér a sejtmagba.
Az érett mRNS és transzfer RNS (tRNS) kiszállítására külön exportproteinek specializálódtak. Ezek a sejten belüli "minőségellenőrző" rendszer részei, amely megakadályozza hogy a nem vagy csak részben érett mRNS a riboszómákhoz jusson. A rendszer a citoplazmába kijutó, nem teljesen módosított mRNS még azelőtt lebontja, hogy elkezdődhetne rajta a transzláció[5].
A sejtmag lebomlása és újjászerveződése

A sejt életciklusának bizonyos szakaszaiban - a sejtosztódás és a programozott sejthalál, az apoptózis során a sejtmag megszűnik és az elkülönülését biztosító struktúrák, a maghártya és a nukleáris lamina tervezetten lebomlik.
A legtöbb sejtben a mitózis profázisának végén a mag membránjai szétesnek. Vannak kivételek, például egyes egysejtű eukarióták (élesztő) ún. zárt mitózis révén osztódnak, amikor maghártyájuk épen marad. Ilyenkor a leánykromoszómák a sejtmag két ellenkező végére vándorolnak, majd a mag osztódik. A fejlettebb eukariótákra azonban a maghártya lebomlásával járó nyílt mitózis jellemző, ahol a leánykromoszómák a mitotikus orsó pólusaihoz mozognak és új sejtmag jön létre körülöttük.
A sejtosztódás után mindkét leánysejtnek teljes kromoszómakészletre van szüksége, azért a mitózis előtt a kromoszómák megkettőződnek, majd az osztódás során a mitotikus orsó fonalai (mikrotubulusai) hozzájuk kapcsolódnak és a leánykromoszómákat a sejt ellentétes végeibe, az orsó pólusához, a centroszómához húzzák. A legtöbb sejtben a centroszómák a magon kívül, a citoplazmában helyezkednek el, így ép maghártya esetén a mikrotubulusok nem férnének hozzá a kromoszómákhoz[48]. Emiatt a mitózis korai szakaszában, a profázisban kezdve és a prometafázisban bfejeződve, a sejtmagot körülvevő membránokat szétbontják[14]. Ugyanekkor szétesik a nukleáris lamina is; ez a folyamat a laminfehérjék foszforilálásával jár[49]. A sejtosztódás végén a maghártya újból összeáll, akárcsak az immár defoszforilált laminokból álló lamina[49].
A dinoflagellátáknál a centroszóma szintén a citoplazmában van, azonban a maghártya ép marad és a kromoszómák centromerjei beépülnek a sejtmag membránjába, hogy a mikrotubulusok hozzájuk kapcsolódhassanak (ún. extranukleáris orsó). Sok más egysejtűnél (csillósok, sporozoák, egyes gombák) a centroszómák a magon belül találhatóak és a mag nem bomlik fel a sejtosztódáskor.
Az apoptózis a sejt ellenőrzött, előre programozott pusztulása. Ennek során mélyreható változások történnek, a kromatin kondenzálódik, a maghártya és a lamina szétesik. A lamina hálózatának szétbontását a kaszpáz nevű proteázok (fehérjebontó enzimek) végzik, amelyek szétvágják a laminokat. A kaszpázaktikivitást laboratóriumi tesztekben a korai apoptózis kimutatására használják[14]. Léteznek mutáns sejtvonalak, melyek laminja ellenálló a kaszpázokkal szemben, ezekben nem zajlik le a sejtmag apoptotikus bomlása[14].
A maghártya a vírusok behatolását és meggátolja. Egyes vírusok szaporodásához a sejtmagban található proteinekre van szükség. Egyes DNS-vírusok (például a herpeszvírusok) a sejtmagban szaporodnak és állítják össze új virionjaikat. Ezek úgy szabadulnak ki, hogy lebontják a belső laminát és a maghártyán át bimbózással távoznak, miközben annak egy darabját burokként magukkal viszik[14].
Mag nélküli és többmagvú sejtek
A sejteknek általában egy nukleuszuk van, de egy esetekben több is lehet, esetleg egy sem. Ez lehet előre tervezett folyamat eredménye (például az emlősök vörösvértestjei) vagy hibás sejtosztódás következménye.

A sejtmag nélküli sejtek nem képesek osztódni. Legismertebb példájuk az emlősök vörösvértestje (eritrocitája), amelyből az egyéb organellumok (pld. mitokondriumok) is hiányoznak és gyakorlatilag csak az oxigénszállító hemoglobin tartályául szolgálnak. Az eritrociták a vörös csontvelőben való érésük során veszítik el magjukat, riboszómáikat és organellumaikat. A sejtmag akkor tűnik el, amikor a kiindulási eritroblasztból retikulocita (az érett vörösvértest prekurzora) lesz[50]. Egyes mutagének hatására éretlen, mikronukleusszal rendelkező eritrociták is kikerülhetnek a véráramba[51][52]. Mag nélküli sejtek hibás sejtosztódás során is keletkezhetnek, amikor az egyik leánysejtnek két sejtmagja lesz, a másiknak pedig egy sem.
Ezzel szemben a sugárállatkák Acantharea csoportjának tagjai[53] és egyes mikorrhizás gombák több sejtmaggal is rendelkeznek sejtenként[54]. De a Giardia egysejtű bélparazitának is két magja van [55]. Az emberben a harántcsíkolt izom sejtjei, a miociták összeolvadnak és szincíciumot alkotnak; eközben az eredeti sejtmagok megmaradnak[5]. Betegségek és kórképek kísérőjelensége is lehet a többmagvú sejtek megjelenése, például a gyulladás esetén időnként monociták és makrofágok összeolvadásából származó óriás többmagvú sejtek figyelhetők meg[56] és tumorképződésben is előfordulhatnak[57]. Bizonyos vírusok, például a HIV burokfehérjéi a sejtmembránba épülve a sejtek összeolvadását és sokmagvú szincíciumok kialakulását okozzák[58].
A dinoflagelláták egyes fajainak két sejtmagva van[59], azonban ezek genetikai anyaga különbözik: az egyik az eredeti sejtmag, a másik pedig a vele szimbiózisban élő kovamoszaté.
Evolúciója
A sejtmag megléte az egyik alapvető különbség a prokarióták és eukarióták között és kialakulására négy jelentősebb elmélet is született, de általános elfogadottsággal egyik sem bír[60].
Az első, az ún. szintropikus modell szerint egy archea (ősbaktérium) és egy baktérium szimbiózisából jött létre a magot tartalmazó eukarióta sejt[61]. Az elképzelés szerint a mai metánbaktériumokhoz hasonló archea belsejében parazita vagy szimbionta prokarióta (pl. myxobaktérium) élt és idővel teljes mértékben akalmazkodtak egymáshoz. Ez az elmélet analóg a mitokondriumok és kloroplasztiszok bakteriális eredetét hirdető, a szakértők által általánosan elismert teóriával[62]. Az ősbaktériumi eredetet támogatja, hogy az eukarióták és archeák génjei (pl. a hisztongének) sok tekintetben hasonlóak. Hasonlóan, a myxobaktériumok is sok olyan tulajdonsággal rendelkeznek (soksejtű komplexumokat alkotnak, mozgékonyak, G-proteinjeik és kinázaik az eukariótákéra hasonlítanak), amely az eukariótákra jellemző[63].
A második elmélet endoszimbionta állapot nélküli evolúciós átmenetet tételez fel. Például a Planctomycetes baktériumcsoportot hozzák fel, amely membránnal és primitív pórusokkal ellátott sejtmagszerű organellummal rendelkezik[64]. Egy hasonló elképzelés szerint a proto-eukarióta sejt fagocitózissal kebelezte be az archeákat vagy baktériumokat és szerezte meg génjeiket[65]
A leginkább vitatott modell, a virális eukariogenezis szerint az eukarióták megkülönböztető sajátosságai, közte a membránnal elkülönített sejtmag, vírusfertőzés következményei. Az elmélet alapja az eukarióták és egyes vírusok közötti hasonlóságok: a lineáris kromoszómák, az mRNS 5'cap-ja, sapkája és a DNS csomagolását végző hisztonok analógiája a vírusok nukleoproteinjeivel. Az elmélet egyik verziója szerint a sejtmag a fagocitózissal párhuzamosan fejlődött ki és a korai eukarióták egysejtű ragadozók voltak[66]. Egy másik változat szerint az eukarióták himlővírussal fertőzött ősbaktériumtól erednek, aminek az adja az alapját hogy ezeknek a vírusoknak a DNS-polimeráza hasonlít az eukariótákéra[67][68]. A víruseredetet megpróbálták az ivaros szaporodás tisztázatlan eredetének magyarazására is[69].
A legújabb elmélet, az exomembrán-hipotézis szerint az eukarióták őse egy olyan archea volt, amely egy második membránt fejlesztett az eredeti köré, amelyikből a maghártya lett és addigi membránkötött struktúráiból kialakultak a pórusok, hogy lehetővé tegyék a belül szintetizált termékei - pl. riboszómák - külső transzportját[70].
Jegyzetek
- ↑ Leeuwenhoek, A. van: Opera Omnia, seu Arcana Naturae ope exactissimorum Microscopiorum detecta, experimentis variis comprobata, Epistolis ad varios illustres viros. J. Arnold et Delphis, A. Beman, Lugdinum Batavorum 1719–1730. Cited after: Dieter Gerlach, Geschichte der Mikroskopie. Verlag Harry Deutsch, Frankfurt am Main, Germany, 2009. ISBN 978-3-8171-1781-9.
- ↑ Harris, H. The Birth of the Cell. New Haven: Yale University Press (1999). ISBN 0-300-07384-4
- ↑ Brown, Robert (1866). „On the Organs and Mode of Fecundation of Orchidex and Asclepiadea”. Miscellaneous Botanical Works I, 511–514. o.
- ↑ a b Cremer, Thomas. Von der Zellenlehre zur Chromosomentheorie. Berlin, Heidelberg, New York, Tokyo: Springer Verlag (1985). ISBN 3-540-13987-7 Online Version here
- ↑ a b c d e f g h Lodish, H. Molecular Cell Biology, 5th, New York: WH Freeman (2004). ISBN 0-7167-2672-6
- ↑ a b c d szerk.: Bruce Alberts, Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, Peter Walter: Molecular Biology of the Cell, Chapter 4, pages 191–234, 4th, Garland Science (2002)
- ↑ Clegg JS (1984. február 1.). „Properties and metabolism of the aqueous cytoplasm and its boundaries”. Am. J. Physiol. 246 (2 Pt 2), R133–51. o. PMID 6364846.
- ↑ a b Paine P, Moore L, Horowitz S (1975). „Nuclear envelope permeability”. Nature 254 (5496), 109–114. o. DOI:10.1038/254109a0. PMID 1117994.
- ↑ szerk.: Rodney Rhoades, Richard Pflanzer: Ch3, Human Physiology, 3rd, Saunders College Publishing (1996)
- ↑ Shulga N, Mosammaparast N, Wozniak R, Goldfarb D (2000). „Yeast nucleoporins involved in passive nuclear envelope permeability”. J Cell Biol 149 (5), 1027–1038. o. DOI:10.1083/jcb.149.5.1027. PMID 10831607.
- ↑ a b Pemberton L, Paschal B (2005). „Mechanisms of receptor-mediated nuclear import and nuclear export”. Traffic 6 (3), 187–198. o. DOI:10.1111/j.1600-0854.2005.00270.x. PMID 15702987.
- ↑ Stuurman N, Heins S, Aebi U (1998). „Nuclear lamins: their structure, assembly, and interactions”. J Struct Biol 122 (1–2), 42–66. o. DOI:10.1006/jsbi.1998.3987. PMID 9724605.
- ↑ Goldman A, Moir R, Montag-Lowy M, Stewart M, Goldman R (1992). „Pathway of incorporation of microinjected lamin A into the nuclear envelope”. J Cell Biol 119 (4), 725–735. o. DOI:10.1083/jcb.119.4.725. PMID 1429833.
- ↑ a b c d e Goldman R, Gruenbaum Y, Moir R, Shumaker D, Spann T (2002). „Nuclear lamins: building blocks of nuclear architecture”. Genes Dev 16 (5), 533–547. o. DOI:10.1101/gad.960502. PMID 11877373.
- ↑ Moir RD, Yoona M, Khuona S, Goldman RD. (2000). „Nuclear Lamins A and B1: Different Pathways of Assembly during Nuclear Envelope Formation in Living Cells”. Journal of Cell Biology 151 (6), 1155–1168. o. DOI:10.1083/jcb.151.6.1155. PMID 11121432.
- ↑ (2002) „Alteration of nuclear lamin organization inhibits RNA polymerase II–dependent transcription”. Journal of Cell Biology 156 (4), 603–608. o. DOI:10.1083/jcb.200112047. PMID 11854306.
- ↑ Mounkes LC, Stewart CL (2004). „Aging and nuclear organization: lamins and progeria”. Current Opinion in Cell Biology 16 (3), 322–327. o. DOI:10.1016/j.ceb.2004.03.009. PMID 15145358.
- ↑ Ehrenhofer-Murray A (2004). „Chromatin dynamics at DNA replication, transcription and repair”. Eur J Biochem 271 (12), 2335–2349. o. DOI:10.1111/j.1432-1033.2004.04162.x. PMID 15182349.
- ↑ Grigoryev S, Bulynko Y, Popova E (2006). „The end adjusts the means: heterochromatin remodelling during terminal cell differentiation”. Chromosome Res 14 (1), 53–69. o. DOI:10.1007/s10577-005-1021-6. PMID 16506096.
- ↑ Schardin, Margit (1985. december 1.). „Specific staining of human chromosomes in Chinese hamster x man hybrid cell lines demonstrates interphase chromosome territories”. Human Genetics 71 (4), 281–287. o, Kiadó: Springer Berlin / Heidelberg. DOI:10.1007/BF00388452. PMID 2416668.
- ↑ Lamond, Angus I. (1998. április 24.). „Structure and Function in the Nucleus”. Science 280 (5363), 547–553. o. DOI:10.1126/science.280.5363.547. PMID 9554838.
- ↑ Kurz, A (1996). „Active and inactive genes localize preferentially in the periphery of chromosome territories”. The Journal of Cell Biology 135 (5), 1195–1205. o, Kiadó: The Rockefeller University Press. DOI:10.1083/jcb.135.5.1195. PMID 8947544.
- ↑ NF Rothfield, BD Stollar (1967). „The Relation of Immunoglobulin Class, Pattern of Antinuclear Antibody, and Complement-Fixing Antibodies to DNA in Sera from Patients with Systemic Lupus Erythematosus”. J Clin Invest 46 (11), 1785–1794. o. DOI:10.1172/JCI105669. PMID 4168731.
- ↑ S Barned, AD Goodman, DH Mattson (1995). „Frequency of anti-nuclear antibodies in multiple sclerosis”. Neurology 45 (2), 384–385. o. DOI:10.1212/WNL.45.2.384. PMID 7854544.
- ↑ Böhm I. IgG deposits can be detected in cell nuclei of patients with both lupus erythematosus and malignancy. Clin Rheumatol 2007;26(11) 1877-1882
- ↑ Hernandez-Verdun, Daniele (2006). „Nucleolus: from structure to dynamics”. Histochem. Cell. Biol 125 (1–2), 127–137. o. DOI:10.1007/s00418-005-0046-4. PMID 16328431.
- ↑ a b Lamond, Angus I. (2003. október 1.). „Nuclear substructure and dynamics”. current biology 13 (21), R825–828. o. DOI:10.1016/j.cub.2003.10.012. PMID 14588256.
- ↑ a b c Cioce M, Lamond A (2005). „Cajal bodies: a long history of discovery”. Annu Rev Cell Dev Biol 21, 105–131. o. DOI:10.1146/annurev.cellbio.20.010403.103738. PMID 16212489.
- ↑ a b c Pollard, Thomas D.. Cell Biology. Philadelphia: Saunders (2004). ISBN 0-7216-3360-9
- ↑ a b c Dundr, Miroslav (2001). „Functional architecture in the cell nucleus”. Biochem. J. 356 (Pt 2), 297–310. o. DOI:10.1042/0264-6021:3560297. PMID 11368755.
- ↑ Fox, Archa. R. Sundby interjúja.. Paraspeckle Size., E-mail Correspondence. 2007. március 7.
- ↑ Goebel, H.H. (1997. január 1.). „Nemaline myopathy with intranuclear rods—intranuclear rod myopathy”. Neuromuscular Disorders 7 (1), 13–19. o. DOI:10.1016/S0960-8966(96)00404-X. PMID 9132135.
- ↑ a b c Matera AG, Frey MA. (1998). „Coiled Bodies and Gems: Janus or Gemini?”. American Journal of Human Genetics 63 (2), 317–321. o. DOI:10.1086/301992. PMID 9683623.
- ↑ Matera, A. Gregory (1998). „Of Coiled Bodies, Gems, and Salmon”. Journal of Cellular Biochemistry 70 (2), 181–192. o. DOI:<181::aid-jcb4>3.0.co;2-k 10.1002/(sici)1097-4644(19980801)70:2<181::aid-jcb4>3.0.co;2-k. PMID 9671224.
- ↑ Saunders WS, Cooke CA, Earnshaw WC (1991). „Compartmentalization within the nucleus: discovery of a novel subnuclear region.”. Journal of Cellular Biology 115 (4), 919–931. o. DOI:10.1083/jcb.115.4.919. PMID 1955462
- ↑ Pombo A, Cuello P, Schul W, Yoon J, Roeder R, Cook P, Murphy S (1998). „Regional and temporal specialization in the nucleus: a transcriptionally active nuclear domain rich in PTF, Oct1 and PIKA antigens associates with specific chromosomes early in the cell cycle”. The EMBO Journal 17 (6), 1768–1778. o. DOI:10.1093/emboj/17.6.1768. PMID 9501098.
- ↑ Cellular component Nucleus speckle. UniProt: UniProtKB. (Hozzáférés: 2013. augusztus 30.)
- ↑ Handwerger, Korie E. (2006. január 1.). „Subnuclear organelles: new insights into form and function”. TRENDS in Cell Biology 16 (1), 19–26. o. DOI:10.1016/j.tcb.2005.11.005. PMID 16325406.
- ↑ Fox, Archa (2002). „Paraspeckles:A Novel Nuclear Domain”. Current Biology 12 (1), 13–25. o. DOI:10.1016/S0960-9822(01)00632-7. PMID 11790299.
- ↑ a b Fox, A. (2005). „P54nrb Forms a Heterodimer with PSP1 That Localizes to Paraspeckles in an RNA-dependent Manner”. Molecular Biology of the Cell 16 (11), 5304–5315. o. DOI:10.1091/mbc.E05-06-0587. PMID 16148043.
- ↑ a b Fox, Archa: Nuclear Compartments: Paraspeckles. Nuclear Protein Database, 2004. [2006. május 2-i dátummal az eredetiből archiválva]. (Hozzáférés: 2007. március 6.)
- ↑ Nierhaus, Knud H.. Protein Synthesis and Ribosome Structure: Translating the Genome. Wiley-VCH (2004). ISBN 3-527-30638-2
- ↑ Nicolini, Claudio A.. Genome Structure and Function: From Chromosomes Characterization to Genes Technology. Springer (1997). ISBN 0-7923-4565-7
- ↑ Lehninger, Albert L.. Lehninger principles of biochemistry, 3rd, New York: Worth Publishers (2000). ISBN 1-57259-931-6
- ↑ Moreno F, Ahuatzi D, Riera A, Palomino CA, Herrero P. (2005). „Glucose sensing through the Hxk2-dependent signalling pathway.”. Biochem Soc Trans 33 (1), 265–268. o. DOI:10.1042/BST0330265. PMID 15667322. PMID 15667322
- ↑ Görlich, Dirk (1999). „Transport between the cell nucleus and the cytoplasm”. Ann. Rev. Cell Dev. Biol. 15 (1), 607–660. o. DOI:10.1146/annurev.cellbio.15.1.607. PMID 10611974.
- ↑ Watson, JD. Ch9–10, Molecular Biology of the Gene, 5th, Peason Benjamin Cummings; CSHL Press. (2004). ISBN 0-8053-9603-9
- ↑ Lippincott-Schwartz, Jennifer (2002. március 7.). „Cell biology: Ripping up the nuclear envelope”. Nature 416 (6876), 31–32. o. DOI:10.1038/416031a. PMID 11882878.
- ↑ a b Boulikas T (1995). „Phosphorylation of transcription factors and control of the cell cycle”. Crit Rev Eukaryot Gene Expr 5 (1), 1–77. o. PMID 7549180.
- ↑ Skutelsky, E. (1970. június 1.). „Comparative study of nuclear expulsion from the late erythroblast and cytokinesis”. J Cell Biol 60 (60(3)), 625–635. o. DOI:10.1016/0014-4827(70)90536-7. PMID 5422968.
- ↑ Torous, DK (2000). „Enumeration of micronucleated reticulocytes in rat peripheral blood: a flow cytometric study”. Mutat Res 465 (465(1–2)), 91–99. o. DOI:10.1016/S1383-5718(99)00216-8. PMID 10708974.
- ↑ Hutter, KJ (1982). „Rapid detection of mutagen induced micronucleated erythrocytes by flow cytometry”. Histochemistry 75 (3), 353–362. o. DOI:10.1007/bf00496738. PMID 7141888.
- ↑ Zettler, LA (1997). „Phylogenetic relationships between the Acantharea and the Polycystinea: A molecular perspective on Haeckel's Radiolaria”. Proc Natl Acad Sci USA 94 (21), 11411–11416. o. DOI:10.1073/pnas.94.21.11411. PMID 9326623.
- ↑ Horton, TR (2006). „The number of nuclei in basidiospores of 63 species of ectomycorrhizal Homobasidiomycetes”. Mycologia 98 (2), 233–238. o. DOI:10.3852/mycologia.98.2.233. PMID 16894968.
- ↑ Adam RD (1991. december 1.). „The biology of Giardia spp”. Microbiol. Rev. 55 (4), 706–32. o. PMID 1779932.
- ↑ McInnes, A (1988). „Interleukin 4 induces cultured monocytes/macrophages to form giant multinucleated cells”. J Exp Med 167 (2), 598–611. o. DOI:10.1084/jem.167.2.598. PMID 3258008.
- ↑ Goldring, SR (1987). „Human giant cell tumors of bone identification and characterization of cell types”. J Clin Invest 79 (2), 483–491. o. DOI:10.1172/JCI112838. PMID 3027126.
- ↑ [Brynmor A. Watkins et al:http://vir.sgmjournals.org/content/78/10/2513.full.pdf Syncytium formation induced by human immunodeficiency virus type 1 isolates correlates with affinity for CD4] Journal of General Virology (1997), 78, 2513–2522
- ↑ (2012) „Tertiary endosymbiosis in two dinotoms has generated little change in the mitochondrial genomes of their dinoflagellate hosts and diatom endosymbionts”. PLOS ONE 7 (8), e43763. o. DOI:10.1371/journal.pone.0043763.
- ↑ Pennisi E. (2004). „Evolutionary biology. The birth of the nucleus”. Science 305 (5685), 766–768. o. DOI:10.1126/science.305.5685.766. PMID 15297641.
- ↑ C.Michael Hogan. 2010. Archaea. eds. E.Monosson & C.Cleveland, Encyclopedia of Earth. National Council for Science and the Environment, Washington DC.
- ↑ Margulis, Lynn. Symbiosis in Cell Evolution. San Francisco: W. H. Freeman and Company, 206–227. o. (1981). ISBN 0-7167-1256-3
- ↑ Lopez-Garcia P, Moreira D. (2006). „Selective forces for the origin of the eukaryotic nucleus”. BioEssays 28 (5), 525–533. o. DOI:10.1002/bies.20413. PMID 16615090.
- ↑ Fuerst JA. (2005). „Intracellular compartmentation in planctomycetes”. Annu Rev Microbiol. 59, 299–328. o. DOI:10.1146/annurev.micro.59.030804.121258. PMID 15910279.
- ↑ Hartman H, Fedorov A. (2002). „The origin of the eukaryotic cell: a genomic investigation”. Proc Natl Acad Sci U S A. 99 (3), 1420–1425. o. DOI:10.1073/pnas.032658599. PMID 11805300.
- ↑ Bell PJ (2001. szeptember 1.). „Viral eukaryogenesis: was the ancestor of the nucleus a complex DNA virus?”. J. Mol. Evol. 53 (3), 251–6. o. DOI:10.1007/s002390010215. PMID 11523012.
- ↑ Takemura M (2001). „Poxviruses and the origin of the eukaryotic nucleus”. J Mol Evol 52 (5), 419–425. o. DOI:10.1007/s002390010171. PMID 11443345.
- ↑ Villarreal L, DeFilippis V (2000). „A hypothesis for DNA viruses as the origin of eukaryotic replication proteins”. J Virol 74 (15), 7079–7084. o. DOI:10.1128/JVI.74.15.7079-7084.2000. PMID 10888648.
- ↑ Bell PJ (2006. november 1.). „Sex and the eukaryotic cell cycle is consistent with a viral ancestry for the eukaryotic nucleus”. J. Theor. Biol. 243 (1), 54–63. o. DOI:10.1016/j.jtbi.2006.05.015. PMID 16846615.
- ↑ de Roos AD (2006). „The origin of the eukaryotic cell based on conservation of existing interfaces”. Artif Life 12 (4), 513–523.. o. DOI:10.1162/artl.2006.12.4.513. PMID 16953783.
Irodalom
- Goldman, Robert D. (2002). „Nuclear lamins: building blocks of nuclear architecture”. Genes & Dev. 16 (5), 533–547. o. DOI:10.1101/gad.960502. PMID 11877373.
- Görlich, Dirk (1999). „Transport between the cell nucleus and the cytoplasm”. Ann. Rev. Cell Dev. Biol. 15, 607–660. o. DOI:10.1146/annurev.cellbio.15.1.607. PMID 10611974.
- Lamond, Angus I. (1998. április 24.). „Structure and Function in the Nucleus”. Science 280 (5363), 547–553. o. DOI:10.1126/science.280.5363.547. PMID 9554838.
- Pennisi E. (2004). „Evolutionary biology. The birth of the nucleus”. Science 305 (5685), 766–768. o. DOI:10.1126/science.305.5685.766. PMID 15297641.
- Pollard, Thomas D.. Cell Biology. Philadelphia: Saunders (2004). ISBN 0-7216-3360-9
Ez a szócikk részben vagy egészben a Cell nucleus című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.