„Ebola (betegség)” változatai közötti eltérés
| [ellenőrzött változat] | [ellenőrzött változat] |
osztályozás bővítése |
|||
| 49. sor: | 49. sor: | ||
[[Fájl:7042 lores-Ebola-Zaire-CDC Photo.jpg|bélyegkép|jobb|200px|az orvosok és ápolók különösen veszélyeztetettek (Kinshasa, 1976)]] |
[[Fájl:7042 lores-Ebola-Zaire-CDC Photo.jpg|bélyegkép|jobb|200px|az orvosok és ápolók különösen veszélyeztetettek (Kinshasa, 1976)]] |
||
A vírus természetben való előfordulása, esetleges átterjedése az emberre részleteiben nem ismert. Valószínűsíthetően fertőzött állattal való érintkezés útján kerülhet át az emberbe. Az emberek közötti terjedése a fertőzött személy [[vér]]ével vagy más testnedveivel (pl. [[nyál]], [[ondó]]) való közvetlen kapcsolat útján történik, vagy a fertőzött orvosi eszközökön keresztül (pl. injekciós tűkkel). A szájon át történő vagy a [[emberi szem|szem]] kötőhártyáján keresztüli fertőzés is valószínű, és főemlősökön végzett állatkísérletekben igazolt mechanizmus.<ref name="pmid8551825">{{cite journal |author=Jaax N, Jahrling P, Geisbert T, Geisbert J, Steele K, McKee K, Nagley D, Johnson E, Jaax G, Peters C.|title=Transmission of Ebola virus (Zaire strain) to uninfected control monkeys in a biocontainment laboratory. |journal=Lancet. |volume=346 |issue=8991-8992 |pages=1669-71 |year=1995 |month=December |language=angol |pmid=8551825 |doi=10.1016/S0140-6736(95)92841-3}}</ref> Cseppfertőzéssel természetes körülmények között nem terjed, de laboratóriumban létrehozott 0,8-1,2 [[Méter#A méter többszörösei és törtrészei|mikrométer]] átmérőjű partikulumként fertőzőképes,<ref name="pmid7547435">{{cite journal |author=Johnson E, Jaax N, White J, Jahrling P.|title=Lethal experimental infections of rhesus monkeys by aerosolized Ebola virus. |journal=Int J Exp Pathol. |volume=76 |issue=4 |pages=227-36 |year=1995 |month=August |language=angol |pmid=7547435}}</ref> így a cseppfertőzés potenciális lehetősége miatt A kategóriás [[biológiai fegyver]]nek minősül.<ref name="pmid15588056">{{cite journal |author=Leffel EK, Reed DS.|title=Marburg and Ebola viruses as aerosol threats. |journal=Biosecur Bioterror. |volume=2 |issue=3 |pages=186-91 |year=2004 |month= |language=angol |pmid=15588056 |doi=10.1089/bsp.2004.2.186 |
A vírus természetben való előfordulása, esetleges átterjedése az emberre részleteiben nem ismert. Valószínűsíthetően fertőzött állattal való érintkezés útján kerülhet át az emberbe. Az emberek közötti terjedése a fertőzött személy [[vér]]ével vagy más testnedveivel (pl. [[nyál]], [[ondó]]) való közvetlen kapcsolat útján történik, vagy a fertőzött orvosi eszközökön keresztül (pl. injekciós tűkkel). A szájon át történő vagy a [[emberi szem|szem]] kötőhártyáján keresztüli fertőzés is valószínű, és főemlősökön végzett állatkísérletekben igazolt mechanizmus.<ref name="pmid8551825">{{cite journal |author=Jaax N, Jahrling P, Geisbert T, Geisbert J, Steele K, McKee K, Nagley D, Johnson E, Jaax G, Peters C.|title=Transmission of Ebola virus (Zaire strain) to uninfected control monkeys in a biocontainment laboratory. |journal=Lancet. |volume=346 |issue=8991-8992 |pages=1669-71 |year=1995 |month=December |language=angol |pmid=8551825 |doi=10.1016/S0140-6736(95)92841-3}}</ref> Cseppfertőzéssel természetes körülmények között nem terjed, de laboratóriumban létrehozott 0,8-1,2 [[Méter#A méter többszörösei és törtrészei|mikrométer]] átmérőjű partikulumként fertőzőképes,<ref name="pmid7547435">{{cite journal |author=Johnson E, Jaax N, White J, Jahrling P.|title=Lethal experimental infections of rhesus monkeys by aerosolized Ebola virus. |journal=Int J Exp Pathol. |volume=76 |issue=4 |pages=227-36 |year=1995 |month=August |language=angol |pmid=7547435}}</ref> így a cseppfertőzés potenciális lehetősége miatt A kategóriás [[biológiai fegyver]]nek minősül.<ref name="pmid15588056">{{cite journal |author=Leffel EK, Reed DS.|title=Marburg and Ebola viruses as aerosol threats. |journal=Biosecur Bioterror. |volume=2 |issue=3 |pages=186-91 |year=2004 |month= |language=angol |pmid=15588056 |doi=10.1089/bsp.2004.2.186}}</ref> |
||
=== Osztályozása === |
=== Osztályozása === |
||
[[File:Ebola 1976-2014.svg|thumb|Az Ebola-járvány kitörési gócpontjai 1976-2014 között. Kék ponttal a 2014-es jelentések alapján (ápr.-ig)]] |
[[File:Ebola 1976-2014.svg|thumb|Az Ebola-járvány kitörési gócpontjai 1976-2014 között. Kék ponttal a 2014-es jelentések alapján (ápr.-ig)]] |
||
Az Ebola-vírus és a Marburg-vírus nemzetséget eredetileg a ma már nem létező filovírus nembe sorolták. 1998 márciusában a Gerincesek Vírusai Albizottság indítványozta a Nemzetközi Vírustaxonómiai Bizottságnál (ICTV), hogy változtassák a filovírus nemet filovíruscsaládra, két külön nemzetséggel: Ebola-szerű vírusok és Marburg-szerű vírusok. Az indítványt 2001 áprilisában Washingtonban elfogadták, majd 2002 júliusában Párizsban is. 2000-ben egy Washingtonban készített indítvány eredményeként az Ebola-szerű vírusokból és a Marburg-szerű vírusokból Ebola-vírus és Marburg-vírus lett. |
Az Ebola-vírus és a Marburg-vírus nemzetséget eredetileg a ma már nem létező filovírus nembe sorolták. 1998 márciusában a Gerincesek Vírusai Albizottság indítványozta a Nemzetközi Vírustaxonómiai Bizottságnál (ICTV), hogy változtassák a filovírus nemet filovíruscsaládra, két külön nemzetséggel: Ebola-szerű vírusok és Marburg-szerű vírusok. Az indítványt 2001 áprilisában Washingtonban elfogadták, majd 2002 júliusában Párizsban is. 2000-ben egy Washingtonban készített indítvány eredményeként az Ebola-szerű vírusokból és a Marburg-szerű vírusokból Ebola-vírus és Marburg-vírus lett. |
||
Az ''Ebolavirus'' [[nemzetség (rendszertan)|nemzetségbe]] jelenleg öt faj tartozik, az Ebola vírus (EBOV, korábban zairei Ebola vírus, ZEBOV), a Szudán vírus (SUDV, korábban szudáni Ebola vírus, SEBOV), A Taï erdő vírus ([[angol nyelv|angolul]]: Taï forest virus, TAFV, korábbi nevén elefántcsontparti Ebola vírus, CIEBOV), a Bundibogyo vírus (BDBV, korábban Bundibogyo Ebola vírus, BEBOV) és a Reston vírus (RESTV, korábbi nevén Reston Ebola vírus, REBOV).<ref name="pmid21046175">{{cite journal |author=Kuhn JH, Becker S, Ebihara H, Geisbert TW, Johnson KM, Kawaoka Y, Lipkin WI, Negredo AI, Netesov SV, Nichol ST, Palacios G, Peters CJ, Tenorio A, Volchkov VE, Jahrling PB.|title=Proposal for a revised taxonomy of the family Filoviridae: classification, names of taxa and viruses, and virus abbreviations. |journal=Arch Virol. |volume=155 |issue=12 |pages=2083-103 |year=2010 |month=December |language=angol |pmid=21046175 |doi=10.1007/s00705-010-0814-x}}</ref><ref name="pmid23255795">{{cite journal |author=Leffel EK, Reed DS.|title=Molecular evolution of viruses of the family Filoviridae based on 97 whole-genome sequences. |journal=J Virol. |volume=87 |issue=5 |pages=2608-16 |year=2013 |month=March |language=angol |pmid=23255795 |doi=10.1128/JVI.03118-12}}</ref> Ezek közül a Reston vírus különböző állatokban (sertés, majom) vérzéses lázat okoz, azonban emberi megbetegedést nem idéz elő.<ref name="pmid22709971">{{cite journal |author=Sayama Y, Demetria C, Saito M, Azul RR, Taniguchi S, Fukushi S, Yoshikawa T, Iizuka I, Mizutani T, Kurane I, Malbas FF Jr, Lupisan S, Catbagan DP, Animas SB, Morales RG, Lopez EL, Dazo KR, Cruz MS, Olveda R, Saijo M, Oshitani H, Morikawa S.|title=A seroepidemiologic study of Reston ebolavirus in swine in the Philippines. |journal=BMC Vet Res. |volume=8 |issue= |pages=82 |year=2012 |month=June |language=angol |pmid=22709971 |doi=10.1186/1746-6148-8-82}}</ref> |
|||
==== A zairei Ebola-vírus (EBOV; előtte ZEBOV) ==== |
==== A zairei Ebola-vírus (EBOV; előtte ZEBOV) ==== |
||
A lap 2014. augusztus 3., 12:52-kori változata
| Az itt található információk kizárólag tájékoztató jellegűek, nem minősülnek orvosi szakvéleménynek, nem pótolják az orvosi kivizsgálást és kezelést. A cikk tartalmát a Wikipédia önkéntes szerkesztői alakítják ki, és bármikor módosulhat. |
| Ebola | |
 | |
| Elkülönített részleg egy gului kórházban a 2000-es ugandai ebola járvány idején. | |
| Szinonimák | Ebola vérzéses láz |
| Angolul | Ebola virus disease, Ebola hemorrhagic fever |
| Osztályozás | |
| BNO-10 | A98.4 |
| BNO-9 | 065.8 |
| Főbb tünetek | |
| Adatbázisok | |
| DiseasesDB | 18043 |
| MedlinePlus | 001339 |
| eMedicine | med/626 |
| MeSH ID | D019142 |
A Wikimédia Commons tartalmaz Ebola témájú médiaállományokat. | |
Az ebola vagy ebola vérzéses láz egy súlyos, magas halálozással járó fertőző betegség, melyet az Ebolavirus nemzetségbe tartozó Ebola-vírusok okoznak, melyek a Marburg-vírushoz hasonlóan a filovíruscsaládba tartoznak.[1] A betegség eleinte klasszikus vírusfertőzés tüneteivel jelentkezik (pl. láz, izomfájdalmak), majd kialakulnak a vérzéses lázra jellemző tünetek, mint a hasmenés, hányás, fokozott vérzékenység, végül többszervi elégtelenség és keringési sokk alakul ki.[2] A betegség a Kongói Demokratikus Köztársaságban található Ebola folyóról kapta a nevét, ahol először okozott járványt 1976-ban. A vírus azóta Afrika különböző pontjain többször is feltűnt, főleg Kelet-Közép-, Közép- és Nyugat-Afrikában, az Ebola és a Kongó folyók környékén, a Kongó területén, a Viktória-tó környékén, Dél-Szudánban, Ugandában, Gabonban, Elefántcsontparton, Guineában, Sierra Leonéban és Libériában. A betegség zoonózis, állatról terjed emberre. Megbetegíti a majmokat és más emlősöket is, azonban a vírus természetes gazdája nem ismert.[3]
Kezelése és megelőzése nem megoldott, sem specifikus terápia, sem hatékony védőoltás nem áll rendelkezése.[2] A beteg elkülönítése mellett támogató, szupportív kezeléseket (pl. folyadékpótlás) alkalmaznak. A betegség halálozása 50-90 százalék körüli. Potenciális biológiai fegyvernek tartják, mivel az egyik legvirulensebb emberi kórokozó.[4]
Etimológia
A vírust a Kongói Demokratikus Köztársaság (egykori nevén Zaire) területén található Ebola folyó völgye után nevezték el, ami közel található az első 1976-os ismert járványkitöréshez, egy flamand nővérek által vezetett misszionárius kórházhoz.
A Kórokozó
A fertőzés módja
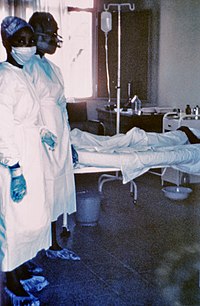
A vírus természetben való előfordulása, esetleges átterjedése az emberre részleteiben nem ismert. Valószínűsíthetően fertőzött állattal való érintkezés útján kerülhet át az emberbe. Az emberek közötti terjedése a fertőzött személy vérével vagy más testnedveivel (pl. nyál, ondó) való közvetlen kapcsolat útján történik, vagy a fertőzött orvosi eszközökön keresztül (pl. injekciós tűkkel). A szájon át történő vagy a szem kötőhártyáján keresztüli fertőzés is valószínű, és főemlősökön végzett állatkísérletekben igazolt mechanizmus.[5] Cseppfertőzéssel természetes körülmények között nem terjed, de laboratóriumban létrehozott 0,8-1,2 mikrométer átmérőjű partikulumként fertőzőképes,[6] így a cseppfertőzés potenciális lehetősége miatt A kategóriás biológiai fegyvernek minősül.[7]
Osztályozása

Az Ebola-vírus és a Marburg-vírus nemzetséget eredetileg a ma már nem létező filovírus nembe sorolták. 1998 márciusában a Gerincesek Vírusai Albizottság indítványozta a Nemzetközi Vírustaxonómiai Bizottságnál (ICTV), hogy változtassák a filovírus nemet filovíruscsaládra, két külön nemzetséggel: Ebola-szerű vírusok és Marburg-szerű vírusok. Az indítványt 2001 áprilisában Washingtonban elfogadták, majd 2002 júliusában Párizsban is. 2000-ben egy Washingtonban készített indítvány eredményeként az Ebola-szerű vírusokból és a Marburg-szerű vírusokból Ebola-vírus és Marburg-vírus lett.
Az Ebolavirus nemzetségbe jelenleg öt faj tartozik, az Ebola vírus (EBOV, korábban zairei Ebola vírus, ZEBOV), a Szudán vírus (SUDV, korábban szudáni Ebola vírus, SEBOV), A Taï erdő vírus (angolul: Taï forest virus, TAFV, korábbi nevén elefántcsontparti Ebola vírus, CIEBOV), a Bundibogyo vírus (BDBV, korábban Bundibogyo Ebola vírus, BEBOV) és a Reston vírus (RESTV, korábbi nevén Reston Ebola vírus, REBOV).[8][9] Ezek közül a Reston vírus különböző állatokban (sertés, majom) vérzéses lázat okoz, azonban emberi megbetegedést nem idéz elő.[10]
A zairei Ebola-vírus (EBOV; előtte ZEBOV)
- A Zaire-vírus, más néven zairei Ebola-vírus (EBOV) rendelkezik a legnagyobb halálozási aránnyal, ami akár 90%-os is lehet, az átlagos halálozási arány körülbelül 83%-os volt 27 év alatt (1976-2003). A halálozási arány 1976-ban 88%, 1994-ben 59%, 1995-ben 81%, 1996-ban 73%, 2001-2002-ben 80%, 2003-ban 90%-os volt. Több járványkitörése volt a zairei Ebola-vírusnak, mint a többi törzsnek. Az első kitörés 1976 augusztus 26-án történt Yambukuban. Mabalo Lokela, egy 44 éves tanár, volt az első feljegyzett eset. A tünetek maláriára hasonlítottak, és a későbbi páciensek kinint kaptak. A fertőzés átvitele valószínűleg Lokela injekciós tűjének fertőtlenítés nélküli újra használata okozhatta. A további fertőzések a nem megfelelő felszerelés, a nem megfelelő nővéri ellátás, a hiányos óvintézkedések (pl. gumikesztyű használata), illetve a hagyományos temetkezési szertartásnak volt köszönhető, amely magában foglalta az emésztőrendszer mosását és tisztítását is.
A szudáni Ebola-vírus (SUDV; előtte SEBOV)
- Ez a vírus volt az Ebola második szubtípusa, ami a Zaire-vírussal egy időben jelent meg. Valószínűsíthető, hogy egy pamutgyár dolgozói között jelent meg először a szudáni Nzaraban, innen származik az első olyan feljegyzett eset is, ahol egy dolgozó volt a vélelmezett természetes hordozó. A tudósok válaszul az összes állatot és rovart letesztelték, ennek ellenére egynél sem találták meg a vírust. A hordozó továbbra is ismeretlen. A nem megfelelő nővéri ellátás szintén elősegítette a járvány terjedését. A legutóbbi járványkitörés 2004 májusában történt. 20 megerősített esetet jelentettek Szudán, Yambio megyéjéből melynek öt áldozata volt. Az átlagos halálozási arány 54%-os volt 1976-ban, 68%-os 1979-ben és 53%-os volt 2000 és 2001-ben.
A restoni Ebola-vírus (RESTV; előtte REBOV)
- Majom vérzéses-láz vírusa (SHFV) által okozott járványkitörés során fedezték fel egy közönséges makákóban, 1989-ben a Hazleton Laboratoriesban (most Covance). Az eredeti restoni (Virginia, Egyesült Államok) kitörés után, felbukkant a Fülöp-szigeteki malacok között, az olaszországi Sienában, Texasban. Annak ellenére, hogy Level-4-es organizmus, nem okoz betegséget az emberekben, azonban veszélyes a majmokra.
Az elefántcsontparti Ebola-vírus (TAFV; előtte CIEBOV)
- A vírust csimpánzok között fedezték fel Tai erdőben, Elefántcsontpartban. 1994. november 1-jén, két csimpánz tetemét fedezték fel az erdőben. A boncolás során a szíven belül folyékony, barna vért találtak, habár nyilvánvaló elváltozás jele nem volt a szerven, egy másik boncolás pedig folyékony vérrel teli tüdőt mutatott. A csimpánzszövetek tanulmányozása hasonló eredményeket mutatott, mint az embereket érintő 1976-os szudáni és zairei járványkitörés. Később, 1994-ben még több halott csimpánzt fedeztek fel, sokuknál az Ebola-teszt pozitív eredményt mutatott. A fertőzés forrása valószínűleg a csimpánzok által zsákmányolt vörös kolobuszmajmok húsa lehetett. Az egyik tudós, a boncolás során megfertőződött a vírussal. Egy héttel a boncolás után a Dengue-lázhoz hasonló tüneteket produkált, majd Svájcba került kezelésre. Két hét múlva elengedték a kórházból és hat héttel a fertőzés után teljesen felépült.
A bundibugyoi Ebola-vírus (BDBV; előtte BEBOV)
- 2007. november 24-én, az Ugandai Egészségügyi Minisztérium megerősítette egy ebolajárvány kitörését Bundibugyo körzetben. Miután a mintákat a United States National Reference Laboratories és a CDC is megerősítette, a Egészségügyi Világszervezet bejelentette az új faj létezését. 2008 február 20-án, az Ugandai Minisztérium hivatalosan bejelentette a járvány végét Bundibugyoban, az utolsó fertőzött embert 2008. január 8-án engedték el. Uganda hivatalosan 149 esetet erősített meg, akik az Ebola-vírus új fajával fertőződtek, közölük 37-en haltak meg, ami 24,83%-os halálozási arányt jelent.
A vírus hordozói, terjesztői
Az újabb járványok esélyét leginkább akkor lehetne korlátozni, ha sikerülne a vírust végre a természetben is megtalálni, vagyis jellemző gazdafajt azonosítani. A Marburg- és a restoni Ebola-vírus mindig főemlősökkel, különböző majmokkal dolgozó, érintkező személyek között és közvetlen környezetükben lépett fel. Az Ebola-vírusok közvetítőjét és rezervoárját még nem azonosították. Lehet, hogy a denevérek közvetítik, de biztos, hogy nem a majmok az elsődleges fertőzési források, nem megfelelő gazdák a vírusok számára, mert nagyon gyorsan elpusztítja őket; a rágcsálók szintén negatívnak bizonyultak. Járványt indíthat el a halotti szertartás, mert Afrikában ez együtt jár a halottal való közvetlen érintkezéssel: a halott lemosása, megcsókolása, a mosófolyadék érintése stb. Nem tudják, hogy a járványok közötti időszakokban hol van a vírus, de annyi biztos, hogy főként kórházi körülmények között fertőz, ahol sokan érintkeznek a beteggel, tehát a vektor nosocomialis. Valamiért mégsem képes hosszabb ideig fennmaradni az emberben. A lehetséges kapcsolatokat is figyelni kell, ami egy-egy járvány idején több ezer lehet, részben az általános afrikai körülmények miatt. Gyorsan képes mutálódni, s új vírusfajjá alakulni. 1995-ben az egyik zairei járvány Kikwit város missziós kórházából indult ki, ahol nem volt orvos, a betegekkel félig képzett apácák foglalkoztak, akik naponta 5 új fecskendőt kaptak, amiket néha leöblítettek vízzel; gumikesztyű és sterilezés nélkül kezeltek több száz embert. A legfertőzőbb ágensek a levegőben is terjednek. Egy beteg úgy fertőzte meg orvosát, hogy vérhányása annak nyálkahártyáira: szemébe, szájába és kezére került. A szudáni altípus nem terjed cseppfertőzéssel, míg a zairei és a restoni igen.
Felfedezésének története
Először 1976-ban, a Kongói Köztársaságban azonosították, majd az eddigi legpusztítóbb járványt 1995-ben Zairében okozta. A vírus valószínűleg nem ember-specifikus, hanem a kórokozó egy ma még ismeretlen, vadon élő állatfajban (talán rágcsálókban vagy denevérben) tartja fönt magát, ahonnan olykor az emberi népességre vagy a csimpánzokra is átterjedhet. Nem képes tartósan fönnmaradni az emberi népességben.
Patogenezis
Tünetek, kórlefolyás
A különböző típusú Ebola vírusok által okozott megbetegedések klinikai megjelenésüket tekintve némiképp különböznek egymástól. A fertőzés után 2-25 nap lappangási időt követően jelentkeznek a betegség első tünetei. Az átlagos lappangási idő 4-10 nap,[2] a zaire típusú vírusnál egy 2011-es tanulmányban 13 napnak találták.[11] A betegség a vírusfertőzésekre általánosan jellemző, influenza-szerű tünetekkel indul, mint a rossz közérzet, láz, fejfájás, torokfájás, izomfájdalom és izomgyengeség. A később megjelenő tünetek utalnak a több szervrendszeri érintettségre, hiszen a torokgyulladás, köhögés, mellkasi fájdalom, nehézlégzés a légzőrendszer, az étvágytalanság, hányinger, hasi fájdalom és a hasmenés az emésztőrendszer, a fejfájás, zavartság, majd a később bekövetkező kóma az idegrendszer, míg a nyálkahártyákon majd a bőrön is megjelenő pontszerű vérzések, a testszerte kialakuló vizenyő és a vérnyomás csökkenése a véralvadás és az érrendszer érintettségét jelzi.[2]
A betegség tetőpontján, az első tünetektől számított 5-7. napon, kialakulnak a vérzéses lázra jellemző tünetek, melyek kedvezőtlen kimenetelt valószínűsítenek.[2] Laboratóriumi módszerekkel mindegyik betegben kimutatható a vérkeringés és véralvadás valamilyen mértékű zavara.[12] Az injekciós szúrások helyéről, illetve a nyálkahártyákról (bélrendszer, orr, fogíny, hüvely) származó vérzéseket a betegek 40-50 százalékában tapasztalnak. A bőrön pontszerű bevérzések (petechia), véraláfutások (ecchymosis), nagyobb vérömlenyek (haematoma) a betegek kb. felében vannak jelen.[12] A nyálkahártyavérzésekre utal a véres széklet (melaena), a vérhányás, vagy vér felköhögése a légutakból. A súlyos vérzések ritkák, rendszerint az emésztőrendszerben alakulnak ki.[13] A vérzésekből származó vérveszteség általában nem jelentős, a halált nem ez, hanem az ezzel párhuzamosan kialakuló többszervi elégtelenség (máj, vese) okozza, ami a szervezet folyadékháztartásának felborulása, az alacsony vérnyomás, a véralvadási zavarok (pl. disszeminált intravaszkuláris koaguláció, DIC) és szövetekben elszórtan kialakuló elhalások (necrosis) következtében alakul ki.[2]
A túlélők teljesen felépülhetnek a betegségből, a gyógyulási fázis azonban hosszú lehet, akár hetekig vagy hónapokig tarthat. A lábadozás alatt gyakori tünet a fejfájás, fogyás, ízületi fájdalmak, hajhullás, a tartós vérszegénység (anaemia).[14] Hetekkel a betegséget követően is kialakulhat a betegben szem-érhártya-gyulladás (uveitis) vagy heregyulladás (orchitis),[15] és még hetekig jelen lehet a beteg testnedveiben (pl. ondó) a vírus.[16]
Diagnosztika
A betegség diagnosztikájában alapvető a pontos anamnézis felvétele, különös tekintettel az olyan részletekre, hogy hol járt és milyen környezeti hatásoknak volt kitéve a beteg (pl. érintkezett-e vadállatokkal). Problémát jelent, hogy a betegség korai fázisában tapasztalt tüneteket sok más betegség is okozhatja, különösen azokon az afrikai területeken, ahol az Ebola is előfordul. Fertőző betegségek közül a többi vírus által okozott vérzéses láz, a Plasmodium falciparum okozta malária, a hastífusz, és a sigellózis is okozhat hasonló tüneteket. Ezek mellett felmerülhet még az akut promielocitás leukémia, hemolitikus urémiás szindróma, kígyómarás vagy a warfarin túladagolás is.[17] Pusztán a klinikai tünetek alapján az Ebolát nem lehet elkülöníteni a Marburg-vírus okozta vérzéses láztól,[2] a végső diagnózist laboratóriumi vizsgálatok szolgáltatják. Ezek közé tartozik az ELISA, mellyel a vírus antigénjeit mutatják ki a beteg vérszérumából,[18] vagy a RT-PCR, amivel a vírusra jellemző RNS szakaszok azonosíthatók.[19]
Kezelés
A betegségnek jelenleg nincsen specifikus kezelése, a terápia gyakorlatilag a támogató kezelésekre korlátozódik.[20] Figyelembe véve az érintett területek infrastrukturális és egészségügyi lehetőségeit, ennek biztosítása is komoly kihívást jelenthet.[20] Mivel a betegség kezdeti tünetei nem jellegzetesek, és a rendelkezésre álló laboratóriumi háttér is sokszor szegényes, a betegséget eleinte sokszor félrediagnosztizálják, a lázas beteget elkülönítés nélkül antibiotikummal vagy malária ellenes szerrel kezelik.[20]
Ebola esetén a beteget mindenképpen elkülönítik. Tüneti kezelésként fájdalomcsillapítókat, lázcsillapítókat, nyugtatókat és hányáscsökkentő gyógyszereket alkalmaznak, amennyiben rendelkezésre állnak.[20] A folyadékpótlás a kezelés egyik központi eleme, amennyiben lehetséges, a szájon át történő folyadékbevitelt preferálják, mivel így a vérzékeny és fertőző beteget nem kell megszúrni.[21]
Az elhunytakat gyorsan kell felboncolni, mert a szövetek a hűtés ellenére is elkocsonyásodnak; gyorsan és biztonságosan (vízhatlan zsákban, mésszel) kell eltemetni, még akkor is, ha az ellenkezik az adott nép temetkezési szokásaival.
További információk
- Centers for Disease Control and Prevention
- Fertőző Betegségek listája
- Kétyi I 2001. Két „egzotikus” vírus: a Marburg és az Ebola. Természet Világa, 132(6), 275.
Kapcsolódó szócikkek
Bibliográfia
- Ádám-Béládi-Gergely-Kétyi-Nász-Pusztai-Szabó: Orvosi mikrobiológia, egyetemi tankönyv, Bp., Semmelweis Kiadó, 1993
- Balázsy Sándor-Naár Zoltán: Mikrobiológiai alapok, főiskolai tankönyv, Nyíregyháza, Bessenyei György Könyvkiadó, 2003 ISBN 963-9385-70-0
- Jurányi Róbert-Vogronics Péterné: Mikrobiológiai és parazitológiai gyakorlatok, Bp. Medicina, 2002 ISBN 963-242-681-9
- Michael B.A. Oldstone: Vírusvadászok, Typotex, 2002 ISBN 963-9326-18-6
- Axmann Ágnes: Fertőző és trópusi betegségek, amelyek előfordulhatnak egzotikus utazásaink során, Bp., Alexandra, 2002 ISBN 963-368-198-7
- Richard Preston: Halálzóna – Ebola: a gyilkos vírus, Bp., Európa Könyvkiadó, 1995 ISBN 963-07-5832-6 – A restoni víruskitörés története
Hivatkozások
- ↑ Colebunders R, Borchert M. (2000. January). „Ebola haemorrhagic fever--a review.” (angol nyelven). J Infect. 40 (1), 16-20. o. DOI:10.1053/jinf.1999.0603. PMID 10762106.
- ↑ a b c d e f g Feldmann H, Geisbert TW. (2011. March). „Ebola haemorrhagic fever.” (angol nyelven). Lancet. 377 (9768), 849-62. o. DOI:10.1016/S0140-6736(10)60667-8. PMID 21084112.
- ↑ Groseth A, Feldmann H, Strong JE. (2007. September). „The ecology of Ebola virus.” (angol nyelven). Trends Microbiol. 15 (9), 408-16. o. DOI:10.1016/j.tim.2007.08.001. PMID 17698361.
- ↑ Salvaggio MR, Baddley JW. (2004. July). „Other viral bioweapons: Ebola and Marburg hemorrhagic fever.” (angol nyelven). Dermatol Clin. 22 (3), 291-302. o. DOI:10.1016/j.det.2004.03.003. PMID 15207310.
- ↑ Jaax N, Jahrling P, Geisbert T, Geisbert J, Steele K, McKee K, Nagley D, Johnson E, Jaax G, Peters C. (1995. December). „Transmission of Ebola virus (Zaire strain) to uninfected control monkeys in a biocontainment laboratory.” (angol nyelven). Lancet. 346 (8991-8992), 1669-71. o. DOI:10.1016/S0140-6736(95)92841-3. PMID 8551825.
- ↑ Johnson E, Jaax N, White J, Jahrling P. (1995. August). „Lethal experimental infections of rhesus monkeys by aerosolized Ebola virus.” (angol nyelven). Int J Exp Pathol. 76 (4), 227-36. o. PMID 7547435.
- ↑ Leffel EK, Reed DS. (2004). „Marburg and Ebola viruses as aerosol threats.” (angol nyelven). Biosecur Bioterror. 2 (3), 186-91. o. DOI:10.1089/bsp.2004.2.186. PMID 15588056.
- ↑ Kuhn JH, Becker S, Ebihara H, Geisbert TW, Johnson KM, Kawaoka Y, Lipkin WI, Negredo AI, Netesov SV, Nichol ST, Palacios G, Peters CJ, Tenorio A, Volchkov VE, Jahrling PB. (2010. December). „Proposal for a revised taxonomy of the family Filoviridae: classification, names of taxa and viruses, and virus abbreviations.” (angol nyelven). Arch Virol. 155 (12), 2083-103. o. DOI:10.1007/s00705-010-0814-x. PMID 21046175.
- ↑ Leffel EK, Reed DS. (2013. March). „Molecular evolution of viruses of the family Filoviridae based on 97 whole-genome sequences.” (angol nyelven). J Virol. 87 (5), 2608-16. o. DOI:10.1128/JVI.03118-12. PMID 23255795.
- ↑ Sayama Y, Demetria C, Saito M, Azul RR, Taniguchi S, Fukushi S, Yoshikawa T, Iizuka I, Mizutani T, Kurane I, Malbas FF Jr, Lupisan S, Catbagan DP, Animas SB, Morales RG, Lopez EL, Dazo KR, Cruz MS, Olveda R, Saijo M, Oshitani H, Morikawa S. (2012. June). „A seroepidemiologic study of Reston ebolavirus in swine in the Philippines.” (angol nyelven). BMC Vet Res. 8, 82. o. DOI:10.1186/1746-6148-8-82. PMID 22709971.
- ↑ Eichner M, Dowell SF, Firese N. (2011. June). „Incubation period of ebola hemorrhagic virus subtype zaire.” (angol nyelven). Osong Public Health Res Perspect. 2 (1), 3-7. o. DOI:10.1016/j.phrp.2011.04.001. PMID 24159443.
- ↑ a b Hoenen T, Groseth A, Falzarano D, Feldmann H. (2006. May). „Ebola virus: unravelling pathogenesis to combat a deadly disease.” (angol nyelven). Trends Mol Med. 12 (5), 206-15. o. DOI:10.1016/j.molmed.2006.03.006. PMID 16616875.
- ↑ Fisher-Hoch SP, Platt GS, Neild GH, Southee T, Baskerville A, Raymond RT, Lloyd G, Simpson DI. (1985. November). „Pathophysiology of shock and hemorrhage in a fulminating viral infection (Ebola).” (angol nyelven). J Infect Dis. 152 (5), 887-94. o. DOI:10.1093/infdis/152.5.887. PMID 4045253.
- ↑ Kortepeter MG, Bausch DG, Bray M. (2011. November). „Basic clinical and laboratory features of filoviral hemorrhagic fever.” (angol nyelven). J Infect Dis. 204 (Suppl 3), s810-6. o. DOI:10.1093/infdis/jir299. PMID 21987756.
- ↑ Rowe AK, Bertolli J, Khan AS, Mukunu R, Muyembe-Tamfum JJ, Bressler D, Williams AJ, Peters CJ, Rodriguez L, Feldmann H, Nichol ST, Rollin PE, Ksiazek TG. (1999. February). „Clinical, virologic, and immunologic follow-up of convalescent Ebola hemorrhagic fever patients and their household contacts, Kikwit, Democratic Republic of the Congo. Commission de Lutte contre les Epidémies à Kikwit.” (angol nyelven). J Infect Dis. 179 (Suppl 1), s28-35. o. DOI:10.1086/514318. PMID 9988162.
- ↑ Emond RT, Evans B, Bowen ET, Lloyd G. (1977. August). „A case of Ebola virus infection.” (angol nyelven). Br Med J. 2 (6086), 541-4. o. PMID 890413.
- ↑ Gear JH, Ryan J, Rossouw E. (1978. February). „A consideration of the diagnosis of dangerous infectious fevers in South Africa.” (angol nyelven). S Afr Med J. 53 (7), 235-7. o. PMID 565951.
- ↑ Niikura M, Ikegami T, Saijo M, Kurane I, Miranda ME, Morikawa S. (2001. September). „Detection of Ebola viral antigen by enzyme-linked immunosorbent assay using a novel monoclonal antibody to nucleoprotein.” (angol nyelven). J Clin Microbiol. 39 (9), 3267-71. o. DOI:10.1128/JCM.39.9.3267-3271.2001. PMID 11526161.
- ↑ Leroy EM, Baize S, Lu CY, McCormick JB, Georges AJ, Georges-Courbot MC, Lansoud-Soukate J, Fisher-Hoch SP. (2000. April). „Diagnosis of Ebola haemorrhagic fever by RT-PCR in an epidemic setting.” (angol nyelven). J Med Virol. 60 (4), 463-7. o. PMID 10686031.
- ↑ a b c d Clark DV, Jahrling PB, Lawler JV. (2012. September). „Clinical management of filovirus-infected patients.” (angol nyelven). Viruses. 4 (9), 1668-86. o. DOI:10.3390/v4091668. PMID 23170178.
- ↑ Borchert M, Mutyaba I, Van Kerkhove MD, Lutwama J, Luwaga H, Bisoborwa G, Turyagaruka J, Pirard P, Ndayimirije N, Roddy P, Van Der Stuyft P. (2011. December). „Ebola haemorrhagic fever outbreak in Masindi District, Uganda: outbreak description and lessons learned.” (angol nyelven). BMC Infect Dis. 11, 357. o. DOI:10.1186/1471-2334-11-357. PMID 22204600.

