Rövid hajtű-RNS
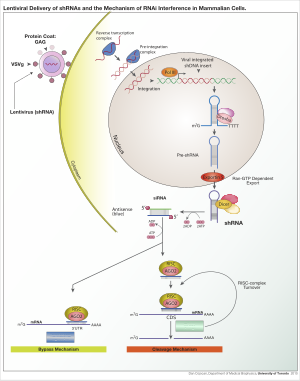
A rövid hajtű-RNS vagy kis hajtű-RNS (shRNS/hajtűvektor) célgén csendesítésére RNS-interferencia (RNSi) révén használható mesterséges RNS hajtűfordulóval.[1][2] Az shRNS expresszióját sejtekben általában plazmidok vagy vírus- vagy baktériumvektorok révén érik el. Az shRNS előnyös RNSi-mediátor kis bomlási és átalakulási sebessége miatt. Azonban expressziós vektort igényel, ezért mellékhatásokat okozhat orvosi használatkor.[3]
A promoterválasztás fontos a megfelelő shRNS-expresszióhoz. Először RNS-polimeráz III-promotereket, például U6-ot és H1-et használtak, de ezeknek nem volt térbeli és időbeli kontrolljuk.[3] Ezért RNS-polimeráz II-promoterekre váltottak az shRNS-expresszió-szabályzáshoz, melyek indukálhatók.
Beadás[szerkesztés]
Az shRNS-expresszió sejtekben plazmidokkal vagy vírus- vagy baktériumvektorokon keresztül érhető el.
A plazmidok transzfekcióval való bejuttatása az shRNS-expresszióhoz elérhető forgalomban kapható reagensekkel in vitro. Azonban ez nem alkalmazható in vivo, így kevéssé hasznos.
A bakteriális vektor shRNS-expresszióhoz való használata sejtekben 2006-ban jelent meg. Azon alapul, hogy az shRNS-tartalmú plazmiddal rendelkező rekombináns Escherichia coli egereknek adva a bélepitéliumban csökkentheti a célgénexpressziót.[4] Ezt 2012-ben klinikai kísérletekben használták familiális adenómás polipózis kezelésére.[5]
Számos vírusvektor használható sejtekben shRNS-expresszió elérésére, például ilyenek az adenoasszociált vírusok (AAV), az adenovírusok és a lentivírusok. Az adenoasszociált és adenovírusok esetén a genomok episzomálisak maradnak, ami előnyös, mivel nincs inzertációs mutagenezis, de a sejtosztódás útján történő vírusvesztés hátrány, ha a sejt gyorsan osztódik. Az AAV-k az adenovírusoktól a vírusgének hiányában térnek el, és kisebb a csomagolási képességük. A lentivírusok transzkripciósan aktív kromatinszakaszokba integrálnak, így az utódsejtek rendelkeznek velük. Ez növeli az inzertációs mutagenezis kockázatát, azonban ez csökkenthető integrázhiányos lentivírussal.[6]

Az in vitro termelt shRNS és dsRNS közvetlen transzfekcióra is használhatók.[8]
Hatásmechanizmus[szerkesztés]
Miután a vektor a gazdagenomba jutott, az shRNS-t a magban írja át promotertől függően az RNS-polimeráz II vagy III. A termék a pri-mikro-RNS-hez (pri-miRNS) hasonlít, és a Drosha dolgozza fel pre-shRNS-sé. Ezt az exportin 5 szállítja ki a magból. A terméket a Dicer feldolgozza és az RNS-indukált csendesítőkomplexbe helyezi. A szenz (utas) szál lebomlik, az antiszenz (vezető) a RISC-et komplementer mRNS-hez szállítja. Teljes komplementaritás esetén a RISC lebontja az mRNS-t, nem teljes esetén a RISC gátolja a transzlációt. Mindkét esetben az shRNS géncsendesítő.
Alkalmazása génterápiában[szerkesztés]
Mivel az shRNS specifikus, hosszú távú géncsendesítésre képes, sokan érdeklődnek az shRNS génterápiás alkalmazásában. 3 példája szerepel itt:
A Gradalis, Inc. az előrehaladott rákok kezelésére dolgozta ki a FANG-vakcinát. Ez bifunkciós shRNS-en (bi-shRNS) alapul immunszupresszív TGF–β1 és β2 átalakító növekedési faktorok ellen.[9] Autológ tumorsejteket távolítottak el betegekből és egy bi-shRNS-t és granulocita-makrofágkolónia-stimuláló faktort (GMCSF) kódoló plazmidot vittek be ex vivo elektroporációval. E sejteket később besugározták és visszainjektálták a betegekbe.
A Marina Biotech a CEQ508-at familiális adenómás polipózisra fejlesztette ki. Ez bakteriális vektort hordoz β-katenin-csendesítő shRNS-sel.
A Gradalis, Inc. bifunkciós shRNS-STMN1-et (pbi-shRNS STMN1) is fejlesztett előrehaladott vagy áttétes rákok ellen. Ez a sztatmin-1 ellen hat és intratumorálisan vihető be bilamellárisbemélyedésesvezikulum (BIV)-lipoplexszel (LP).
Több kihívás is megjelenik az shRNS-alapú terápiában, a legfontosabb a bevitel. Az shRNS gyakran vektorral kerül be, s bár általában hatékonyak, jelentős biztonsági kockázatok. Különösen a vírusalapú génterápiák bizonyultak veszélyesnek korábbi klinikai kísérletekben. Az első generációs retrovirális génterápiában egyes vírusvektorral kezelt Wiskott–Aldrich-szindrómás betegekben akut T-sejtes leukémia jelentkezett. Erről kiderült, hogy a vektorinzertáció helye okozta.[10] A potenciális RISC-túltelítődés is probléma. Ha az shRNS expressziós szintje túl magas, a sejt nem feltétlenül tudja helyesen feldolgozni az endogén RNS-t, mely jelentős probléma lehet. Ezenkívül a beteg immunválaszt is kiválthat a terápia ellen.[11] Végül lehetnek nem specifikus hatások és az shRNS nem megfelelő géneket is csendesíthet. A sikeres shRNS-alapú terápiákban ezek is figyelembe veendők.
A nem specifikus RNSi-hatásokat csökkenti a magi és a 3′-régiókban lévő gyenge bázispárosodás.[12]
Az shRNS-ek bevihetők siRNS-expresszáló plazmidokkal is.[13]
Jegyzetek[szerkesztés]
- ↑ Paddison PJ, Caudy AA, Bernstein E, Hannon GJ, Conklin DS (2002. április 1.). „Short hairpin RNAs (shRNAs) induce sequence-specific silencing in mammalian cells”. Genes & Development 16 (8), 948–958. o. DOI:10.1101/gad.981002. PMID 11959843.
- ↑ Brummelkamp TR, Bernards R, Agami R (2002. április 1.). „A system for stable expression of short interfering RNAs in mammalian cells”. Science 296 (5567), 550–553. o. DOI:10.1126/science.1068999. PMID 11910072.
- ↑ a b Wang Z, Rao DD, Senzer N, Nemunaitis J (2011. december 1.). „RNA interference and cancer therapy”. Pharmaceutical Research 28 (12), 2983–2995. o. DOI:10.1007/s11095-011-0604-5. PMID 22009588.
- ↑ Xiang S, Fruehauf J, Li CJ (2006. június 1.). „Short hairpin RNA-expressing bacteria elicit RNA interference in mammals”. Nature Biotechnology 24 (6), 697–702. o. DOI:10.1038/nbt1211. PMID 16699500.
- ↑ Burnett JC, Rossi JJ, Tiemann K (2011. szeptember 1.). „Current progress of siRNA/shRNA therapeutics in clinical trials”. Biotechnology Journal 6 (9), 1130–46. o. DOI:10.1002/biot.201100054. PMID 21744502.
- ↑ Lombardo A, Genovese P, Beausejour CM, Colleoni S, Lee YL, Kim KA, Ando D, Urnov FD, Galli C, Gregory PD, Holmes MC, Naldini L (2007. november 1.). „Gene editing in human stem cells using zinc finger nucleases and integrase-defective lentiviral vector delivery”. Nature Biotechnology 25 (11), 1298–1306. o. DOI:10.1038/nbt1353. PMID 17965707.
- ↑ Macrae IJ, Zhou K, Li F, Repic A, Brooks AN, Cande WZ, Adams PD, Doudna JA (2006. január 1.). „Structural basis for double-stranded RNA processing by Dicer”. Science 311 (5758), 195–198. o. DOI:10.1126/science.1121638. PMID 16410517.
- ↑ Aradi J, Balajthy Z, Csősz É, Scholtz B, Szatmári I, Tőzsér J, Varga T. 12. Géncsendesítő terápiák, Molekuláris terápiák, 115. o.. Hozzáférés ideje: 2024. április 17.

- ↑ Senzer N, Barve M, Kuhn J, Melnyk A, Beitsch P, Lazar M, Lifshitz S, Magee M, Oh J, Mill SW, Bedell C, Higgs C, Kumar P, Yu Y, Norvell F, Phalon C, Taquet N, Rao DD, Wang Z, Jay CM, Pappen BO, Wallraven G, Brunicardi FC, Shanahan DM, Maples PB, Nemunaitis J (2012. március 1.). „Phase I trial of "bi-shRNAi(furin)/GMCSF DNA/autologous tumor cell" vaccine (FANG) in advanced cancer”. Molecular Therapy 20 (3), 679–686. o. DOI:10.1038/mt.2011.269. PMID 22186789.
- ↑ Persons DA, Baum C (2011. február 1.). „Solving the problem of γ-retroviral vectors containing long terminal repeats”. Molecular Therapy 19 (2), 229–231. o. DOI:10.1038/mt.2010.305. PMID 21289636.
- ↑ Whitehead KA, Dahlman JE, Langer RS, Anderson DG (2011). „Silencing or stimulation? siRNA delivery and the immune system”. Annual Review of Chemical and Biomolecular Engineering 2, 77–96. o. DOI:10.1146/annurev-chembioeng-061010-114133. PMID 22432611.
- ↑ Gu S, Zhang Y, Jin L, Huang Y, Zhang F, Bassik MC, Kampmann M, Kay MA (2014. október 29.). „Weak base pairing in both seed and 3′ regions reduces RNAi off-targets and enhances si/shRNA designs”. Nucleic Acids Res 42 (19), 12169–12176. o. DOI:10.1093/nar/gku854.

- ↑ Rácz Zs, Hamar P (2008. január 27.). „SiRNS-technológia, a jövő génterápiája”. Orv Hetil, 153–159. o. DOI:10.1556/OH.2008.28289.

Fordítás[szerkesztés]
Ez a szócikk részben vagy egészben a Short hairpin RNA című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
| Az itt található információk kizárólag tájékoztató jellegűek, nem minősülnek orvosi szakvéleménynek, nem pótolják az orvosi kivizsgálást és kezelést. A cikk tartalmát a Wikipédia önkéntes szerkesztői alakítják ki, és bármikor módosulhat. |
