Szalicilaldehid
| szalicilaldehid | |||
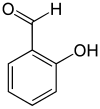 szerkezeti képlet |
 pálcikamodell | ||
| IUPAC-név | 2-hidroxibenzaldehid[1] | ||
| Más nevek | szalicilaldehid o-hidroxibenzaldehid | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 90-02-8 | ||
| ChemSpider | 13863618 | ||
| ChEBI | 16008 | ||
| |||
| |||
| InChIKey | SMQUZDBALVYZAC-UHFFFAOYSA-N | ||
| UNII | 17K64GZH20 | ||
| ChEMBL | 108925 | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C7H6O2 | ||
| Moláris tömeg | 122,12 g/mol | ||
| Sűrűség | 1,146 g/cm3 | ||
| Olvadáspont | −7 °C | ||
| Forráspont | 196–197 °C | ||
| Oldhatóság (vízben) | kevéssé[2] | ||
| Oldhatóság | alkoholban és éterben korlátlanul[2] | ||
| Mágneses szuszceptibilitás | −64,4·10−6 cm3/mol | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A szalicilaldehid (2-hidroxibenzaldehid) szerves vegyület, képlete C6H4CHO-2-OH.[4] A 3- és 4-hidroxibenzaldehiddel együtt a három hidroxibenzaldehid izomer egyike. Színtelen, nagyobb koncentrációban keserűmandula illatú, olajszerű folyadék. Számos kelátképző előállításának fontos kiindulási anyaga.
Előállítása[szerkesztés]
Reimer–Tiemann-reakcióval állítják elő fenolból és kloroformból, nátrium- vagy kálium-hidroxid jelenlétében történő hevítéssel:[5]
Másik előállítási útja a fenol vagy származékainak formaldehiddel végzett kondenzációja, majd a keletkező hidroxibenzil-alkohol aldehiddé történő oxidációja.
Általánosan szalicilaldehideket a megfelelő fenolból Duff-reakcióval lehet előállítani, vagy paraformaldehiddel történő kezeléssel magnézium-klorid és bázis jelenlétében.[6]
Előfordulása[szerkesztés]
A hajdina illatanyagának egyik jellegzetes összetevője.[7]
Az illatszeriparban használt kasztoreum – az ivarérett kanadai (Castor canadensis) és az eurázsiai hód (Castor fiber) szagmirigyéből nyert váladék – egyik összetevője. A fentieken kívül több – a levélbogárformák (Chrysomelinae) alcsaládba tartozó – levélbogárféle lárvájának váladékában is megtalálható.[8] Az egyik, szalicilaldehidet termelő levélbogárféle a nagy nyárlevelész (Chrysomela populi).
Reakciói és felhasználása[szerkesztés]
Szalicilaldehidből állítják elő:
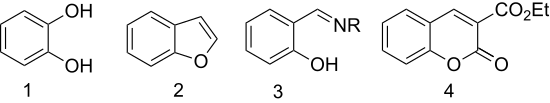
1. Hidrogén-peroxiddal oxidálva pirokatechinné (1,2-dihidroxibenzol) alakul (Dakin-oxidáció).[9]
2. Klórecetsavas éterképzés, majd azt követő gyűrűzárás révén heterociklusos vegyület, benzofurán (kumaron) képződik.[10]
3. Aminokkal kondenzálva kelátképző ligandumok képződnek. Etilén-diaminnal szalén keletkezik, hidroxil-aminokkal szalicilaldoximot ad.
4. Dietil-malonáttal aldolkondenzációs reakcióban 3-karbetoxikumarin (a kumarin egyik származéka) jön létre.[11]
Jegyzetek[szerkesztés]
- ↑ Front Matter, Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry, 652. o.. DOI: 10.1039/9781849733069-FP001 (2014. május 2.). ISBN 978-0-85404-182-4
- ↑ a b Römpp vegyészeti lexikon: Negyedik kötet Q–Zs. Budapest: Műszaki Könyvkiadó, 311. o. (1984). ISBN 963 10 4749 0
- ↑ a b c Sigma-Aldrich Salicylaldehyde MSDS, hozzáférés dátuma: 2018-05-24
- ↑ Merck Index, 11th Edition, 8295
- ↑ Ullmann Vegyipari Enciklopédia
- ↑ (2005) „Ortho-Formylation of Phenols; Preparation of 3-Bromosalicylaldehyde”. Org. Synth. 82, 64. o.
- ↑ (2008) „Salicylaldehyde is a characteristic aroma component of buckwheat groats”. Food Chemistry 109 (2), 293–298. o. DOI:10.1016/j.foodchem.2007.12.032. PMID 26003350.
- ↑ Pauls, G., Becker, T., et al. (2016). Two Defensive Lines in Juvenile Leaf Beetles; Esters of 3-nitropropionic Acid in the Hemolymph and Aposematic Warning. Journal of Chemical Ecology 42 (3) 240-248.
- ↑ Dakin, H. D. (1923). „Catechol”. Org. Synth. 3, 28. o. ; Coll. Vol. 1: 149
- ↑ Burgstahler, A. W.; Worden, L. R. (1966). „Coumarone”. Org. Synth. 46, 28. o. ; Coll. Vol. 5: 251
- ↑ Horning, E. C.; Horning, M. G.; Dimmig, D. A. (1948). „3-Carbethoxycoumarin”. Org. Synth. 28, 24. o. ; Coll. Vol. 3: 165
Fordítás[szerkesztés]
- Ez a szócikk részben vagy egészben a Salicylaldehyde című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.


