Majomhimlő
| Majomhimlő | |
 | |
| Majomhimlő okozta kiütések | |
| Angolul | Monkeypox vagy mpox |
| BNO-10 | B04 |
| BNO-9 | 059.01 |
| Leírás | |
| Főbb tünetek | Láz, nyirokcsomó megnagyobbodás, hólyagos bőrelváltozás |
| Szövődmények | Szemfertőzés, látásvesztés, hegesedés |
| Megelőzés | Himlő elleni védőoltás |
A Wikimédia Commons tartalmaz Majomhimlő témájú médiaállományokat. | |
A majomhimlő fertőzőbetegséget (angolul: monkeypox vagy mpox[1][2]) a Poxviridae család orthopoxvírus nemzetségébe tartozó, dupla szálú DNS-t tartalmazó, zoonózisos majomhimlő vírus okozza.[3] A betegség – amelynek tünetei 2-4 hétig tartanak – emberen és több állatfajon is előfordul, állatról emberre vagy egyik személyről a másikra terjed, a bőrön felszakadó hólyagok szövetnedvével, testnedvekkel, légutakból kijutó cseppekkel és a beteg közvetlen környezetéből származó szennyezett anyagokkal.[4][5][6] Emberen a fertőzés lázzal, nyirokcsomó megnagyobbodással, jellegzetes hólyagos bőrelváltozással jár együtt. A 3-6% körüli halálozási arányú betegség a túlélőknél számos szövődmény kialakulásához vezethet.[4]
A majomhimlő járványtani története[szerkesztés]

A majomhimlő vírust először 1958-ban észlelték majmokon, egy koppenhágai kutatóintézetben, majd 1959-ben jelentették, mint egy újszerű, himlőhöz hasonló fertőzőbetegséget.[7] Az orvostudomány történetében az első emberi majomhimlős esetet akkor ismerték fel, amikor 1970. szeptember 1-jén egy kilenc hónapos csecsemőt felvettek a Kongói Demokratikus Köztársaság Basankusu-i kórházába.[8] A fiúnak atipusos himlőszerű betegsége volt, amelyből majomhimlő vírusokat izoláltak.[9] Eleinte a virológusok előtt nem volt világos, hogy az emberen előforduló vírus genetikailag teljesen azonos a majmokon észlelt vírussal.[10] Ezt követően, 1970 októbere és 1971 májusa között három nyugat-afrikai országból (Nigériából, Libériából és Sierra Leonéból) további hat humán esetet jelentettek a WHO-nak.[11] Az 1970-es évek óta több ezer embernél diagnosztizáltak majomhimlőt a világ 15 országban, ebből 11-et afrikai országokban. A vírus elsősorban Közép-Afrika és Nyugat-Afrika trópusi erdeiben fordult elő. A megbetegedést behurcolták az Egyesült Királyságba, az USA-ba, Izraelbe és Szingapúrba, ahol a fertőzés tovaterjedését sikerrel megakadályozták.[12]
Az első, Afrikán kívüli majomhimlőjárványt 2003-ban regisztrálták az Amerikai Egyesült Államokban, ahol a fertőzés elterjedése Ghánából importált erszényes patkányokkal és az azokkal érintkező prérikutyákkal volt kapcsolatos. Ez a járvány több mint 70 embernél majomhimlős megbetegedést eredményezett az Egyesült Államokban.[13]
Az elmúlt években a fertőzés esetszámai – úgy Afrikában, mint globálisan – emelkedni látszott. Nigériában 2017 óta a majomhimlő járványszerű elterjedését jelenti a WHO, melyben több mint 500 gyanús fertőzést és további több mint 200 (3%-os halálozási aránnyal) megerősített esetet írtak le. Emiatt fennáll annak veszélye, hogy az Afrikában rendszeresen fellobbanó járvány más kontinensen is állandó (esetleg lappangó) járványgócokat hoz létre.[12] A járványügyi szakemberek aggodalma nem alaptalan. Utazók, vendégmunkások és turisták 2018 szeptemberében Nigériából Izraelbe, továbbá az Egyesült Királyságba négy alkalommal (2018 szeptember, 2019 december, 2021 május, 2022 május) hurcolták be a vírust. A vírus Ázsiába is eljutott, ahol Szingapúrban 2019 májusában regisztrálták az első beteget. Az Egyesült Államokban 2021-ben két alkalommal is (július és november) felütötte a fejét a majomhimlő. A felsorolt esetek mind a nigériai járványos területről származtak.[5] 2022 májusában több, nem endémiás országban is (így Magyarországon is) azonosítottak egy vagy több majomhimlős esetet. Jelenleg a WHO égisze alatt nemzetközi összefogással vizsgálatok folynak a majomhimlőjárvány dinamikájának, a fertőzés forrásainak és az átviteli módok további megértése érdekében. Nigériából a mai napig folyamatosan jelentenek megbetegedéseket.[5]
A majomhimlő elnevezés eredete[szerkesztés]
A majomhimlő vírust először egy koppenhágai kutatóintézet állatházában észlelték 1958-ban, ahol mintegy 30 makákómajom (Macaca fascicularis) járványszerűen betegedett meg 50 nappal azután, hogy a szállítmány Szingapúrból elindult. A himlőszerű fertőzés esettanulmányát 1959-ben publikálta a betegség felfedezője – Preben von Magnus dán virológus – egy skandináv szaklapban,[7] ahol az új vírusbetegség „majomhimlő” (monkeypox) elnevezéssel került be a tudomány világába.[14][15] Az esemény publikálása idején még nem tudhatták az esetet ismertető szerzők, hogy a betegség vírusa más fajokon is előfordul (rágcsálókon, emberen) néha nagyobb gyakorisággal, mint majmokon. A majomra utaló név a mai napig használatban maradt. Az elnevezés második fele a „himlő” szórészt a fekete himlőre hasonlító tünetek miatt kapta a betegség.[16]
A majomhimlő várható átnevezése[szerkesztés]
2022-ben több mint 30 nemzetközileg elismert szakember (epidemiológus, virológus, infektológus) aláírt egy szakmailag jól alátámasztott dokumentumot, amelyben felhívták a világ közvéleményének figyelmét, hogy sürgős szükségét érzik a „majomhimlő” elnevezés megváltoztatásának. Érvként azt hozták fel, hogy a jelenlegi elnevezés kirekesztő és megbélyegző hatást kelt, mert „A médiában és a tudományos életben egyre több olyan kijelentés születik, amely a jelenlegi globális járványkitörést Afrikához, Nyugat-Afrikához vagy Nigériához próbálja kötni”. Az aláírók azt is javasolják, hogy a hírsajtó ne használjon afrikai emberekről készült, himlős elváltozásokat bemutató illusztrációkat.[* 1] A dokumentum megjelenését követően a WHO főigazgatója bejelentette, hogy a szervezet mérlegeli a vírus átnevezését, mert az afrikai térség hibáztatására ad okot a majomhimlő elnevezés.[5][17]
A betegség lefolyása[szerkesztés]


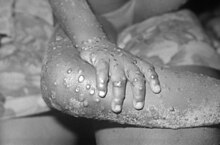
Az emberi majomhimlő-fertőzés klinikai jellemzőinek többsége a globálisan felszámolt fekete himlő jellemzőit tükrözi.[18]
A majomhimlő-fertőzés inkubációs ideje[* 2] jellemzően 6-13 nap, de 5-21 nap közötti inkubáció is előfordulhat.[4] Az inkubációs periódust követő ún. inváziós periódusra (1–4 nap) jellemző a kezdeti magas láz, az általánossá váló erős fejfájás, levertség, eluralkodó fáradtság, amelyet hátfájás vagy kiterjedő izomfájdalom kísér. A betegségnek ebben a fázisában még nincsenek a bőrön hólyagok, kiütések. Az inváziós szakaszban kemény, jól tapintható, 1–4 cm átmérőjű nyirokcsomó duzzanatok jelennek meg a nyakon vagy a lágyék tájon. A megnagyobbodott nyirokcsomók nyomásra rendszerint érzékenyek vagy fájdalmasak. [* 3][19]
A beteg bőre duzzadttá válik, és megjelennek a kiütések. A magas láz (38,5–40,5 °C) gyakran csökken a kiütések kialakulásának napján vagy az azt követő 1–3 napban. A kiütések általában az arcon jelennek meg először, majd a következő napon a test többi részére is átterjednek. A himlős megbetegedésekre oly jellemző bőrelváltozások egy fejlődési folyamatot mutatnak, amit a medicina sorrendben makula,[* 4] papula,[* 5] hólyag és végül pusztulaként[* 6] ír le.[20] A bőrelváltozások száma széles határok között mozog (néhány darab és ezer). A fertőzés későbbi szakaszában előfordulhatnak hólyagszerű képletek a szájüreg különböző pontjain – így a nyelven is – amelyek a beteg számára fájdalmassá teszik a rágást és az ivást.[21]
Gyakran előfordul, hogy a beteg ismét lázassá válik, ami legtöbbször a felszakadó hólyagok másodlagos bakteriális fertőzésének a jele. A bőr fertőzéses területei begennyesedhetnek, ami a beteg általános állapotának gyors romlásával jár együtt.[22] Szemfertőzések fordulhatnak elő, amelyek szaruhártya hegesedést és súlyosabb esetben tartós látásvesztést okozhatnak.[9][22] A majomhimlő-fertőzés következményeként súlyos szövődmények léphetnek fel a betegség lefolyásának késői szakaszában. Nem ritka a tüdőgyulladás, hányás, hasmenés és annak következményeként fellépő kiszáradás. Főleg gyerekeknél léphetnek fel szövődmények, ezért az esetükben nagyobb lehet a halálozási arány. A korábban feketehimlő ellen oltott páciensek esetében az ismertetett majomhimlős tünetek lényegesen enyhébbek, a szövődmények ritkábbak.[4]
A betegség kezelése[szerkesztés]
Kifejezetten a majomhimlő-fertőzés kezelésére használt – klinikailag bizonyított – módszerek nem ismertek. Mint a legtöbb vírusos betegségnél, a kezelés ebben az esetben is az ún. támogató tünetkezelés. Ezek lehetnek lázcsökkentő szerek, vagy a másodlagos bakteriális fertőzések kezelésére alkalmazott antibiotikumok, esetleg a szövődmények megelőzését szolgáló szerek. Súlyos esetekben egyéni elbírálás alapján mérlegelhető olyan antivirális[* 7] farmakonok alkalmazása, amelyek állatkísérletekben bizonyítottan előnyösek voltak az ortopoxvírusokkal szemben. Az orális[* 8] DNS-polimeráz[* 9] inhibitor brincidofovir, az ugyancsak orális intracelluláris vírus felszabadulásgátló tecovirimat szóba jöhet az életveszélyes állapotú beteg kezelésére azzal a megjegyzéssel, hogy ezeknek a szereknek a majomhimlő kezelésére vonatkozó pontos hatékonyságuk még nem kellően ismert.[4]
A beteg kezelése mellett vannak olyan megelőző intézkedések is, amelyek segíthetnek megelőzni a fertőzés továbbadását vagy továbbterjedését. A fertőzött betegnek elkülönítve kell maradnia, sebészi maszkot kell viselnie a cseppfertőzés kivédése érdekében. A bőrön jelentkező elváltozásokat a lehető legnagyobb mértékben be kell fedni, amíg az összes hólyag természetes úton le nem szárad és esik, illetve ameddig a beteg felület új, egészséges bőrréteget nem képez.[4][5]
A fertőzésnek fokozottan kitett egyének (ápolószemélyzet, családtagok stb.) esetében a testhőmérsékletet és a betegségre utaló tüneteket 21 napon keresztül[* 10] naponta kétszer ellenőrizni kell. A fertőzőképesség összhangban van a tünetek megjelenésével, ezért a csak „feltehetően” fertőzött, gyanús személyt nem szükséges elkülöníteni, amíg tünetmentes (nincs láz, fejfájás, a nyaki nyirokcsomók nem tapinthatók stb.).
Bizonyos esetekben, egy „magas kockázatú” expozíció utáni vakcinázás a lappangási idő alatt az Ankara vakcinával elfogadott lehet, amelyet a fertőzés után a lehető leghamarabb el kell kezdeni. A CDC szerint az expozíciót követő négy napon belüli oltás megakadályozhatja a betegség kialakulását, illetve a 14 napon belüli vakcinabeadás csökkentheti a betegség súlyosságát.[23]
A majomhimlő és a fekete himlő közötti hasonlóság[szerkesztés]
Az emberiség történetének egyik legpusztítóbb fertőző betegsége a fekete himlő[* 11] a Poxvirus variolae vírus által okozott betegség, melyet globálisan teljesen felszámoltak. A majomhimlő klinikai képe nagyon hasonlít a himlőre, de annál kevésbé fertőző, lassabban terjed és a betegek halálozási aránya is jóval alacsonyabb (3-10 %) szemben a himlő 30%-os halálozási arányával. A természetes úton szerzett fekete himlő utolsó fertőzéses esetét 1977-ben regisztrálták és 1980-ban a himlőt világszerte felszámolt fertőzőbetegséggé nyilvánították egy globális oltási és izolációs kampány után. Az alkalmazott vakcinák egy életre szóló védettséget biztosítottak az oltottaknak, amely többé-kevésbé keresztvédettséget is biztosít más himlőféleségekkel – így a majomhimlővel – szemben is. A védettség erősségét >80 %-ra becsülik, amely számos tényezőtől (vakcina típusa, életkor, egyéb fertőzések, életviteltől, egészségi állapottól, más alapbetegségektől) is függ. Mivel több mint 40 év telt el azóta, hogy minden ország beszüntette a rutinszerű himlő elleni védőoltást, ezért a be nem oltott fiatal korosztály ma már érzékenyebb a majomhimlő vírusfertőzéssel szemben.[5][6]
A kórokozó vírus jellemzése[szerkesztés]
A majomhimlő betegség kórokozója a Poxviridae család Orthopoxvirus nemzetségéhez tartozó majomhimlő zoonózisos vírus (MPV vagy MPXV).[3] Az Orthopoxvirus nemzetségbe többek között olyan ismert vírusuk tartoznak, mint a fekete himlő vírusa (VACV) a fekete himlő elleni vakcinák készítéshez használatos ún. vakcina vírus (VACV), a tehénhimlö vírus (CPX) vagy a tevehimlö vírus. Nem közvetlen őse és nem is közvetlen leszármazottja a himlőt okozó variola vírusnak.[24]
A többi ortopoxvírussal azonos morfológiai jellemzőket mutató majomhimlő virionok[* 12] kissé ovális, tégla formátumú (200 x 250 nm) részecskék, amelyeket lipoprotein membránburok vesz körül.[12] A molekulárisan kompakt csomagolású virion lipidburkolata alatt a kettős szálú DNS-genomot (~197 kb), a transzkripciós faktorokat, valamint a sejtbe jutás után a szaporodás elindításához szükséges enzimeket tartalmazza. A DNS-vírus teljes életciklusa alatt a fertőzött sejtek citoplazmájában helyezkedik el, a gazdasejt sejtmagjába nem hatol be.[12]
Mai tudásunk szerint a vírusnak két különböző genetikai variánsa van: a közép-afrikai (Kongó-medencében elterjedt) variáns és a nyugat-afrikai variáns. A kongó-medencei variáns történelmileg súlyosabb betegségeket okozott, és úgy gondolták, hogy fertőzőképessége is felülmúlja a nyugat-afrikai variáns eme képességét. A vírusvariánsok általában földrajzi megosztottságot mutatva, egymástól elkülönülve okoznak járványokat. Eddig Kamerun volt az egyetlen ország, ahol mindkét variánst azonosították.[5]
Vírushordozó fajok[szerkesztés]
A Poxviridae családba tartozó himlővírusokat ősi vírusoknak is nevezik, mert rovarokban, hüllőkben, madarakban és emlősökben is megtalálhatók.[25] A tudomány mai állása szerint ezek a vírusok a törzsfejlődés során a már a gerinctelenek és gerincesek szétválása előtt is jelen voltak az állatvilágban és valamiféle „himlős betegséget” okoztak.[26] Mindezeket figyelembe véve nem meglepő, hogy a Poxviridae családba tartozó majomhimlő kórokozója zoonózisos vírus, tehát több állatfajban megtalálható, a fajok között terjedő vagy lappangó – az emberre is átvihető – vírus.[27]
Egy fertőzőbetegség dinamikájának[* 13] megismerése a járvány kiterjedésének megakadályozása érdekében az epidemiológia egyik fontos feladata. Járványtani szempontból fontos tudni, hogy milyen fajok hordozzák a vírust és ezek közül melyek azok, amelyek potenciálisan alkalmasak az ember megfertőzésére. Különös figyelemmel vizsgálják az ember környezetében gyakori háziállatokat (haszonállat, kutya, macska stb.), azok potenciális fertőzhetőségét.[28]
A majomhimlő vírusát potenciálisan hordozni és továbbadni képes állatfajok felkutatása, a fertőzés valószínű forrásának meghatározása nemzetközi összefogással jelenleg is folyamatban van. A WHO megállapítása szerint a közelmúltban sok állatfaj ismertté vált, de még korántsem ismert az összes, ezért továbbra is bizonytalanság áll fenn a majomhimlő vírusának természetrajzával kapcsolatban, és további vizsgálatokra van szükség a pontos hordozók és a fertőzés dinamikájának megismeréséhez.[5][29]
Az eddig azonosított állatfajok (a teljesség igénye nélkül):[30][31][32]
- - makákómajom
- - emberszabású majmok
- - kötélmókusok (Funisciurus congicus)
- - mókusfélék (Sciuridae)
- - gambiai erszényes patkányok (Cricetomys gambianus)
- - ecsetfarkú pelék (Graphiurinae)
- - prérikutya (Cynomys)
A majomhimlő emberekről kutyákra és macskákra történő átvitelének kockázatát rendkívül alacsonynak tartják, de ez részben a vizsgált esetek alacsony számából is adódhat. Tény, hogy fertőzött kutyát vagy házimacskát a járványügyi hatóságok eddig még nem jelentettek. A rágcsálók (egér, patkány, nyúl) fertőzhetősége ezzel szemben magas, de a hörcsög és tengerimalac a kísérletes fertőzéseknek rendkívül jól ellenállt.[33][34]
Vírusátadás[szerkesztés]
A klinikai tapasztalatok szerint az emberi majomhimlő-fertőzés létrejöttének három lehetséges útja
- - a fertőzött állatról emberre
- - a fertőzött emberről másik emberre
- - egy fertőzött tárgyról emberre történő vírusátjutás.
A járványtan az állatról emberre való átjutást zoonózisos átvitelnek nevezi, melynek során a fertőzés az állat vérével, testnedvével, bőrével vagy nyálkahártyájával való közvetlen érintkezésből eredhet, vagy olykor a gazdaszervezet (állat) elfogyasztása révén történik. A fertőzött állatok nem megfelelően főtt húsának és egyéb állati termékeinek fogyasztása lehetséges kockázati tényező.[12] Afrikában számos állatban találtak bizonyítékot lezajlott vagy aktív majomhimlő-fertőzésre, de a vírus természetes hordozóját mind ez ideig nem sikerült azonosítani, bár a rágcsálókat tartják a legvalószínűbbnek. A rágcsálókra vonatkozó aggodalmak azért is figyelemre méltók, mert a nagyvárosok csatornarendszerében élő és az ember közvetlen közelébe jutó patkányok, egerek komoly veszélyforrást jelenthetnek.[5]
Az emberről emberre történő fertőzés a légzőszervi váladékokkal (cseppfertőzés), a fertőzött személy bőrelváltozásaival vagy az azokból kikerülő szöveti váladékkal való szoros érintkezésből eredhet. A légzőszervi váladékcseppeken keresztül történő vírus átvitel általában hosszan tartó ún. szemtől-szembe való érintkezést igényel, ami elsősorban az egészségügyi dolgozók esetében vagy a fertőzött beteggel egy háztartásban élő személyeknél jelent nagyobb kockázatot.[35] A fertőzés placentán keresztül is előfordulhat, így az anyáról a magzatra átterjedhet, ami veleszületett majomhimlőt eredményez.[36] Bár a fertőzött személlyel való szoros fizikai érintkezés a vírusátvitel jól ismert kockázati tényezője, jelenleg nem világos, hogy a majomhimlő kifejezetten szexuális átviteli útvonalakon keresztül továbbítható-e.[37] A WHO és CDC megállapításai szerint további vizsgálatokra, tanulmányokra van szükség ahhoz, hogy jobban megértsük ezt a kockázatot.[5][6] A szexuális úton való terjedés kockázatának megállapítása jelenleg az orvostudomány központi kérdése. A római székhelyű Spallanzani Institute kutatói több fertőzött beteg spermáját vizsgálták meg (2022. május), amelyekben kimutatták a vírus egyes alkotórészeit, továbbá a vírus örökítő anyagát. A minták vizsgálata során a szakemberek arra a következtetésre jutottak, hogy a vírus a spermán keresztül képes volt fertőzni, és a fertőzött személyben szaporodni.[38]
A beteg közvetlen környezetéből származó, – ezért fertőzővé vált – tárgyak is közvetíthetik a vírust. Potenciális veszélyt jelenthet a beteg ruházata ágyneműje, evőeszközei.[6]

Védőoltás[szerkesztés]
A fekete himlő megelőzésére korábban széles körben alkalmazott védőoltásról bebizonyosodott, hogy körülbelül 85%-ban hatékony a majomhimlő-fertőzés megelőzésében. Nagy mértékben képes csökkenti a fertőzés valószínűséget, vagy enyhébb lefolyású betegséget eredményez mindazoknál, akik korábban (jellemzően gyermekkorban) immunizálva lettek. A himlő elleni védőoltást – a fekete himlő globális felszámolása után – világszerte megszüntették. Magyarországon a himlő elleni védőoltás megszüntetéséről 1979-ben született döntés, majd az ezt követő években – a készletek felhasználásával – fokozatosan kivezetésre került.[39] A beoltott személyek felkarján az oltás bizonyítéka a kör alakú heg. A himlő elleni védettség – és így a majomhimlő elleni keresztvédettség is – elméletileg élethosszig fennáll. Mivel a himlő lassan fél évszázada nem okoz fertőzést, ezért az empirikus úton számolt, vagy állatmodelleken meghatározott „élethosszig tartó” immunitásnak az ellenőrzése nem lehetséges. Egyes szakértők kételkednek abban, hogy az 50 évvel ezelőtt oltottak elegendő immunitással rendelkeznek egy esetleges fertőzéssel szemben.[40] Ezen félelmeknek ellentmondanak azok a megfigyelések, miszerint a járvány sújtotta területeken a himlő ellen oltottak között a fennálló keresztimmunitás miatt alacsonyabb a majomhimlős fertőzések aránya. Jelenleg az eredeti (első generációs) himlő elleni vakcinák – néhány ritka kivételtől eltekintve – már nem állnak az egészségügy rendelkezésére. Mindezekből az következik, hogy az 1979 után születettek nem védettek a majomhimlő ellen és ez részben magyarázatot is ad arra vonatkozóan, hogy napjainkban miért terjedhet könnyen a majomhimlő.[41]
2019-ben az orthopoxvirusok ellen, azok megelőzésére egy módosított, (gyengített, élő) vaccinia víruson (Ankara törzs) alapuló, új oltóanyagot hoztak forgalomba, amelyet az amerikai U.S. Food and Drug Administration jóváhagyott és engedélyezett.[42] Ez egy kétadagos vakcina, amelynek elérhetősége továbbra is korlátozott. Megelőzési céllal olyan személyek számára ajánlják, akiknél fokozottan fennáll a majomhimlő-fertőzés veszélye. Az oltóanyag JYNNEOSM (más néven Imvamune vagy Imvanex) elnevezéssel kerül forgalomba és bár elsősorban a himlő megelőzésére szolgál, a majomhimlő esetében is képes védelmet nyújtani.[6]
Majomhimlő vírus mint biofegyver[szerkesztés]
A virológus szakemberek arra figyelmeztetnek, hogy a majomhimlő vírus terroristák kezében alkalmas lehet biofegyverként való alkalmazásra.[43] A vírus okozta humán fertőzésekben a halálozási arány viszonylag alacsonynak mondható, ezért ún. tömegpusztító háborús fegyverként való alkalmazása nem valószínű, de a vírushoz való könnyű hozzáférés miatt a molekuláris biológiában jártas és képzett terroristák kezében hatékony biofegyverré válhat.[44] További aggodalomra adhat okot, hogy a vírus megfelelő módosítás után alkalmas lehet haszonállatok fertőzésére, amely óriási gazdasági károkat okozhat az állattartásban. Jelenleg vita folyik arról, hogy az aeroszolátvitel (cseppfertőzés) milyen hatékonyan vezet másodlagos fertőzésekhez és ez milyen módon fokozható vagy tehető halálosabbá.[45][46] A vírus fejlődésére vonatkozó vizsgálatok azt mutatják, hogy az emberi fertőzéseket okozó majomhimlő vírus az elmúlt évtizedekben genetikailag stabil maradt, továbbá bizonyítékok vannak arra vonatkozóan is, hogy a fekete himlőtől függetlenül alakult ki. Ez a megállapítás arra enged következtetni, hogy a majomhimlő valószínűleg nem fejlődik variola-szerű (tehát fekete himlő veszélyességű) vírussá.[47][48] Mindazonáltal egyes szakértők azon a véleményen vannak, hogy a majomhimlő vírus genetikailag viszonylag egyszerűen módosítható rendkívül halálos biológiai fegyverré.[49]
Megjegyzések[szerkesztés]
- ↑ Az illusztrációkkal kapcsolatos kérés a hírsajtóra vonatkozik és nem a szakirodalomra, ismeretterjesztő kiadványokra vagy enciklopédiákra
- ↑ A fertőző betegségeknél inkubációs időnek nevezik a fertőzés időpontja és a tünetek első megjelenése között eltelt időszakot.
- ↑ A megnagyobbodott érzékeny nyirokcsomó diagnosztikai jelentőségű, a majomhimlő megkülönböztető jellemzője más fertőzőbetegségekhez (bárányhimlő, kanyaró, himlő) képest, amelyekkel kezdetben összetéveszthető.
- ↑ Macula: nem tapintható, de körülírható, színbeli elváltozást mutató foltszerű bőrtünet, többnyire < 10 mm átmérővel.
- ↑ Papula: a bőr irharétegébe beszűrődő, a környezetéből kiemelkedő, tapintható, általában <10 mm átmérőjű bőrelváltozás.
- ↑ Pusztula: fájdalmas, könnyen felszakadó, szöveti folyadékkal telt hólyag, a bőr hámrétegei között genny gyülemlik.
- ↑ Antivirális: a vírus szaporodását vagy szóródását akadályozó szer.
- ↑ Orális: szájon át szedhető.
- ↑ A DNS-polimeráz egy enzim, az örökítő anyag DNS (ebben az esetben vírus DNS) replikációjának kulcsenzime. A folyamat során a DNS-polimeráz „leolvassa” a meglévő vírus DNS-szálakat, miközben két új szálat hoz létre, amelyek pontos másolatai a leolvasottaknak.
- ↑ A majomhimlő lappangási idejének elfogadott felső határa 21 nap.
- ↑ Gyakran csak himlőként említik
- ↑ Virion: a sejteken kívül életjelenségeket nem mutató vírusrészecske, amely – egy védelmet biztosító burokban – a genetikai információt és a vírus szaporodását (replikációját) elindító legszükségesebb molekulákat hordozza.
- ↑ A fertőzőbetegség dinamikája: a fertőzés elindulásának és terjedésének a részletkérdései.
Hivatkozások[szerkesztés]
- ↑ Gumbrecht, Jamie: WHO renames monkeypox as 'mpox' (angol nyelven). CNN, 2022. november 28. (Hozzáférés: 2023. február 28.)
- ↑ WHO recommends new name for monkeypox disease (angol nyelven). www.who.int. Egészségügyi Világszervezet. (Hozzáférés: 2023. február 28.)
- ↑ a b J. M. Willey, L. M. Sherwood, C. J. Woolverton: Prescott's Microbiology, The McGraw·Hill Companies, (ninth edition) 2014. 862. oldal. ISBN 978-0-07-340240-6
- ↑ a b c d e f g A.M. McCollum, I.K. Damon: Human Monkeypox, Clinical Infectious Diseases, 2014 (58) #2, 260–266. o. (https://doi.org/10.1093/cid/cit703)
- ↑ a b c d e f g h i j World Health Organization weboldal: https://www.who.int/health-topics/monkeypox
- ↑ a b c d e CDC weboldal: https://www.cdc.gov/poxvirus/monkeypox/transmission.html
- ↑ a b P. von Magnus, E.K. Andersen K.B. Petersen, A. Birch-Andersen: A pox-like disease in cynomolgus monkeys, Acta pathologica et microbiologica Scandinavica, 1959 (46) #2, 156-176. o. (https://doi.org/10.1111/j.1699-0463.1959.tb00328.x)
- ↑ J.G. Breman, K. Ruti, M.V. Steniowski (Szczeniowski): Human monkeypox, 1970–1979, Bulletin of WHO, 1980 (58) #2, 165–182. o. (https://apps.who.int/iris/handle/10665/261903)
- ↑ a b I.D. Ladnyj, P. Ziegler, E. Kima: A human infection caused by monkeypox virus in Basankusu Territory, Democratic Republic of the Congo, Bulletin of WHO, 1972 (46), 593–597. o. (PMID: 4340218)
- ↑ Z. Jezek, A.I. Gromyko, M.V. Szczeniowski: Human monkeypox, Journal of Hygiene, Epidemiology, Microbiology and Immunology, 1983 (27), 13–28. o. (PMID: 6304185)
- ↑ S.O. Foster, E.W. Brink, D.L. Hutchins, J.M. Pifer, B. Lourie, C.R. Moser, E.C. Cummings, O.E.K., Kuteyi, R.E.A. Eke, J.B. Titus, et al. Human monkeypox, Bulletin of WHO, 1972 (46), 569–576. o. (PMID: 4340216)
- ↑ a b c d e E. Alakunle, U. Moens, G. Nchinda, M.I. Okeke: Monkeypox Virus in Nigeria: Infection Biology, Epidemiology, and Evolution, Viruses, 2020 (12): 1257. o. (https://doi.org/10.3390/v12111257)
- ↑ S.M. Bernard, S.A. Anderson: Qualitative assessment of risk for monkeypox associated with domestic trade in certain animal species, United States, Emerging Infectious Diseases (CDC), 2006 (12), 1827-1833. o. (https://doi.org/10.3201/eid1212.060454)
- ↑ R. Gispen, B. Brand-Saathof: White" poxvirus strains from monkeys, Bulletin of WHO, 1972 (46) #5, 585-592. o. (https://apps.who.int/iris/handle/10665/263483), ("A sample of monkeypox virus was obtained from Dr Preben von Magnus in 1959.")
- ↑ Charles Rondle (1978. november 30.). „The natural history of smallpox / Monkeypox”. New Scientist 80 (1131), 682. o. [2023. január 13-i dátummal az eredetiből archiválva]. ISSN 0262-4079. (Hozzáférés: 2022. június 21.)
- ↑ I. Arita, A. Henderson: Smallpox and Monkeypox in Non-human Primates, Bulletin of WHO, 1968 (39) #2, 277–283. o. (https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2554549/)
- ↑ Christian Happi, Ifedayo Adetifa, Placide Mbala, Richard Njouom, Emmanuel Nakoune, et al.: Urgent need for a non-discriminatory and non-stigmatizing nomenclature for monkeypox virus, virological.org, 2022. június 10.(https://virological.org/t/urgent-need-for-a-non-discriminatory-and-non-stigmatizing-nomenclature-for-monkeypox-virus/853)
- ↑ J.G. Breman, D.A. Henderson: Diagnosis and management of smallpox, The New England Journal of Medicine, 2002 (346), 1300–1308. o. (https://www.nejm.org/doi/full/10.1056/nejmra020025)
- ↑ I.K. Damon: Status of human monkeypox: clinical disease, epidemiology and research, Vaccine, 2011 (29), D54–59. o. (https://doi.org/10.1016/j.vaccine.2011.04.014)
- ↑ D.B. Di Giulio, P.B. Eckburg: Human monkeypox: an emerging zoonosis, The Lancet Infectious Diseases, 2004 (4): 15–25. o.
- ↑ Z. Jezek, M. Szczeniowski, K.M. Paluku, M. Mutombo: Human monkeypox: clinical features of 282 patients, The Journal of Infectious Diseases, 1987 (156), 293–298. o. (https://doi.org/10.1093/infdis/156.2.293)
- ↑ a b E. Petersen, A. Kantel, M. Koopmans, D. Asogun, A. Yinka-Ogunleye, C. Ihekweazu, A. Zumla: Human Monkeypox: Epidemiologic and Clinical Characteristics, Diagnosis, and Prevention, Infectious Disease Clinics of North America, 2019 (33), 1027-1043. o. (https://doi.org/10.1016/j.idc.2019.03.001)
- ↑ A.K. Rao, B.W.,Petersen, F. Whitehill, et al.: Use of JYNNEOS (Smallpox and Monkeypox Vaccine, Live, Nonreplicating) for Preexposure Vaccination of Persons at Risk for Occupational Exposure to Orthopoxviruses: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022, Morbidity and Mortality Weekly Report (CDC: MMWR), 2022 (71), 734–742. o. (http://dx.doi.org/10.15585/mmwr.mm7122e1)
- ↑ C.T. Cho, H.A. Wenner: Monkeypox virus, Bacteriological Reviews, 1973 (37), 1–18. o. (https://doi.org/10.1128/br.37.1.1-18.1973)
- ↑ M.R. Odom, R. Curtis Hendrickson, E.J. Lefkowitz: Poxvirus protein evolution: Family wide assessment of possible horizontal gene transfer events, Virus Research, 2009 (144), 233–249. o. (https://doi.org/10.1016/j.virusres.2009.05.006)
- ↑ A.L. Hughes, S. Irausquin, R. Friedman: The evolutionary biology of poxviruses, Infection, Genetics and Evolution, 2010 (10), 50–59. o. (https://doi.org/10.1016/j.meegid.2009.10.001)
- ↑ S. Essbauer, M. Pfeffer, H. Meyer: Zoonotic poxviruses, Veterinary Microbiology, 2010 (140) #3-4, 229–236. o. (https://doi.org/10.1016/j.vetmic.2009.08.026)
- ↑ C.A. Quiner, C. Moses, B.P. Monroe, Y. Nakazawa, J.B. Doty, C.M. Hughes, A.M. McCollum, S. Ibata, J. Malekani, E. Okitolonda, D.S. Carroll, M.G. Reynolds: Presumptive risk factors for monkeypox in rural communities in the Democratic Republic of the Congo, PLoS One, 2017 (12), (https://doi.org/10.1371/journal.pone.0168664)
- ↑ F.X. Meslin, K. Stöhr, D. Heymann: Public health implications of emerging zoonoses', Revue scientifique et technique, 2000 (19), 310-317. o. (https://doi.org/10.20506/rst.19.1.1214)
- ↑ S.M. Bernard, S.A. Anderson: Qualitative Assessment of Risk for Monkeypox Associated with Domestic Trade in Certain Animal Species, United States, Emerging Infectious Diseases (CDC), 2006 (12), 1827–1833. o. (https://doi.org/10.3201/eid1212.060454)
- ↑ P.Y. Riley, B.B. Chomel: Hedgehog zoonoses, Emerging Infectious Diseases (CDC), 2005 (1), 1-5. o. (https://doi.org/10.3201/eid1101.040752)
- ↑ G.W. Witmer, N.P. Snow, P.W. Burke: Potential attractants for detecting and removing invading Gambian giant pouched rats (Cricetomys gambianus), Pest Management Science, 2010 (66), 412-416. o. (https://doi.org/10.1002/ps.1892)
- ↑ https://www.ecdc.europa.eu/sites/default/files/documents/Monkeypox-multi-country-outbreak.pdf
- ↑ S.S. Marennikova, E.M. Šeluhina: Susceptibility of some rodent species to monkeypox virus, and course of the infection, Bulletin of WHO, 1976 (53), 13-20. o. (http://www.ncbi.nlm.nih.gov/pmc/articles/pmc2366409/)
- ↑ L.D. Nolen, L. Osadebe, J. Katomba, J. Likofata, D. Mukadi, B. Monroe, J. Doty, C.M. Hughes, J. Kabamba, J. Malekani, et al.: Extended human-to-human transmission during a monkeypox outbreak in the Democratic Republic of the Congo, Emerging Infectious Diseases (CDC), 2016 (22), 1014–1021. o. (https://doi.org/10.3201/eid2206.150579)
- ↑ N.K. Kisalu, J.L. Mokili: Toward Understanding the Outcomes of Monkeypox Infection in Human Pregnancy, The Journal of Infectious Diseases, 2017 (216), 795-797. o. (https://doi.org/10.1093/infdis/jix342)
- ↑ D. Ogoina, J.H. Izibewule, A. Ogunleye, E. Ederiane, u. Anebonam, A. Neni, A. Oyeyemi, E.N. Etebu, C. Ihekweazu: The 2017 human monkeypox outbreak in Nigeria—Report of outbreak experience and response in the Niger Delta University Teaching Hospital, Bayelsa State, Nigeria, PLoS ONE, 2019 (14), 1–12. o. (https://doi.org/10.1371/journal.pone.0214229)
- ↑ A. Antinori, V. Mazzotta, S. Vita, F. Carletti, D. Tacconi, L.E. Lapini, A. D’Abramo, S. Cicalini, D. Lapa, S. Pittalis, V. Puro, M.R. Capparuccia, E. Giombini, C.E.M. Gruber, A.R. Garbuglia, A. Marani, F. Vairo, E. Girardi, F. Vaia, E. Nicastri: Epidemiological, clinical and virological characteristics of four cases of monkeypox support transmission through sexual contact, Italy, May 2022, Eurosurveillance, 2022 (27) #22, (https://www.eurosurveillance.org/content/10.2807/1560-7917.ES.2022.27.22.2200421)
- ↑ Nem pusztít már a végzetes vírus (Weborvos.hu)
- ↑ R.B. Kennedy, I.G. Ovsyannikova, B.M. Jacobson, G.A. Poland: The immunology of smallpox vaccines, Current Opinion in Immunology, 2009 (21), 314–320. o. (https://doi.org/10.1016/j.coi.2009.04.004)
- ↑ B.W. Petersen, J. Kabamba, A.M. McCollum, R.S. Lushima, E.O. Wemakoy, J.J Muyembe Tamfum, B. Nguete, C.M. Hughes, B.M. Monroe, M.G. Reynolds: Vaccinating against monkeypox in the Democratic Republic of the Congo, Antiviral Research, 2019 (162), 71-177. o. (https://doi.org/10.1016/j.antiviral.2018.11.004)
- ↑ A. Volkmann, A.L. Williamson, H. Weidenthaler, T.P.H. Meyer, J.S. Robertson, J.L. Excler, R.C. Condit, E. Evans, E.R. Smit, D. Kim, R.T. Chen: The Brighton Collaboration standardized template for collection of key information for risk/benefit assessment of a Modified Vaccinia Ankara (MVA) vaccine platform, Vaccine, 2021 (39), 3067-3080. O. (https://doi.org/10.1016/j.vaccine.2020.08.050)
- ↑ J.R. Su: Emerging viral infections, Clinics in Laboratory Medicine, 2004 (24), 773–795. o. (https://doi.org/10.1016/j.cll.2004.05.002)
- ↑ F. Fenner, R. Wittek, K.R. Dumbell: Orthopoxviruses, In.: James R. Swearengen (szerk.): Biodefense Research Methodology and Animal Models, Taylor & Francis, Boca Raton, 2012, ISBN 978-1439836323, (2. kiad.), 255–270. o.
- ↑ D.L. Heymann, M. Szczeniowski, K. Esteves: Re-emergence of monkeypox in Africa: a review of the past six years, British Medical Bulletin, 1998 (54), 693–702. o. (https://doi.org/10.1093/oxfordjournals.bmb.a011720)
- ↑ G.M. Zaucha, P.B. Jahrling, T.W. Geisbert, J.R. Swearengen, L. Hensley: The pathology of experimental aerosolized monkeypox virus infection in cynomolgus monkeys (Macaca fascicularis), Laboratory Investigation (Nature), 2001 (81), 1581–1600. o. (https://doi.org/10.1038/labinvest.3780373)
- ↑ C. Gubser, S. Hué, P. Kellam, G.L. Smith: Poxvirus genomes: a phylogenetic analysis, Journal of General Virology, 2004 (85), 105–117. o. (https://doi.org/10.1099/vir.0.19565-0)
- ↑ S.N. Shchelkunov, A.V. Totmenin, P.F. Safronov, M.V. Mikheev, V.V. Gutorov, O.I. Ryazankina, et al. Analysis of the monkeypox virus genome, Virology, 2002 (297), 172–194. O. (https://doi.org/10.1006/viro.2002.1446)
- ↑ R.J. Jackson, A.J. Ramsay, C.D. Christensen, S. Beaton, D.F. Hall, I.A. Ramshaw: Expressionof mouse interleukin-4 by a recombinant ectromelia virus suppresses cytolytic lymphocyte responses and overcomes genetic resistance to mousepox, Journal of Virology, 2001 (75), 1205–1210. o. (https://doi.org/10.1128/jvi.75.3.1205-1210.2001)
| Az itt található információk kizárólag tájékoztató jellegűek, nem minősülnek orvosi szakvéleménynek, nem pótolják az orvosi kivizsgálást és kezelést. A cikk tartalmát a Wikipédia önkéntes szerkesztői alakítják ki, és bármikor módosulhat. |

