25I-NBOMe
| |||
| 25I-NBOMe | |||
| IUPAC-név | |||
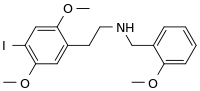
| 2-(4-jód-2,5-dimetoxifenil)-N-[(2-metoxifenil)metil]etánamin | |||
| Kémiai azonosítók | |||
| CAS-szám | 919797-19-6, 1043868-97-8 (hidroklorid) | ||
| PubChem | 10251906 | ||
| |||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C18H22INO3 | ||
| Moláris tömeg | 427,28 g/mol | ||
| Terápiás előírások | |||
| Jogi státusz | Oroszországban és néhány USA államban illegális (HU) | ||
| Függőségi potenciál | Nem ismert | ||
| Alkalmazás | Bukkális, szublinguális, intravénás, intramuszkuláris, szippantás, belégzés, kúp | ||
A 25I-NBOMe (2C-I-NBOMe) a szubsztituált fenetilaminok közé tartozó pszichedelikus drog, a 2C-I származéka. 2003-ban fedezte fel Ralf Heim, a Szabad Berlini Egyetem kutatója,[1] majd David E. Nichols csapata tanulmányozta.[2]
A vegyület 11-es tömegszámú szénizotópos változatát ([11C]Cimbi-5) Koppenhágában szintetizálták és érvényesítették, mint PET radioligandumot.[3][4] Mint az első 5HT2A receptor teljes agonista PET radioligandum, a [11C]Cimbi-5 lehetséges funkcionális jelölője lehet ezeknek a receptoroknak. Az 5HT2A receptorok összefüggésben állhatnak több pszichiátriai betegséggel, mint például a depresszió és a szkizofrénia.[5]
Farmakológia[szerkesztés]
A 25I-NBOMe az emberi 5-HT2A receptor potens teljes agonistája[6][7] 0,044 nM-os Ki-val, ami 16-szor potensebbé teszi anyavegyületénél, a 2C-I-nél.[8] In vitro kísérletek megmutatták, hogy a molekula agonistaként hat, de állatkísérleteket még nem végeztek. Míg a 2C-I N-benzil származékai szignifikánsan növelték a vegyület potenciálját, addig a DOI ilyen származékai inaktívak voltak.[9]
A következő receptorokhoz tartozó Ki értékek nagyobbak voltak 500 nM-nál (nagyobb érték, kisebb potenciál): 5-HT1A, D3, H2, 5-HT1D, α1A adrenerg, δ opioid, szerotonin visszavétel transzporter, 5-HT5A, 5-HT1B, D2, 5-HT7, D1, 5-HT3, 5-HT1E, D5, muszkarin M1-M5, H3, és a dopamin visszavétel transzporter.[8]
| Receptor | Ki (nM) | ± |
|---|---|---|
| 5-HT2A | 0.044 | |
| 5-HT2C | 2 | |
| 5-HT6 | 73 | 12 |
| μ-opioid | 82 | 14 |
| H1 | 189 | 35 |
| 5-HT2B | 231 | 73 |
| κ-opioid | 288 | 50 |
Dózis[szerkesztés]
Az utóbbi időben a 25I-NBOMe és egyéb NBOMe vegyületek megjelentek bélyegen, sokszor LSD-ként árulva fesztiválokon és partikon, mivel hatásuk igen hasonló. Mindenesetre lehetséges különbséget tenni a két anyag között teszter kittel, vagy akár anélkül is.[10] A 25I-NBOMe orálisan nem hat, míg az LSD igen.
Az Erowid pszichoaktív szerekkel foglalkozó adatbázis a küszöbdózist a használók beszámolói alapján 50-250 mikrogramm (µg) között határozza meg. Egy könnyű élményhez 200-600 µg, egy átlagoshoz 500-800 µg-ot ajánl, 700-1500 µg pedig már erős dózisnak számít.[11] A Bluelight.ru fórumon végzett szavazás alapján a legtöbb felhasználó a maximális felelősségteljes dózist 1000-1500 µg-nak tartotta.[12]
Hatás[szerkesztés]
A 25I-NBOMe hatása általában 6-10 órán keresztül tart, ha szublingálisan (nyelv alatt tartva kb 20-25 percig a nyál lenyelése nélkül) vagy bukkálisan (hasonlóan, csak az ínynél) alkalmazzák.[13] Ha szippantják, körülbelül 4-6 órán keresztül hat.[13] A 25I-NBOMe orálisan nem jár hatással. Mindenesetre a dózistól függően jelentősen tovább is tarthat a szer hatása, 12 óránál hosszabb „utazásról” is található beszámoló.
A 25I-NBOMe továbbá vaporizálható/inhalálható is, ami a hatások sokkal korábbi megjelenésével és rövidebb időtartammal jár. Ez az alkalmazási út nem ajánlott, kivéve pontos folyadékmérési technika alkalmazásával, a mikrogrammos dózisok kimérésének nehézsége és ezáltal a túladagolás veszélye miatt.
Az 25I-NBOMe okozta hallucináció, vizuális effektek hasonlóak más pszichedelikumokhoz (leginkább az LSD-re hasonlít), de felhasználóik intenzívebb vizuális effektekről és kontrasztosabb színekről számolnak be. A hatások hasonlóak az LSD-hez, de egy rendszeres LSD vagy 25I-NBOMe felhasználó könnyen különbséget tudok tenni a két vegyület okozta "utazás" között.
Kívánatos[13][szerkesztés]
|
Nem kívánt[13][szerkesztés](magasabb dózisoknál több/erősebb mellékhatások tapasztalhatóak)
|
Toxicitás, bántalmak[szerkesztés]
A 25I-NBOMe egy rendkívül új vegyület és még keveset tudni a farmakológiai és viselkedésbeli veszélyeiről. Az LD50 érték nem ismert. Néhány haláleset a 25I-NBOMe felelőtlen használata miatt bekövetkezett túladagolás következménye.[14] A mostanában széleskörűen elterjedt használata jelzi, hogy halált nem valószínű, hogy átlagos dózis, hanem túladagolás okoz: a tény, hogy a 25I-NBOMe már mikrogrammos dózisban hatásos hozzájárulhat a könnyű túladagoláshoz, mivel így a kimérés jelentősen nehezebb, mint egy kevésbé dózisérzékeny szernél. Több információ szükséges a halálos kimenetelű esetekről ahhoz, hogy megerősíthető legyen ez a hipotézis. Érdemes megjegyezni, hogy számos 5HT2A agonista bizonyítottan biztonságos, de egyik sem teljes agonista, biztonságossági adataikat nem alkalmazhatjuk a 25I-NBOMe esetében.
A 25I-NBOMe használata más kábítószerekkel együtt nem ajánlott, mivel kiszámíthatatlan, hogy a kombináció milyen hatásokkal/mellékhatásokkal járhat, még önmagában is kellő körültekintést igényel a szer használata.
Jogi státusz[szerkesztés]
A 25I-NBOMe az Egyesült Államok szövetségi törvényei alapján nem illegális.[15] Mindenesetre lehetséges, hogy a 2C-I (Schedule I szer) analógjaként mégis illegálisnak minősíthető a 25I-NBOMe tartása és terjesztése. Virginia,[16] Louisiana,[17] és Florida[18] specifikusan a Schedule I listára helyezte a vegyületet, így ezekben az államokban illegális a 25I-NBOMe.
Oroszországban az összes szubsztituált fenetilamin NBOMe illegális.[19]
Magyarországon a 25I-NBOMe C-listás vegyületnek minősülhet.[20]
Hasonló vegyületek[szerkesztés]
- 2CBCB-NBOMe (NBOMe-TCB-2)
- 2CBFly-NBOMe (NBOMe-2CB-Fly)
- 25C-NBOMe (NBOMe-2CC)
- 25B-NBOMe (NBOMe-2CB)
- 25I-NBMD (NBMD-2CI)
- 25I-NBOH (NBOH-2CI)
- 25I-NBF (NBF-2CI)
- 5-MeO-NBpBrT
Források[szerkesztés]
- ↑ Ralf Heim PhD. Synthese und Pharmakologie potenter 5-HT2A-Rezeptoragonisten mit N-2-Methoxybenzyl-Partialstruktur. Entwicklung eines neuen Struktur-Wirkungskonzepts. (German). Diss.fu-berlin.de, 2010. február 28. (Hozzáférés: 2012. augusztus 8.)
- ↑ Michael Robert Braden PhD. Towards a biophysical understanding of hallucinogen action. Purdue University 2007. Proquest.umi.com. (Hozzáférés: 2012. augusztus 8.)
- ↑ (2010) „Radiosynthesis and Evaluation of 11C-CIMBI-5 as a 5-HT2A Receptor Agonist Radioligand for PET”. Journal of Nuclear Medicine 51 (11), 1763–1770. o. DOI:10.2967/jnumed.109.074021. PMID 20956470.
- ↑ Hansen, M. Design and Synthesis of Selective Serotonin Receptor Agonists for Positron Emission Tomography Imaging of the Brain. PhD Thesis, University of Copenhagen, 2011.. [2013. október 22-i dátummal az eredetiből archiválva]. (Hozzáférés: 2013. április 3.)
- ↑ The therapeutic role of 5-HT1A and 5-HT2A receptors in depression
- ↑ a b Ettrup, A. E. A. (2010). „Radiosynthesis and in vivo evaluation of a series of substituted 11C-phenethylamines as 5-HT2A agonist PET tracers”. European Journal of Nuclear Medicine and Molecular Imaging 38 (4), 681–693. o. DOI:10.1007/s00259-010-1686-8. PMID 21174090.
- ↑ Silva ME, Heim R, Strasser A, Elz S, Dove S (2011. January). „Theoretical studies on the interaction of partial agonists with the 5-HT(2A) receptor”. Journal of Computer-aided Molecular Design 25 (1), 51–66. o. DOI:10.1007/s10822-010-9400-2. PMID 21088982.
- ↑ a b c Nichols DE, Frescas SP, Chemel BR, Rehder KS, Zhong D, Lewin AH (2008. June). „High Specific Activity Tritium-Labeled N-(2-methoxybenzyl)-2,5-dimethoxy-4-iodophenethylamine (INBMeO): A High Affinity 5-HT2A Receptor-Selective Agonist Radioligand”. Bioorganic & Medicinal Chemistry 16 (11), 6116–23. o. DOI:10.1016/j.bmc.2008.04.050. PMID 18468904.
- ↑ (2006) „Molecular interaction of serotonin 5-HT2A receptor residues Phe339(6.51) and Phe340(6.52) with superpotent N-benzyl phenethylamine agonists”. Molecular Pharmacology 70 (6), 1956–64. o. DOI:10.1124/mol.106.028720. PMID 17000863.
- ↑ LSD Identification Guide. Bunk Police, 2012. (Hozzáférés: 2012. november 8.)
- ↑ 2C-I-NBOMe (25I) Dose, Erowid.org, <http://www.erowid.org/chemicals/2ci_nbome/2ci_nbome_dose.shtml>. Hozzáférés ideje: 2012-10-07
- ↑ The Big & Dandy 25I-NBOMe Thread (3rd edition)[halott link]
- ↑ a b c d 2C-I-NBOMe (25I) Effects, Erowid.org, <http://www.erowid.org/chemicals/2ci_nbome/2ci_nbome_effects.shtml>. Hozzáférés ideje: 2012-10-07
- ↑ 2C-I-NBOMe Fatalities / Deaths, Erowid.org, <https://www.erowid.org/chemicals/2ci_nbome/2ci_nbome_death.shtml>. Hozzáférés ideje: 2012-10-07
- ↑ 2C-I-NBOMe Legal Status, Erowid.org, <http://www.erowid.org/chemicals/2ci_nbome/2ci_nbome_law.shtml>. Hozzáférés ideje: 2012-10-07
- ↑ Archivált másolat. [2012. augusztus 20-i dátummal az eredetiből archiválva]. (Hozzáférés: 2013. április 3.)
- ↑ DHH Announces Ban of Deadly Synthetic Drug. Thursday, November 8, 2012. [2013. április 9-i dátummal az eredetiből archiválva]. (Hozzáférés: 2013. április 3.)
- ↑ Archivált másolat. [2013. május 25-i dátummal az eredetiből archiválva]. (Hozzáférés: 2013. április 3.)
- ↑ Постановление Правительства Российской Федерации от 6 октября 2011 г. N 822 г. Москва, rg.ru, 2011-10-19, <http://www.rg.ru/2011/10/19/narko-dok.html>. Hozzáférés ideje: 2012-10-07
- ↑ C-lista
Külső linkek[szerkesztés]
Fordítás[szerkesztés]
Ez a szócikk részben vagy egészben a(z) 25I-NBOMe című angol Wikipédia-szócikk fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
