Szerkesztő:Izoxazol/Inozitol
| mio-inozitol[1] | |||
 mio-inozitol | |||
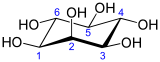 mio-inozitol | |||
| IUPAC-név | (1R,2S,3r,4R,5S,6s)-ciklohexán-1,2,3,4,5,6-hexol | ||
| Más nevek | cisz-1,2,3,5-transz-4,6-ciklohexánhexol, ciklohexánhexol, ciklohexitol, izomcukor, cis-1,2,3,5-trans-4,6-Cyclohexanehexol, Cyclohexanehexol | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 87-89-8 | ||
| PubChem | 892 | ||
| ChemSpider | 10239179 | ||
| KEGG | D08079 | ||
| ChEBI | 17268 | ||
| ATC kód | A11HA07 | ||
| |||
| |||
| InChIKey | CDAISMWEOUEBRE-GPIVLXJGSA-N | ||
| UNII | 4L6452S749 | ||
| ChEMBL | 1222251 | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C6H12O6 | ||
| Moláris tömeg | 180.16 g/mol | ||
| Sűrűség | 1.752 g/cm3 | ||
| Olvadáspont | 225-227 °C | ||
| Veszélyek | |||
| NFPA 704 | |||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
Az inozitol vagy ciklohexán-1,2,3,4,5,6-hexol egy kémiai vegyület, képlete C6H12O6 vagy (-CHOH-)6, egy ciklohexán származék, mely 6 hidroxilcsoporttal gyűrűs, többértékű alkoholt (poliol) alkot. 9 féle lehetséges sztereoizomere van. Közülük a cisz-1,2,3,5-transz-4,6-ciklohexánhexol vagy mio-inozitol (korábbi néven mezo-inozitol vagy i-inozitol) a természetben leggyakrabban megtalálható formája.[2][3] Az inozitol a cukoralkoholok közé tartozik, édessége fele az étkezési cukorénak (szacharóz). A mio-inozitol és az inozitol-foszfátok eukarióta sejtekben — így emberben is — a sejten belüli kommunikációban, a szervezet sejten kívülről érkező parancsainak sejten belüli végrehajtási folyamatában játszanak szerepet: másodlagos hírvivők alkotóelemeként befolyásolják a sejtek felépítését, az idegsejtek ingerületvezetését, a sejten belüli kálcium koncentrációt, a sejtmembrán elektromos feszültségét, a zsírlebontást, a gének kifejeződését és az inzulinhatást. Az inozitol az állatokban és növényekben található zsírok fontos alkotóeleme foszfatidil-inozitol, és ennek különböző foszfátjainak, (foszfatidilinozitol-foszfát lipidek) formájában, amelyek a sejtek biológiai membránjainak alapvető építőkövei is.
Az inozitol vagy foszfátjai és a kapcsolódó lipidvegyületei sok élelmiszerben megtalálhatók, így gyümölcsökben, különösen a sárgadinnyében és a narancsban.[4] Számos növényben az inozitol egyik foszfátja, a fitinsav (inozitol-hexafoszfát, fitát) illetve ennek sói elsődleges foszforraktárként szolgálnak a magokban, így a dió- és babfélékben,[5] valamint a magas rosttartalmú gabonafélék magjának héjjában. A táplálékkal elfogyasztott fitinsav azonban nem hasznosul közvetlenül a szervezetben, mivel nem emészthető. Bizonyos élelmiszer-feldolgozási technikákkal igyekszenek részben lebontani a fitinsavat, hogy emészthető formába hozzák. Ezzel szemben az inozitol glicerofoszfolipidek - növényi eredetű anyagok, mint pl. a lecitinek - formájában jól felszívódik, és részben hasznosul.
A mio-inozitol (foszfátmentes formában) korábban a B-vitaminok közé sorolták B8 vitaminként. Mivel azonban a szervezet képes maga előállítani glükózból, a mai rendszertan szerint nem számít esszenciális tápanyagnak.[6]
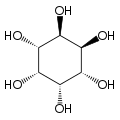
Izomerei és szerkezete
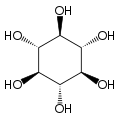
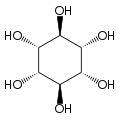
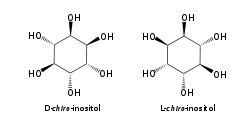
[szerkesztés]A izomer mio-inozitol egy mezoizomer, tehát optikailag inaktív, mivel szerkezete tükörszimmetrikus. Ebből adódóan a korábbi mezo-inozitol elnevezés ma elavultnak számít. A mio-inositol mellett a természetben előforduló sztereoizomerek még a scyllo-, muco-, D-chiro-, neo-inozitol, bár ezek minimális mennyiségben fordulnak elő a természetben. További lehetséges izomerek az L-chiro-, allo-, epi-, cisz-inozitol. Ahogy nevük mutatja, az L- és a D-chiro inozitol az inozitol egyetlen optikai izomerpárja, ezek viszont egymás optikai izomerjei, nem a mio-inozitolé.[7]

|
|
|
|
| mio- | scyllo- | muco- | chiro- |

|
|

|
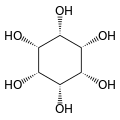 |
| neo- | allo- | epi- | cisz- |
Legstabilabb formája, a mio-inozitol izomer „szék” konformációt alkot, amelyben maximális számú hidroxil-csoport fordul ekvatoriális pozícióba, így kerülve a legtávolabb egymástól. Ebben a konformációban a természetes mio izomer szerkezete olyan, amelyben a hat hidroxilcsoport közül öt (az első, harmadik, negyedik, ötödik, hatodik), ekvatoriális, míg a második hidroxilcsoport axiális.[8]
Bioszintézis
[szerkesztés]A mio-inozit glükóz-6-foszfátból (G-6-P) állítható elő két lépésben. Először a G-6-P-t izomerizálják egy inozitol-3-foszfát-szintetáz enzim (pl. ISYNA1) segítségével mio-inozitol-1-foszfáttá. Majd ezt defoszforizálják inozitol monofoszfatáz enzimmel (pl. IMPA1), így végül szabad mio-inozitolt nyernek. Az emberi szervezet saját maga is képes inozitot előállítani glükózból, foszfát felhasználásával. Emberben a legtöbb inozit a vesében szintetizálódik, jellemzően naponta néhány gramm.[9]
Funkciói élő szervezetben
[szerkesztés]Az inozitol, a foszfatidilinozitol, valamint a mono- és polifoszfátjai másodlagos messengerként (hírvivő) működnek számos intracelluláris jelátviteli folyamatban, így az alábbi biológiai folyamatokban:
- Az inzulin jelátviteli folyamatában másodlagos hírvivőként befolyásolja az inzulinhatást.[10]
- Sejtváz (citoszkeleton) összeszerelési folyamata
- Epszin, idegsejtek ingerületvezetésének befolyásolása
- Intracelluláris kalcium (Ca2+) koncentráció ellenőrzése[11]
- Sejtekben a membránpotenciál fenntartása[12]
- Zsírok lebontása[13]
- Génexpresszió[14][15]
A foszfatidilinozitol-foszfát (PIP) zsírok meghatározó része az inozitol, így a sejtek fontos strukturális építőelemeinek is alapköve.[16][forrás?] A sejten belüli folyamatok egy fontos csoportjában, a foszfatidilinozitol-4,5-bizfoszfát (PIP2) a sejtmembránokban tárolódik, amíg a jelátviteli fehérjék valamelyikének felszabadulása át nem alakítja valamilyen másodlagos messengerré,[17] például diacilglicerollá és inozitol-trifoszfáttá.[18]
Növényekben, fitinsavként
[szerkesztés]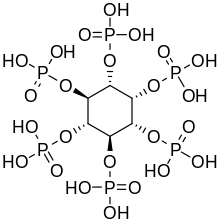
Az inozitol-hexafoszfát, más néven fitinsav vagy IP6, számos növényi szövetben a foszfor elsődleges tárolási formája, különösen a magokban és a magvak héjjában.[19] A foszfor és az inositol fitinsav formájában a nem kérődző állatok a szervezetében általában nem hasznosul, mivel nem rendelkeznek a fitinsav emésztéséhez - a foszfátcsoportok eltávolításához - szükséges emésztőenzimmel. A kérődző állatok a tápcsatornájukban élő kérődzésben segítő mikroorganizmusok által termelt fitáz enzimmel képesek a fitinsav emésztésére .[20] A fitinsav kelátvegyületekben képes megkötni fontos ásványi anyagokat, mint a kalcium, magnézium, vas és cink, amelyekből így kevesebb szívódik fel a belekben. Ez ásványi anyagok hiányához vezethet az ásványi anyag bevitelt egyoldalúan csak magas rosttartalmú, növényi magvakat tartalmazó étrenddel biztosító embereknél, amint a fejlődő országokban megfigyelték.[21][22]
Az inozitol penta- (IP5), tetra- (IP4) és trifoszfátjait (IP3) szintén szokás "fitátok" gyűjtőnéven emlegetni.
Orvosi alkalmazása, kutatások
[szerkesztés]Az inozitolt hatékonynak találták koraszülött csecsemők kezelésére, akiknél légzési distressz szindróma (RDS) alakult ki vagy veszélyeztetettek.[23]
Inozitol bizonyítottan hatékony és biztonságos a policisztás ovárium szindróma (PCOS) kezelésében. Hatásának alapja, hogy növeli az inzulinérzékenységet, ezen keresztül erősíti a petefészek működését és csökkenti a hiperandrogenizmust.[24] Azt is kimutatták, hogy csökkenti az anyagcsere-betegségek előfordulását PCOS-ben szenvedő betegeknél.[25]
A depresszió kezelésére 2004-ben végeztek egy kutatást nagy dózisú inozitol alkalmazásával, de nem sikerült bizonyítani az ilyen kezelés hatékonyságát.[26]
Táplálkozási forrásként
[szerkesztés]A mio-inozit természetes módon megtalálható számos élelmiszerben, bár az élelmiszerek összetételét jelző táblázatok gyakran nem tesznek különbséget biológiailag hasznosuló/felszívódó formája, a lecitin és a magvakban található, fel nem szívódó fitinsav között.[27] Élelmiszerek közül a legmagasabb a myo-inozitol tartalmúak (beleértve összetett vegyület formáit is) a gyümölcsök, babfélék, magvak és diófélék. A babfélék és magvak azonban nagyrészt fitinsav formájában tartalmazzák.
Drogok hígítóanyagaként
[szerkesztés]Az illegális drogok hígítására előszeretettel alkalmaznak cukorvegyületeket (szőlőcukor, tejcukor) fehér színüknek és porszerű textúrájuknak köszönhetően. Ugyanezen tulajdonságai miatt az inozitolt is használják drogok hígításához ( pl. kokain, amfetamin, néha heroin), különösen, hogy édessége fele a többi cukorénak.[28] Inozitport filmekben, TV-műsorokban is alkalmaznak a kokain helyettesítésére.[29]
Felhasználása a robbanóanyag-gyártásban
[szerkesztés]1936-ban az Amerikai Kémiai Társaság ülésén Edward Bartow az Iowai Egyetem professzora bemutatott egy ipari alkalmazásra alkalmas eljárást, mellyel nagy mennyiségű inozitol nyerhető ki a hulladékkukoricában található fitinsavból. Az előállított inozitolt egy lehetséges felhasználásaként javasolta az inozitol-nitrátot nitroglicerin stabilabb alternatívájaként.[30] Ma az inozitol-nitrátot a nitrocellulóz zselésítésére használják, így megtalálható számos modern robbanóanyag és szilárd rakéta-hajtóanyagok.[31]
Útszóró só elleni növényvédelem
[szerkesztés]Az utak hagyományos sózásakor a növények sejtjei diszfunkcionálissá válhatnak, apoptózis játszódik le bennük, ami gátolja a növekedésüket. Újabb vizsgálatok szerint inozitollal történő előkezeléssel meg lehet akadályozni ezeket a hatásokat.[32][33]
Hivatkozások
[szerkesztés]- ↑ Merck Index, 11th Edition, 4883.
- ↑ Synonyms in PubChem
- ↑ Synonyms in Commonchemistry.org
- ↑ Clements RS, Darnell B (1980). "Myo-inositol content of common foods: development of a high-myo-inositol diet". The American Journal of Clinical Nutrition. 33 (9): 1954–67. PMID 7416064.
- ↑ "Phytic acid". www.phytochemicals.info. Retrieved 2017-10-02.
- ↑ Reynolds, James E. F.. Martindale: The Extra Pharmacopoeia. Pennsylvania: Rittenhouse Book Distributors (1993. január 1.) „Egy cukorizomer, ami hagyományos csoportosítás szerint B-vitaminnak tekintenek, bár vitamin státusza bizonytalan, és hiánybetegségét sem azonosították emberben.”
- ↑ Majumder, A. Lahiri. Biology of Inositols and Phosphoinositides (angol nyelven). Springer Science & Business Media (2006. október 3.)
- ↑ Brady, Scott. Basic Neurochemistry: Molecular, Cellular and Medical Aspects (angol nyelven). Academic Press, 348. o. (2005. november 11.)
- ↑ (2006) „Mammalian inositol 3-phosphate synthase: its role in the biosynthesis of brain inositol and its clinical use as a psychoactive agent”. Sub-cellular Biochemistry 39, 293–314. o. PMID 17121280.
- ↑ (2002) „D-chiro-inositol—its functional role in insulin action and its deficit in insulin resistance”. International Journal of Experimental Diabetes Research 3 (1), 47–60. o. DOI:10.1080/15604280212528. PMID 11900279.
- ↑ (2006) „Bile acids induce Ca2+ release from both the endoplasmic reticulum and acidic intracellular calcium stores through activation of inositol trisphosphate receptors and ryanodine receptors”. The Journal of Biological Chemistry 281 (52), 40154–63. o. DOI:10.1074/jbc.M606402200. PMID 17074764.
- ↑ (1997) „Modulation of the kinetics of inositol 1,4,5-trisphosphate-induced [Ca2+]i oscillations by calcium entry in pituitary gonadotrophs”. Biophysical Journal 72 (2 Pt 1), 698–707. o. DOI:10.1016/S0006-3495(97)78706-X. PMID 9017197.
- ↑ (1986) „G-proteins of fat-cells. Role in hormonal regulation of intracellular inositol 1,4,5-trisphosphate”. The Biochemical Journal 240 (1), 35–40. o. PMID 3103610.
- ↑ (2003) „Modulation of ATP-dependent chromatin-remodeling complexes by inositol polyphosphates”. Science 299 (5603), 112–4. o. DOI:10.1126/science.1078068. PMID 12434013.
- ↑ (2003) „Regulation of chromatin remodeling by inositol polyphosphates”. Science 299 (5603), 114–6. o. DOI:10.1126/science.1078062. PMID 12434012.
- ↑ Inozitol hatásmechanizmusa
- ↑ Molekuláris sejtbiológia|Digitális Tankönyvtár (hu-HU nyelven). www.tankonyvtar.hu. (Hozzáférés: 2017. december 18.)
- ↑ 1937–, Mathews, Christopher K.,. Biochemistry, Van Holde, K. E. (Kensal Edward), 1928–, Ahern, Kevin G., 3rd, San Francisco, Calif.: Benjamin Cummings, 855. o. (2000. július 13.)
- ↑ Phytic acid
- ↑ Klopfenstein, Terry J. (2002. július 1.). „Animal Diet Modification to Decrease the Potential for Nitrogen and Phosphorus Pollution”. Council for Agricultural Science and Technology 21.
- ↑ (2003) „Influence of vegetable protein sources on trace element and mineral bioavailability”. The Journal of Nutrition 133 (9), 2973S–7S. o. PMID 12949395.
- ↑ Committee on Food Protection. Phytates, Toxicants Occurring Naturally in Foods. National Academy of Sciences, 363–371. o. (1973)
- ↑ (2015) „Inositol in preterm infants at risk for or having respiratory distress syndrome”. The Cochrane Database of Systematic Reviews (2), CD000366. o. DOI:10.1002/14651858.CD000366.pub3. PMID 25927089.
- ↑ Monastra, G., Unfer, V., Harrath, A.H. (2017. Január). „„Combining treatment with myo-inositol and D-chiro-inositol (40:1) is effective in restoring ovary function Combining treatment with myo-inositol and D-chiro-inositol (40:1) is effective in restoring ovary function and metabolic balance in PCOS patients”. Gynecological Endocrinology 33 (1), 1–9. o. DOI:10.1080/09513590.2016.1247797. PMID 27898267.
- ↑ (2012) „The combined therapy with myo-inositol and D-chiro-inositol reduces the risk of metabolic disease in PCOS overweight patients compared to myo-inositol supplementation alone”. European Review for Medical and Pharmacological Sciences 16 (5), 575–81. o. PMID 22774396.
- ↑ (2004) „Inositol for depressive disorders”. The Cochrane Database of Systematic Reviews (2), CD004049. o. DOI:10.1002/14651858.CD004049.pub2. PMID 15106232.
- ↑ (1980) „Myo-inositol content of common foods: development of a high-myo-inositol diet”. The American Journal of Clinical Nutrition 33 (9), 1954–67. o. PMID 7416064.
- ↑ http://feedadditivechina.com/6-16-inositol.html}}
- ↑ Golianopoulos, Thomas: Drug Doubles: What Actors Actually Toke, Smoke and Snort on Camera. Wired Magazine. (Hozzáférés: 2012. május 14.)
- ↑ Laurence, William L. "Corn by-product yields explosive", The New York Times. 1936. Április 7., p. 7.
- ↑ Ledgard, Jared. The Preparatory Manual of Explosives, 2007. p. 366.
- ↑ (2010) „Salt-induced abnormalities on root tip mitotic cells of Allium cepa: prevention by inositol pretreatment”. Protoplasma 245 (1–4), 165–72. o. DOI:10.1007/s00709-010-0170-4. PMID 20559853.
- ↑ Theerakulp, P. (2012). „Exogenous Sorbitol and Trehalose Mitigated Salt Stress Damage in Salt-sensitive but not Salt-tolerant Rice Seedlings”. Asian Journal of Crop Science 4 (4), 165–70. o. DOI:10.3923/ajcs.2012.165.170.
Források
[szerkesztés]

