Ribonukleinsav
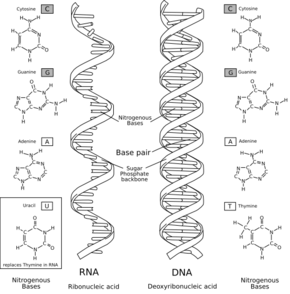
A ribonukleinsav (RNS) a DNS-hez hasonló polimer óriásmolekula, amely sok ismétlődő egységből épül fel. Egységei a ribonukleotidok. A ribonukleotidok száma egy RNS-molekulán belül 75-től több ezerig terjedhet. Minden ribonukleotid egy ribóz cukormolekulából, egy nitrogéntartalmú szerves bázisból és egy foszfátcsoportból áll. Az egyes egységek a foszfátcsoporton keresztül, úgynevezett foszfodiészter-kötéssel kapcsolódnak egymáshoz. A szerves bázisok az RNS-ben adenin (A), citozin (C), guanin (G) és uracil (U) lehetnek (a DNS-ben az uracil helyett timin található). Minden szervezet RNS-molekulák segítségével szintetizál fehérjéket. Néhány egyszerű szervezet (például vírusok) örökítőanyaga RNS. Egyes RNS-molekulák katalitikus tulajdonságokkal bírnak, így enzimfunkciót is betöltenek (ribozim enzimek).
Az RNS típusai[szerkesztés]
A génexpresszióban, tehát a DNS-ben kódolt öröklött tulajdonságok kifejeződésében szerepet játszó RNS-molekulák főbb csoportjai a következők:
- hírvivő RNS (mRNS, messenger RNS): a legtöbb RNS-típushoz hasonlóan egyszálú molekula, hosszúsága, így tömege is nagyon változó. Szerepe a fehérjeszintézisben a DNS-ben kódolt genetikai információ szállítása a fehérjék szintézisének helyére, a riboszómákhoz. A legkevésbé tömeges RNS-típus, a sejtekben előforduló összes RNS tömegének 5%-át adja.
- transzfer RNS (tRNS): a legkisebb RNS-molekula: általában 75-80 nukleotid egységből épül fel, így tömege is a legkisebb. Szerepe a fehérjék építőegységeinek, az aminosavaknak a riboszómákhoz való szállítása. Mind a 20 fehérjékben előforduló aminosavat legalább egy specifikus tRNS köt meg. Funkcionális szempontból két legfontosabb molekularészletük az aminosav-kötőhely és a templát-felismerőhely. Az aminosavak kötése a molekula ún. 3’ végén történik (az egyes nukleotidegységek kapcsolódása a ribóz 3’ szénatomjához és 5’ szénatomjához kapcsolódó OH- ill. PO4-csoportokon keresztül történik. 3’ végnek nevezzük a lánc azon végét, ahol a nukleotid 3’ szénatomján elhelyezkedő OH-csoporthoz nem kapcsolódik foszfát. A templát-felismerőhelyet antikodonnak is szokták nevezni. Az mRNS molekula három nukleotidjához (egy kodonjához) kapcsolódik. A kodont alkotó nukleotidok sorrendjének megfelelően egy specifikus tRNS kötődik a riboszómához, és szállítja a növekvő polipeptidlánc (fehérje) soron következő aminosavegységét. Az RNS-molekulák össztömegének 15%-át adja.
- riboszomális RNS (rRNS): az összes RNS tömegének 85%-át e típus adja. A riboszómák felépítésében vesznek részt (a fehérjék mellett). Három típusuk van, amelyeket ülepedési együtthatójuk után 23S, 16S és 5S rRNS-nek hívnak. Az „S” a Svedberg rövidítése. Centrifugálás közben az egyes alkotórészek méretüktől függően eltérő magasságban rétegződnek. Ezt a pozíciót jellemzik a Svedberg-értékek.
- ezeken kívül még számos RNS-csoport létezik, például az snRNS (kis sejtmagi vagy small nuclear RNS), amely az RNS-átszabásban (splicing) játszik szerepet.
RNS-szintézis (transzkripció)[szerkesztés]
Az RNS-molekulák szintézisét specifikus enzimek, az RNS-polimerázok katalizálják. A polimerázok működéséhez a következő összetevőkre van szükség:
- templátmolekula: templátnak nevezzük általános értelemben a képződő makromolekula szerkezetét meghatározó információt hordozó molekulát, jelen esetben a DNS-t.
- a nukleotidok aktivált előalakjai (prekurzorai): a négyféle bázist tartalmazó nukleozid-trifoszfátok, melyekben a ribózmolekulához három foszfátcsoport csatlakozik.
- fémionok (E. coliban: Mg2+ vagy Mn2+)
Az RNS-szintézis mechanizmusa hasonlít a DNS-replikáció mechanizmusához: az RNS-polimeráz enzim mintegy „leolvassa” a DNS-t felépítő nukleotidok sorrendjét, és olyan nukleozidokat épít be a hosszabbodó RNS-láncba, melyek bázisai a DNS-bázisaival ideiglenes hidrogénkötéseket képesek létesíteni (az adenin az uracillal, a guanin a citozinnal állítható párba ilyen szempontból). Az épülő lánchoz egy újabb nukleozid-trifoszfát kötődik, miközben a ribóz 3’ szénatomjához kapcsoló hidroxilcsoport (OH-) közvetítésével a trifoszfátot alkotó három foszfátcsoport két tagja hidrolizál, pirofoszfátként leválik, a megmaradt nukleozid-monofoszfát ezzel egy időben a lánchoz kapcsolódik. A DNS templát azon helyét, ahol az átírás megkezdődik, promóter szakasznak, ahol befejeződik, terminátor szakasznak nevezzük.
Az RNS-polimeráz esetében a hibakorrekció első lépése a hibásan beépített nukleotid elválasztása a DNS templát száltól. Ez időlegesen megállítja az átírás folyamatát. A polimeráz ezután visszalép egy pozícióval, és kihasítja a nem odaillő nukleotidot tartalmazó dinukleotidot. Ez a folyamat ugyanazon az aktív helyen játszódik le, mint ahol a polimerizáció is történik. Ez élesen különbözik a DNS-polimeráz működésétől, ahol a hibajavítás egy eltérő aktív helyen megy végbe.[1] Különbség a DNS-polimerázzal szemben az is, hogy az RNS-polimeráz nem igényel primert, tehát olyan rövid láncrészletet, ahol megkezdheti a lánc hosszabbítását.
RNS-átszabás (splicing)[szerkesztés]
A baktériumok DNS-e teljes egészében kódoló szakaszokból, génekből áll. Ezzel szemben az eukarióta szervezetek DNS-ében a gének nem folyamatosan tartalmaznak kódoló régiókat, közéjük ékelődve aminosavat nem kódoló szakaszokat találunk. Ezeket a szakaszokat intronoknak nevezzük, míg a kódoló szakaszokat exonoknak. A transzkripció során a teljes gén átíródik mRNS-be, függetlenül attól, hogy az adott szakasz exon vagy intron. Az átíráskor létrejött mRNS-t „primer transzkriptumnak", átiratnak nevezzük. Ebből a fehérjeszintézis (transzláció) előtt az átszabásnak (splicing) nevezett folyamat során kivágódnak az intronok. Az átszabás a spliceosomákban megy végbe, amelyet fehérjék és egy kis molekulájú RNS, az snRNS alkotnak. Az intronok felismerését segíti, hogy kezdetükön szinte mindig GU-t (guanin-uracil) találunk, és AG-vel végződnek, amit egy pirimidinben gazdag régió előz meg. Az exonok egy génen belül sokszor, de nem mindig a kódolt fehérje egy-egy doménjét (alegységét) kódolják.
Irodalom[szerkesztés]
- Weaver, R. F. & Hedrick, P. W. 1997. Genetics, 3rd Ed. New York: WC Brown/McGraw-Hill. [1] (magyarul: Budapest: Panem, 2000 [2])
- Stryer, L. 1988. Biochemistry, 3rd Ed. New York: W.H.Freeman and Co. [3]
További információk[szerkesztés]
Közelebb az élet titkához – magyar kutatók úttörő eredményei (A ribozim-modellezés az ősi RNS-világ hipotézisét erősíti). origo.hu, 2005-09-26.
Jegyzetek[szerkesztés]
- ↑ (2009. december 1.) „RNA polymerase fidelity and transcriptional proofreading”. Current Opinion in Structural Biology 19 (6), 732–9. o. [2017. szeptember 21-i dátummal az eredetiből archiválva]. DOI:10.1016/j.sbi.2009.10.009. PMID 19914059. (Hozzáférés: 2020. február 14.)
