Oxálsav
| Ez a szócikk részben vagy egészben a Pallas nagy lexikonából való, ezért szövege és/vagy tartalma elavult lehet.
Segíts nekünk korszerű szócikké alakításában, majd távolítsd el ezt a sablont! |
| Oxálsav | |||
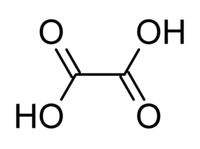 Oxálsav | |||
 Oxálsav pálcikamodellje |
 Oxálsav kalottamodellje | ||
| IUPAC-név | oxálsav | ||
| Szabályos név | etándisav | ||
| Más nevek | Sóskasav | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 144-62-7 | ||
| |||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | H2C2O4 (vízmentes) H2C2O4·2H2O (dihidrát) | ||
| Moláris tömeg | 90,04 g/mol | ||
| Megjelenés | fehér kristályok | ||
| Sűrűség | 1,90 g/cm³ (vízmentes, 17 °C)[1] 1,635 g/cm³ (dihidrát, 18,5 °C)[1] | ||
| Olvadáspont | 157 °C felett bomlik[1] | ||
| Oldhatóság (vízben) | 90-100 g/l (20 °C)[1] | ||
| Savasság (pKa) | pKs1 = 1,37 pKs2 = 3,81[2] | ||
| Veszélyek | |||
| EU osztályozás | Ártalmas (Xn)[3] | ||
| NFPA 704 | |||
| R mondatok | R21/22[3] | ||
| S mondatok | (S2), S24/25[3] | ||
| Lobbanáspont | 166 °C | ||
| LD50 | 7500 mg/kg (patkány, szájon át)[1] | ||
| Rokon vegyületek | |||
| Rokon vegyületek | oxalil-klorid dinátrium-oxalát kalcium-oxalát difenil-oxalát | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
Oxálsav, más néven: sóskasav, etándisav. Két bázisú (azaz besorolása: dikarbonsav), széntartalmú organikus sav. A legegyszerűbb kétértékű karbonsav. Kémiai képlete: HOOC–COOH. Sói és észterei az oxalátok.
Az oxálsav szó a görög okszálisz (ὀξαλίς = erdei sóska) szóból származik, latin közvetítéssel (oxalis).[4]
Története[szerkesztés]
François Pierre Savary (Fribourg, Svájc) fedezte fel 1773-ban.
Az oxálsav volt az első szerves anyag, amit szervetlen anyagokból állítottak elő ezzel bizonyítva, hogy az élő szervezetre a szervetlen környezet is biokémiailag hatással van.
A XIX. század második felétől elkezdődött a szerves és szervetlen kémia ötvözése. Megindult a szerves molekulák szervetlen anyagokból történő szintetizálása, amely a gyógyszeripar egyik alappillére lett a XXI. századra.
Tulajdonságai[szerkesztés]
Fehér kristályos vegyület.
Az oxálsav egyhajlású prizmákban kristályosodik, amelyek két molekula kristályvizet tartalmaznak (H2C2O4·2 H2O). Vízben és alkoholban könnyen oldódik (2 sr. kristályos oxálsav szobahőmérsékleten 9 sr. vízben feloldódik), oldata erősen savanyú ízű és savas kémhatású. Oxidáló anyagok (kálium-permanganát) igen könnyen szén-dioxiddá és vízzé oxidálják, ezért az oxálsav erélyes redukálószer. Az iparban a karton-, selyem- és gyapotfestészetben, a kémiai laboratóriumokban pedig normál (szabályos) oldatok készítésére és a különféle oxálsavsók előállítására használják. Nagyobb adagban a szervezetre mérgező hatású. Az oxálsav legegyszerűbben mészvízzel ismerhető fel, amellyel fehér, ecetsavban oldhatatlan csapadékot ad. Mennyiségi meghatározása leginkább kálium-permanganát oldattal történik titrálás útján. Analitikai kémiában az egyik legelterjedtebb titeralapanyag, mivel 99,9 %-os tisztaság is elérhető. Általában lúgok mennyiségi meghatározására használják.
Előfordulása[szerkesztés]
Előfordul a sóskában, spenótban és számos más növényben (az Oxalis és a Rumex fajokban), azonkívül az állati szervezetben (a vizeletben) részint szabad állapotban, részint különféle sók alakjában. Kalciumsója a vesekő leggyakoribb alkotója. A természetben található humboltin nevű ásvány nem egyéb, mint vas(II)-oxalát, a whewellit pedig kalcium-oxalát. Oxálsav képződik igen sok széntartalmú vegyület oxidációjakor, így a cukorféleségeknek, a szénhidrátoknak stb. salétromsavval való oxidálásakor.
Kalciumsója vízben oldhatatlan (ezért okozhat vesekövet). Savanyú kálium sója (HOOC-COOK) a rozsdafoltot eltávolítja.
Reakcióképessége, reakciói[szerkesztés]
Az oxálsav kétbázisú sav lévén, számos sót alkot, amelyeket oxalátoknak neveznek. Ezek közül fontosabbak:
- Kálium-oxalát (K2C2O4·H2O), amely az oxálsav és a kálium-karbonát telítése, és az oldatnak kikristályosítása útján készül. Vízben könnyen oldódik. Ezt a sót a barnakő (MnO2) kimutatására és a fényképészetben használták. Oxálsavval kálium-hidrogén-oxaláttá (KHC2O4·H2O) alakul, mely a természetben számos savanyú ízű növény (például sóska) nedvében megtalálható és legegyszerűbben úgy készül, hogy az oxálsav felét kálium-karbonáttal telítik és a másik felét hozzáöntve kikristályosítják.
- Kálium-trihidrogén-oxalát (KH3(C2O4)2·2H2O), amely fő alkatrészét képezi a kereskedésben található ún. sóskasónak és amit a háztartásban tinta- és rozsdafoltok eltávolítására használnak. A kálium-oxalátokhoz teljesen hasonlók a megfelelő nátrium- és ammóniumsók.
- Kalcium-oxalát (CaC2O4·H2O), fehér, por alakú csapadék alakjában válik le, ha a vízben oldható oxalátokhoz kalcium-klorid oldatot öntünk. Megtalálható a növényi és az állati szervezetben (vizeletben), a húgykövekben stb. Vízben és ecetsavban oldhatatlan, de sósavban v. salétromsavban igen könnyen feloldódik. Erősebb hevítéskor kalcium-karbonátra és szén-dioxidra bomlik. A súly szerinti elemzésben rendszerint e só alakjában választják le a kalciumot. A kalcium-oxaláthoz teljesen hasonló a bárium- és stroncium-oxalát.
- vas(II)-oxalát (FeC2O4·2H2O), citromsárga csapadék, mely vas(II)-szulfát- és kálium-oxalát oldatok elegyítésekor képződik. A kálium-vas(II)-oxalátot (K2Fe(C2O4)2·2H2O) kiváló redukáló hatásánál fogva a fotográfiában mint igen jó «előhívót» használták.
- vas(III)-oxalát (Fe2(C2O4)3), frissen készült vas(III)-hidroxid oxálsavban való oldásával állítható elő. A fény a vas(III)-oxalátot vas(II)-oxaláttá redukálja, ezért sötétben állítandó elő. Hasonló összetételűek a króm(II)- és króm(III)-oxalátok.
Az oxálsav hidrogénatomjai különféle szénhidrogéncsoportokkal (metil, etil stb.) helyettesíthetők, ekkor az oxálsavnak különféle észterei keletkeznek.
Az oxálsav amidja, az oxamid formamid elektrolízisével állítható elő.[5]
Előállítása[szerkesztés]
Nagyban való előállítása úgy történik, hogy fűrészport kálium- és nátrium-hidroxid elegyével összekeverve, vasüstökben 200-220 °C-ra hevítenek, ekkor nátrium- és kálium-oxalát képződik. A megolvadt barna tömeget vízzel kivonják, és oltott mésszel főzik; ekkor kalcium-oxalát válik ki, amelyet kénsavval bontanak el, és a megszűrt oldatból kikristályosítják. Kis mennyiségben előállítható glükóz és salétromsav 1:5 arányú keverékének főzésével és a folyadék kristályosításával. A kereskedelemben előforduló oxálsav rendszerint nem tiszta, de igen könnyen megtisztítható vízben feloldva lassú hűtéssel.
Jegyzetek[szerkesztés]
- ↑ a b c d e Az oxálsav vegyülethez tartozó bejegyzés az IFA GESTIS adatbázisából. A hozzáférés dátuma: 2010. 12. 28. (JavaScript szükséges) (angolul)
- ↑ Négyjegyű függvénytáblázatok, összefüggések és adatok. Nemzeti tankönyvkiadó, 2006.
- ↑ a b c Az oxálsav (ESIS)[halott link] (németül)
- ↑ Fülöp József: Rövid kémiai értelmező és etimológiai szótár. Celldömölk: Pauz–Westermann Könyvkiadó Kft. 1998. 108. o. ISBN 963 8334 96 7
- ↑ (1962) „A New Method for the Preparation of Oxamide”. The Journal of Organic Chemistry 27 (10), 3698. o. DOI:10.1021/jo01057a516.
Források[szerkesztés]
- Bokor József (szerk.). Oxálsav, A Pallas nagy lexikona. Arcanum: FolioNET (1893–1897, 1998.). ISBN 963 85923 2 X. Hozzáférés ideje: 2023. november 6.

