2-Oxopropanal
| 2-Oxopropanal | |||
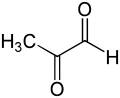 A 2-oxopropanal vonalváza |

| ||
| Más nevek | Piruvaldehid, metilglioxál | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 78-98-8 | ||
| PubChem | 880 | ||
| ChemSpider | 857 | ||
| DrugBank | DB03587 | ||
| KEGG | C00546 | ||
| MeSH | Methylglyoxal | ||
| ChEBI | 17158 | ||
| |||
| |||
| InChIKey | AIJULSRZWUXGPQ-UHFFFAOYSA-N | ||
| Beilstein | 906750 | ||
| UNII | 722KLD7415 | ||
| ChEMBL | 170721 | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C3H4O2 | ||
| Moláris tömeg | 72,06 g/mol | ||
| Megjelenés | Sárga folyadék | ||
| Sűrűség | 1,046 g/cm3 | ||
| Olvadáspont | 25 °C | ||
| Forráspont | 72 °C | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A 2-oxopropanal, más néven metilglioxál (MGO) szerves vegyület, képlete CH3COCHO. A piroszőlősav aldehidje. Reaktív, a cukorbetegségben jelenlévő vegyület. Iparilag szénhidrátok túlexpresszált 2-oxopropanal-szintázzal való bontásával állítják elő.[1]
Szerkezet[szerkesztés]
Gázállapotban 2 karbonilcsoportja van – egy aldehid és egy keton. Víz jelenlétében hidrátokként és oligomerekként van jelen. Ezek jelzik nagy reakcióképességét, mely biológiai viselkedésével is összefügg.[2]
Biokémia[szerkesztés]
Bioszintézis és bomlás[szerkesztés]
A 2-oxopropanal számos metabolikus út mellékterméke.[3] Elsősorban a glikolízis melléktermékeként van jelen a glicerinaldehid-3-foszfát és a dihidroxiaceton-foszfát mellett. Ezenkívül feltehetően az aceton és a treonin bomlásakor is keletkezik.[4] Az arisztolochinsav 18-ról 231 μg/mg vesefehérjére növeli koncentrációját egerekben.[5] 3-Aminoacetonból is keletkezhet, mely a treoninkatabolizmus köztiterméke, valamint lipidperoxidációból is. Azonban legfontosabb forrása a glikolízis. Itt a 2-oxopropanal a glicerinaldehid- és a dihidroxiaceton-foszfátról való nem enzimatikus foszfáteltávolításból jön létre. Ez az alapja a propán-1,2-diol előállításának lehetséges biotechnológiai útja.[6]
Mivel erősen citotoxikus, számos hatástalanító mechanizmus jött létre. Ezek egyike a glioxalázrendszer, ahol a 2-oxopropanalt glutation hatástalanítja. A glutation féltioacetált adva reagál a 2-oxopropanallal, melyet a glioxaláz I S-d-laktoilglutationná alakít.[7] E tioésztert a glioxaláz II d-laktáttá hidrolizálja[8]
Biokémiai funkció[szerkesztés]
A 2-oxopropanal az előrehaladott glikációs végtermékek (AGE) keletkezésében fontos.[4] E folyamatban a lizin és arginin szabad aminocsoportjaival és a cisztein tiolcsoportjaival reagál. A hisztonok erősen érzékenyek a 2-oxopropanal általi módosulásra, ezek száma mellrákban nagyobb.[9][10]

A DNS-károsodást reaktív karbonilcsoportok, elsősorban a 2-oxopropanalé és a glioxálé indukálják az oxidatív DNS-károsodáshoz hasonló gyakorisággal.[12] Ez a DNS-glikáció, mely mutációt, DNS-töréseket vagy citotoxicitást okozhat.[12] Emberben ezeket a DJ-1 (PARK7) javítja.
Orvostudományi szempontok[szerkesztés]
A nagyobb vérglükózszintek miatt a 2-oxopropanal koncentrációja nagyobb cukorbetegekben, és összefügg az artériás aterogenezissel. A 2-oxopropanal okozta alacsonysűrűségűlipoprotein-glikációja 4-szeresére növeli az aterogenezist cukorbetegekben.[13] A 2-oxopropanal közvetlenül az idegvégekhez köt, növelve a krónikus fájdalmakat diabéteszes neuropátia esetén és erősítve a neuropátiát.[14][15]
Egyéb előfordulás[szerkesztés]
A 2-oxopropanal egyes mézek, például a manukaméz összetevője, hatásos az Escherichia coli és a Staphylococcus aureus ellen, és segíthet megakadályozni a Pseudomonas aeruginosa biofilmképzését.[16]
A mézben lévő 2-oxopropanal nem növeli az előrehaladott glikációs végtermékek keletkezését egészséges emberekben.[17][18]
Jegyzetek[szerkesztés]
- ↑ Ullmann Vegyipari Enciklopédia
- ↑ Loeffler, Kirsten W. (2006). „Oligomer Formation in Evaporating Aqueous Glyoxal and Methyl Glyoxal Solutions”. Environmental Science & Technology 40 (20), 6318–23. o. DOI:10.1021/es060810w. PMID 17120559.
- ↑ Inoue Y, Kimura A (1995). „Methylglyoxal and regulation of its metabolism in microorganisms”. Adv. Microb. Physiol. 37, 177–227. o. DOI:10.1016/S0065-2911(08)60146-0. PMID 8540421.
- ↑ a b Bellier, Justine (2019). „Methylglyoxal, a Potent Inducer of AGEs, Connects between Diabetes and Cancer”. Diabetes Research and Clinical Practice 148, 200–211. o. DOI:10.1016/j.diabres.2019.01.002. PMID 30664892.
- ↑ Li, YC (2012). „Aristolochic acid-induced accumulation of methylglyoxal and Nε-(carboxymethyl)lysine: an important and novel pathway in the pathogenic mechanism for aristolochic acid nephropathy”. Biochem Biophys Res Commun 423 (4), 832–7. o. DOI:10.1016/j.bbrc.2012.06.049. PMID 22713464.
- ↑ Ullmann Vegyipari Enciklopédia
- ↑ Thornalley PJ (2003). „Glyoxalase I—structure, function and a critical role in the enzymatic defence against glycation”. Biochem. Soc. Trans. 31 (Pt 6), 1343–8. o. DOI:10.1042/BST0311343. PMID 14641060.
- ↑ Vander Jagt DL (1993). „Glyoxalase II: molecular characteristics, kinetics and mechanism”. Biochem. Soc. Trans. 21 (2), 522–7. o. DOI:10.1042/bst0210522. PMID 8359524.
- ↑ Galligan JJ, Wepy JA, Streeter MD, Kingsley PJ, Mitchener MM, Wauchope OR, Beavers WN, Rose KL, Wang T, Spiegel DA, Marnett LJ (2018. szeptember 1.). „Methylglyoxal-derived posttranslational arginine modifications are abundant histone marks”. Proc Natl Acad Sci USA 115 (37), 9228–33. o. DOI:10.1073/pnas.1802901115. PMID 30150385.
- ↑ (2019. március 1.) „Reversible histone glycation is associated with disease-related changes in chromatin architecture”. Nat Commun 10 (1), 1289. o. DOI:10.1038/s41467-019-09192-z. PMID 30894531.
- ↑ Oya, Tomoko (1999). „Methylglyoxal Modification of Protein”. Journal of Biological Chemistry 274 (26), 18492–502. o. DOI:10.1074/jbc.274.26.18492. PMID 10373458.
- ↑ a b Richarme G, Liu C, Mihoub M, Abdallah J, Leger T, Joly N, Liebart JC, Jurkunas UV, Nadal M, Bouloc P, Dairou J, Lamouri A (2017. július 14.). „Guanine glycation repair by DJ-1/Park7 and its bacterial homologs”. Science 357 (6347), 208-211. o. DOI:10.1126/science.aag1095. PMID 28596309.
- ↑ Rabbani N (2011. május 26.). „Glycation of LDL by methylglyoxal increases arterial atherogenicity. A possible contributor to increased risk of cardiovascular disease in diabetes”. Diabetes 60 (7), 1973–80. o. DOI:10.2337/db11-0085. PMID 21617182.
- ↑ Spektrum: Diabetische Neuropathie: Methylglyoxal verstärkt den Schmerz. DAZ.online, 2012. május 21. (Hozzáférés: 2012. június 11.)
- ↑ (2012) „Methylglyoxal modification of Nav1.8 facilitates nociceptive neuron firing and causes hyperalgesia in diabetic neuropathy”. Nature Medicine 18 (6), 926–33. o. DOI:10.1038/nm.2750. PMID 22581285.
- ↑ (2014) „Antimicrobial properties of honey.”. American Journal of Therapeutics 21 (4), 304–23. o. DOI:10.1097/MJT.0b013e318293b09b. PMID 23782759.
- ↑ Wallace A, Eady S, Miles M, Martin H, McLachlan A, Rodier M, Willis J, Scott R, Sutherland J (2010. április 1.). „Demonstrating the safety of manuka honey UMF® 20+ in a human clinical trial with healthy individuals”. Br J Nutr 103 (7), 1023–8. o. DOI:10.1017/S0007114509992777. PMID 20064284.
- ↑ Degen J, Vogel M, Richter D, Hellwig M, Henle T (2013. október 1.). „Metabolic transit of dietary methylglyoxal”. J Agric Food Chem 61 (43), 10253–60. o. DOI:10.1021/jf304946p. PMID 23451712.
Fordítás[szerkesztés]
Ez a szócikk részben vagy egészben a Methylglyoxal című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
