Kémiai képlet
A kémiai képlet (vagy régies nevén vegyképlet) a vegyületek rövid kémiai jelölésére szolgál, bemutatja azok alkotórészeit, felvilágosítást ad összetételükről és szerkezetükről.
A különböző képletek felírása és jelrendszere nemzetközi szinten szabályozott.
Az ionvegyületek képlete
A molekuláris vegyületek képletei
Tapasztalati képlet
A tapasztalati képlet a vegyület sztöchiometriai összetételét adja meg és az elemek egymás mellé írt vegyjelét tartalmazza. A vegyjelek alsó indexe fejezi ki az összetevők legegyszerűbb arányát. A tapasztalati képlet nem minden esetben adja meg, melyik vegyületről van szó.
Molekulaképlet
A molekulaképlet vagy összegképlet a valóságban önállóan létező molekula minőségi és mennyiségi összetételét fejezi ki, amely alapján kiszámítható a relatív molekulatömeg. Megegyezhet a tapasztalati képlettel.
- Pl. C2H4 (etén).
A Hill-képlet az összegképlet atomjainak sorrendjét szabja meg. Ha a molekulában van szén, a képlet a szén- és hidrogénatomok számával kezdődik, ezt követi a többi atom abc rendben. Ha a molekulában nincsen szén, valamennyi atom (a hidrogént is beleértve) abc-sorrendben szerepel. Pl. a kénsav szokásos összegképlete H2SO4, ez a Hill-rendszerben H2O4S. A kálium-hidroxid szokásos képlete KOH, a Hill-rendszerbelié HKO. A rendszer az összegképlet szerinti keresést egyszerűsíti le.
A Hill-féle rendszer az összegképletek rendezését is megadja (összegképlet-lista esetén): az atomok abc-sorrendjében, azon belül az atomszám szerint sorolja fel őket.[1]
Szerkezeti képlet, vagy más néven konstitúciós képlet
A különböző szerkezeti képletek a molekulák szerkezetét is leírják, különböző, kiemelt szempontok szerint;[2] feltüntetik a molekulát alkotó atomok kapcsolódását és azok térbeli elrendeződését.
- A konstitúciós képlet külön-külön feltünteti a molekulában lévő összes kovalens kötést.[2][3] Pl. az etén szerkezeti (konstitúciós) képlete:

- A félkonstitúciós (gyökcsoportos) képlet csak csak a szénatomok közötti kötéseket tünteti fel:[3] H2C=CH2
- Az egyszerű vonalképlet csak a szénvázat tünteti fel.[3] Az etén esetén ez csak két vonal (mely a kettős kötéssel összekapcsolt két szénatomot jelenti):
 . A benzolt is így ábrázoljuk a leggyakrabban:
. A benzolt is így ábrázoljuk a leggyakrabban: 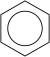
- A szerkezeti képletben megadhatjuk a molekula jellemzőit is, pl. kötésszög, vagy kötéstávolság:
 .
. - A legvalósághűbben azonban a molekulamodell segítségével tudjuk jellemezni a molekulát:
 . Az etén interaktív 3D molekulamodellje itt található. Itt megmérhetjük a kötésszöget és kötéstávolságot is.
. Az etén interaktív 3D molekulamodellje itt található. Itt megmérhetjük a kötésszöget és kötéstávolságot is.
A szerves kémia részletesen tárgyalja a szerves vegyületek szerkezeti képletét.
Források
- Bodonyi Ferenc: Kémiai összefoglaló (Műszaki könyvkiadó, Budapest, 1987)
Jegyzetek
- ↑ Dr. Otto – Albrecht Neumüller: Römpp vegyészeti lexikon. Budapest: Műszaki Könyvkiadó. 1981. 2 kötet., 481–482. o. ISBN 963-10-3269-8
- ↑ a b http://sdt.sulinet.hu/Player/Default.aspx?g=8d9ee604-81a4-4b1c-86c9-c2f150756a57&cid=e36e8b86-e694-4a9c-9e91-78b2c4364d53[halott link]
- ↑ a b c http://www.sulinet.hu/tovabbtan/felveteli/2001/19het/kemia/kemia19.html
Kapcsolódó lapok
- Vegyületek összegképlete (lista magyar Wikipédiában található vegyületek összegképleteiről)
- Vegyületek összegképlet-táblázata (összegképletek vegyületek és elemek szerint). Nagyon nagy lap (736k).
További információk
- a magyar Wikipédia vegyületeinek összegképlet szerinti keresője külső lapon




