Ón(II)-klorid
| Ón(II)-klorid | |

| |
| IUPAC-név | Ón(II)-klorid |
| Szabályos név | Ón-diklorid |
| Más nevek | E512 |
| Kémiai azonosítók | |
|---|---|
| CAS-szám | [7772-99-8] (anhidrát) [10025-69-1] (dihidrát) |
| Kémiai és fizikai tulajdonságok | |
| Kémiai képlet | SnCl2 |
| Moláris tömeg | 189,60 g/mol (anhidrát) 225,63 g/mol (dihidrát) |
| Megjelenés | fehér, kristályos |
| Sűrűség | 3,95 g/cm³ (anhidrát) 2,71 g/cm³ (dihidrát) |
| Olvadáspont | 247 °C (anhidrát) 37 °C (dihidrát) |
| Forráspont | 623 °C (896 K) (bomlik) |
| Oldhatóság (vízben) | 83,9 g/l (20 °C) |
| Oldhatóság (etanol, dietil-éter, ecetsav, aceton, etil-acetát) |
7,4 g/l (30 °C) |
| Kristályszerkezet | |
| Kristályszerkezet | rétegrácsos szerkezet (anhidrát) |
| Koordinációs geometria |
trigonális piramisos (anhidrát) |
| Molekulaforma | hajlított (gáz fázisban) |
| Veszélyek | |
| EU osztályozás | Ártalmas (Xn)[1] |
| R mondatok | R22, R36/37/38, R43[1] |
| S mondatok | S24, S26, S37[1] |
| LD50 | 700 mg/kg (patkány, szájon át)[1] |
| Rokon vegyületek | |
| Azonos kation | Ón(II)-fluorid Ón(II)-bromid |
| Azonos anion | Ón(IV)-klorid Germánium-diklorid Ólom(II)-klorid |
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |
Az ón(II)-klorid egy fehér, kristályos anyag, mely az ón klórral alkotott egyik sója. Képlete: SnCl2. Általában dihidrát formájában fordul elő, de forró vízben oldva hidrolizálható. Redukálószerként, valamint elektrolitként széles körben alkalmazzák.
Kémiai tulajdonságok[szerkesztés]
A SnCl2 szilárd, kristályos formában láncokat képez a képen látható módon. Dihidrát formában a kristályszerkezetbe víz épül be.
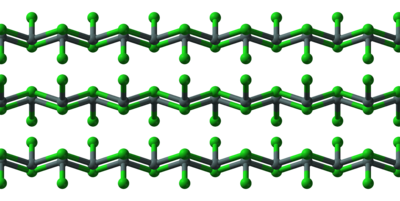
Az ón(II)-klorid saját tömegénél kevesebb vízben is feloldódik, de amint az oldat telített lesz, hidrolízis útján csapadék képződik:
- SnCl2(aq) + H2O(l) ⇌ Sn(OH)Cl(s) + HCl(aq)
Ebből következik, hogy tiszta ón(II)-klorid oldat eléréséhez hidrogén-kloridot kell adni az oldathoz. Az ón(II)-klorid levegőn könnyen oxidálódik:
A folyamat tiszta ón segítségével megelőzhető.[2]
Előállítása[szerkesztés]
Az ón(II)-klorid anhidrát formáját gáz halmazállapotú hidrogén-klorid és ón reakciójából nyerik. Dihidrát előállításához a hidrogén-kloridot vízben oldják:
A víz elpárologtatásával SnCl2·2H2O kristályokat kapunk. A kristályokból a víz jégecet használatával távolítható el.
Felhasználása[szerkesztés]
- az ón(II)-klorid oldatából kevés sósav jelenlétében elektrolízis során a katódon ón válik ki, és ónbevonat kialakítására alkalmazható
- a politejsav (PLA) nevű műanyag előállítása során katalizátorként használják
- tükrök ezüst-bevonatának készítésekor redukálószerként működik:
- Sn2+(aq) + 2 Ag+ → Sn4+(aq) + 2 Ag(s)
- régebben hasonló reakciót alkalmaztak higany, valamint arany kimutatására. Higany jelenlétében fekete, míg arany jelenlétében világos lila színű oldatot kapunk.
- a biokémiában az ón(II)-klorid szelektíven csak az anilin aromás csoportját redukálja[3]
- élelmiszerek esetén antioxidánsként és stabilizálószerként, E512 néven alkalmazzák. Elsősorban konzervekben fordul elő. Napi maximum beviteli mennyisége 2 mg/testsúlykg. Ilyen mennyiségben mellékhatása nem ismert.
Jegyzetek[szerkesztés]
- ↑ a b c d Az ón(II)-klorid vegyülethez tartozó bejegyzés az IFA GESTIS adatbázisából. A hozzáférés dátuma: 2010. december 30. (JavaScript szükséges) (angolul)
- ↑ H. Nechamkin. The Chemistry of the Elements. New York: McGraw-Hill (1968)
- ↑ F. D. Bellamy and K. Ou (1984). „Selective reduction of aromatic nitro compounds with stannous chloride in non acidic and non aqueous medium”. Tetrahedron Letters 25 (8), 839-842. o. DOI:10.1016/S0040-4039(01)80041-1.
Források[szerkesztés]
- N. N. Greenwood, A. Earnshaw, Chemistry of the Elements, 2nd ed., Butterworth-Heinemann, Oxford, UK, 1997.
- Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990.
- The Merck Index, 7th edition, Merck & Co, Rahway, New Jersey, USA, 1960.
- A. F. Wells, 'Structural Inorganic Chemistry, 5th ed., Oxford University Press, Oxford, UK, 1984.
- J. March, Advanced Organic Chemistry, 4th ed., p. 723, Wiley, New York, 1992.
- http://www.food-info.net/uk/e/e512.htm

