Kén-hexafluorid
| Kén-hexafluorid | |||
 |

| ||
| |||
| IUPAC-név | kén(VI)-fluorid | ||
| Más nevek | kén-hexafluorid | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 2551-62-4 | ||
| PubChem | 17358 | ||
| ChemSpider | 16425 | ||
| EINECS-szám | 219-854-2 | ||
| KEGG | D05962 | ||
| ChEBI | 30496 | ||
| RTECS szám | WS4900000 | ||
| ATC kód | V08DA05 | ||
| |||
| UNII | WS7LR3I1D6 | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | SF6 | ||
| Moláris tömeg | 146,06 g/mol | ||
| Megjelenés | színtelen szagtalan gáz[1] | ||
| Sűrűség | 6,164 g/l, (gáz, 1 bar) 1,329 kg/l, (folyadék, 25 °C) 2510 kg/m³ vagy 2,510 kg/l, (szilárd −50,8 °C) | ||
| Olvadáspont | −63,8 °C (209 K) (szublimál)[1] | ||
| Forráspont | normál nyomáson nem létezik[1] | ||
| Oldhatóság (vízben) | 0,003% (25 °C)[3] | ||
| Mágneses szuszceptibilitás | −44,0·10−6 cm3/mol | ||
| Hővezetés |
| ||
| Viszkozitás | 15,23 μPa·s[4] | ||
| Gőznyomás | 2,9 MPa (21,1 °C-on) | ||
| Kristályszerkezet | |||
| Kristályszerkezet | rombos, oP28 | ||
| Tércsoport | Oh | ||
| Koordinációs geometria |
derékszögű hatszöges | ||
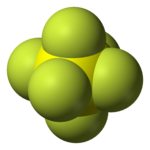
| Molekulaforma | oktaéderes | ||
| Dipólusmomentum | 0 D | ||
| Termokémia | |||
| Std. képződési entalpia ΔfH |
−1209 kJ·mol−1[6] | ||
| Standard moláris entrópia S |
292 J·mol−1·K−1[6] | ||
| Hőkapacitás, C | 0,097 kJ/(mol·K) (állandó nyomáson) | ||
| Terápiás előírások | |||
| Licenc adat | yes (EU) | ||
| Veszélyek | |||
| MSDS | külső MSDS | ||
| NFPA 704 | |||
| S mondatok | S38 | ||
| PEL | TWA 1000 ppm (6000 mg/m3)[3] | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A kén-hexafluorid (SF6) szervetlen vegyület. Szobahőmérsékleten gáz halmazállapotú. Molekulaszerkezete oktaéderes; hat fluoratom kapcsolódik egy központi kénatomhoz. Színtelen, szagtalan, nem mérgező és nem gyúlékony. Mivel tipikusan apoláris gáz, vízben alig, de apoláris szerves oldószerekben jól oldódik. Általában sűrített, cseppfolyósított formában szállítják.
Előállítása és reakciói[szerkesztés]
Előállítható elemi kén és fluor reakciójával, ezt a módszert használták a vegyület felfedezői, Henri Moissan és Paul Lebeau 1901-ben. A reakció erősen exoterm.[7]
A folyamat során más kén-fluoridok is keletkeznek, de ezeket el lehet távolítani: ipari előállítása során a keveréket 400 °C-ra hevítik, így a(z erősen mérgező) S2F10 diszproporcionál:
majd a terméket nátrium-hidroxidos gázmosón átvezetve a maradék SF4 is elbontható:
A kapott kén-hexafluoridot desztillációval tisztítják.
Egy alternatív, brómot alkalmazó módszerrel SF4 és CoF3 viszonylag alacsony (pl. 100 °C) hőmérsékleten végzett reakciójával is előállítható:[8]
A kén-hexafluoridnak alig ismertek reakciói. Közömbösségét főként a kénatom sztérikusan gátolt volta okozza, míg a 16. csoport nehezebb elemeinek megfelelője, például a szelén-hexafluorid (SeF6) sztérikusan már kevésbé zsúfolt, és reakcióképesebb.[9] Nem reagál az olvadt nátriummal annak forráspontja alatt,[10] de lítiummal exoterm reakcióba lép.
Folyékony ammóniában az alkálifémek a megfelelő szulfidokká és fluoridokká redukálják:[11]
Hidrogén-szulfid jelenlétében szinproporciós reakcióban elemi kén és hidrogén-fluorid (HF) keletkezik:
Üvegházhatása[szerkesztés]

Az Éghajlatváltozási Kormányközi Testület szerint az általuk vizsgáltak közül a SF6 a legerősebben üvegházhatású gáz, globális felmelegedési potenciálja 100 éves időtartamot tekintve a CO2-énak 23 900-szerese.[12] Mérések szerint a SF6 koncentrációja évente kb. 0,2 ppt-t nőve 2018 februárjában 9 ppt volt.[13][14] A légkörben rendkívül sokáig megmarad, a troposzférában és a sztratoszférában sem lép reakcióba, becsült élettartama 800–3200 év.[15] Átlagos globális koncentrációja évente kb. 7%-kal nőtt az 1980-as és 1990-es években, elsősorban a magnézium előállításához, valamint az elektromos és elektronikai iparban történő felhasználása miatt. Tekintve, hogy a szén-dioxidhoz képest kis mértékű a kibocsátása, a globális felmelegedéshez való hozzájárulása a becslések szerint kevesebb, mint 0,2%.[16]
Európában a SF6 az F-gáz rendelet hatálya alá tartozik, mely az anyag számos felhasználását szabályozza vagy megtiltja. 2006. január 1. óta nem használható nyomjelző gázként.[17]
Élettani hatásai és óvintézkedések[szerkesztés]
Érdekessége, hogy kis, biztonságos adag belélegzése során az emberi hang mélyebb lesz. Ennek magyarázata az, hogy az emberi vokális traktus tulajdonképpen egy akusztikus rezonátor. Annak a sajátfrekvenciája egyenesen arányos az üreget kitöltő anyagban uralkodó hangsebességgel. A kén-hexafluoridban pedig 0,44-szor lassabban terjed a hang, mint a levegőben. Ezzel ellentétben a hélium belélegzésekor a hang magasabb lesz, mert a héliumban a hang háromszor gyorsabban terjed, mint a levegőben.[18]
Ezt mutatta be Adam Savage az Állítólag… című televíziós műsorban 2008. szeptember 3-án. A műsor során hélium belélegzésére is sor került, amitől magasabb lett a belélegző hangja.[19]
Habár a kén-hexafluorid belégzése újszerű szórakozás lehet, a mutatvány veszélyessé válhat. Ennek oka, hogy a többi közömbös gázhoz hasonlóan az SF6 nemcsak az oxigént szorítja ki a tüdőből, hanem a légzési reflexet elsődlegesen kiváltó szén-dioxidot is. Általában elmondható, hogy a sűrű, szagtalan gázok zárt területen fulladást okozhatnak.
Az extrém üvegház hatású anyagokhoz tartozik, légköri lebomlási ideje több ezer év.[20]
Felhasználása[szerkesztés]
Évente több, mint 10 000 tonnát állítanak elő, melynek nagy részét (több, mint 8000 tonna) dielektrikumként használják fel a villamosiparban.[21] Felhasználják továbbá védőgázként a magnéziumöntés során.
Villamos erőátvitel[szerkesztés]
A levegőnél ötször nagyobb sűrűsége és jóval nagyobb villamos szilárdsága (az 1...6 bar nyomástartományban kb. 2,5...3-szoros) miatt nagy zárlati teljesítményű hálózatok megszakítóiban alkalmazzák gáztöltetként. A kén-hexafluoridban égő ív azonos gáznyomás és áramerősség esetén jóval kisebb átmérőjű, mint levegőben. Az ív kialvásakor a gáztér ionjainak rekombinációja gyorsabb, és a gáztér villamos szilárdsága sokkal gyorsabban tér vissza.
Ablakok hangszigetelése[szerkesztés]
A nagy sűrűség jelentős hangcsillapítást eredményez a ragasztott ablaküvegeknél. Ez a hang sebességének nagy mértékű csökkenésével van összefüggésben. Míg a levegőben ez a sebesség 330 m/s, addig a kén-hexafluoridban mindössze 130 m/s. Hőszigetelése viszont rosszabb az erre a célra általánosan használt argonénál.
Gépjárművek gumiabroncsai[szerkesztés]
1984 óta a németországi gépkocsivezetők levegő helyett kén-hexafluoriddal is feltölthetik a gumiabroncsaikat. Mivel a gáz molekulái sokkal nagyobb méretűek a levegő molekuláinál, sokkal lassabban diffundálnak a gumiabroncson keresztül. A Continental AG például biztosította a vevőket, hogy ilyen módon akár egy évig is stabil marad a guminyomás. A tartósan egyenletes nyomás növeli a közlekedés biztonságát és meghosszabbítja a gumik élettartamát.
További információk[szerkesztés]
- ↑ a b c A kén-hexafluorid vegyülethez tartozó bejegyzés az IFA GESTIS adatbázisából. A hozzáférés dátuma: 2019. augusztus 2. (JavaScript szükséges) (angolul)
- ↑ (2002) „Measurement and calculation of critical points for binary and ternary mixtures”. AIChE Journal 48 (10), 2350–2356. o. DOI:10.1002/aic.690481024. ISSN 00011541.
- ↑ a b c d NIOSH Pocket Guide to Chemical Hazards #0576. National Institute for Occupational Safety and Health (NIOSH)
- ↑ (2018) „Reference Values and Reference Correlations for the Thermal Conductivity and Viscosity of Fluids”. Journal of Physical and Chemical Reference Data 47 (2), 021501. o. DOI:10.1063/1.5036625. ISSN 0047-2689.
- ↑ (2012) „Reference Correlation of the Thermal Conductivity of Sulfur Hexafluoride from the Triple Point to 1000 K and up to 150 MPa”. Journal of Physical and Chemical Reference Data 41 (2), 023104–023104-9. o. DOI:10.1063/1.4708620. ISSN 0047-2689.
- ↑ a b Zumdahl, Steven S.. Chemical Principles 6th Ed. Houghton Mifflin Company, A23. o. (2009). ISBN 978-0-618-94690-7
- ↑ Chase, M.W., Jr., NIST-JANAF Themochemical Tables, Fourth Edition, J. Phys. Chem. Ref. Data, Monograph 9, 1998, 1–1951.
- ↑ Winter R.W., Pugh J.R. and Cook P.W. (Jan. 9-14, 2011). “SF5Cl, SF4 and SF6: Their Bromine−facilitated Production & a New Preparation Method for SF5Br”. 20th Winter Fluorine Conference.
- ↑ Inorganic Chemistry. W. H. Freeman, 409. o. (2010). ISBN 978-1429252553
- ↑ Advanced Inorganic Chemistry: Volume II, 12th, GOEL Publishing House, 160. o. (2010) Extract of page 160
- ↑ Holger Deubner, Florian Kraus, Holger Lars Deubner, Florian Kraus (2017. október 13.). „The Decomposition Products of Sulfur Hexafluoride (SF6) with Metals Dissolved in Liquid Ammonia”. Inorganics 5 (4), 68. o. DOI:10.3390/inorganics5040068. (Hozzáférés: 2018. szeptember 18.)
- ↑ 2.10.2 Direct Global Warming Potentials. Intergovernmental Panel on Climate Change, 2007. [2013. március 2-i dátummal az eredetiből archiválva]. (Hozzáférés: 2013. február 22.)
- ↑ Chromatograph for Atmospheric Trace Species SF6 Mixing Ratio. US National Oceanic and Atmospheric Administration. [2012. január 18-i dátummal az eredetiből archiválva]. (Hozzáférés: 2013. február 22.)
- ↑ Sulfur hexaflouride (SF6) data from hourly in situ samples analyzed on a gas chromatograph located at Cape Matatulu (SMO), American Samoa (14.3 S, 170.6 W, elevation: 77 m). (Hozzáférés: 2018. április 11.)
- ↑ A. R. Ravishankara, S. Solomon, A. A. Turnipseed, R. F. Warren (1993. január 8.). „Atmospheric Lifetimes of Long-Lived Halogenated Species”. Science 259 (5092), 194–199. o. [2015. szeptember 24-i dátummal az eredetiből archiválva]. DOI:10.1126/science.259.5092.194. PMID 17790983. (Hozzáférés: 2013. február 22.)
- ↑ SF6 Sulfur Hexafluoride. PowerPlantCCS Blog, 2011. március 19. [2012. december 30-i dátummal az eredetiből archiválva]. (Hozzáférés: 2013. február 22.)
- ↑ Climate: MEPs give F-gas bill a 'green boost'. EurActiv.com, 2005. október 13. [2013. június 3-i dátummal az eredetiből archiválva]. (Hozzáférés: 2013. február 22.)
- ↑ Physics in speech. phys.unsw.edu.au, 2010. március 30. [2004. december 10-i dátummal az eredetiből archiválva]. (Hozzáférés: 2010. március 30.)
- ↑ Mythbusters - Fun With Gas. YouTube, 2008. június 2. (Hozzáférés: 2008. szeptember 9.)
- ↑ weblaboratorium.hu Kísérletek kén-hexafluoriddal
- ↑ Sulfur Hexafluoride: Global Environmental Effects and Toxic Byproduct Formation. Taylor and Francis (2012)







