Bullvalén
| Bullvalén | |||
 |
| ||
| Más nevek | Bullvalén | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 1005-51-2 | ||
| PubChem | 136796 | ||
| ChemSpider | 120549 | ||
| |||
| |||
| InChIKey | UKFBVTJTKMSPMI-UHFFFAOYSA-N | ||
| UNII | ZQZ1X09E2B | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C10H10 | ||
| Moláris tömeg | 130,19 g/mol | ||
| Olvadáspont | 96 °C | ||
| Forráspont | (bomlik) | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
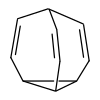
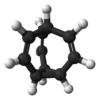
A bullvalén szénhidrogén, képlete C10H10. A molekula ketrecszerű szerkezete egy ciklopropán- és három ciklohepta-1,4-diéngyűrű kondenzálásából jön létre. A bullvalén különleges szerves vegyület, ahol a C–C és C=C kötések gyorsan képződnek és szűnnek meg NMR-időskálán, így fluxiós molekula.[1]
Sztereodinamika
[szerkesztés]A bullvalén ciklopropán három viniléncsoporttal, melyek egy metincsoportban csatlakoznak. Ez lehetővé tesz egy elfajult Cope-átrendeződést, így minden szén- és hidrogénatom ekvivalens NMR-időskálán. Standard hőmérsékleten a proton-NMR-jelek átlaga egy 5,76 ppm-es csúcs.[2] Alacsony hőmérsékleteken e csúcs szélesedik, és nagyon alacsony hőmérsékleten a bullvalén fluxiós viselkedése csökken, 4 jelet láthatóvá téve. Ez a minta a 4 szűkülő rezonancia frekvenciaelválasztásához közeli k-val rendelkező cseréhez hasonlít. A 10 megkülönböztethető hellyel rendelkező bullvalénnek különböző vegyérték-tautomerje lehet, nem számolva az enantiomereket.

Szintézis
[szerkesztés]1963-ban G. Schröder ciklooktatetraén-dimer fotolízisével állított elő bullvalént. A reakció mellékterméke benzol.[3]
1966-ban W. von Eggers Doering és Joel W. Rosenthal cisz-9,10-dihidronaftalin átrendezésével állították elő.[4]
Hasonló vegyületek
[szerkesztés]Bullvalonok
[szerkesztés]A bullvalonokban a bullvalén egyik vinilcsoportja helyett metilénhídon lévő ketocsoport van. Így a fluxiós állapot bázis hozzáadásával aktiválható, a bázis eltávolításával megszüntethető:[5]

A jobb oldali képen az 1. vegyület nem fluxiós molekula, de bázis (nátrium-metoxid metanolos oldata) hozzáadásával a keton enoláttá (2) alakul, és a fluxiós állapot aktiválódik. A deutériumos jelölés lehetséges, ez először a 3. vegyületet adja, majd egy legfeljebb 7 deutériumatomos keveréket ad, melynek egyik tagja a 4. vegyület.
Szemibullvalén
[szerkesztés]A szemibullvalénben (C8H8) egy vinilén helyén egy kötés van. Ezt először barrelén fotolízisével állították elő izopentánban aceton fényérzékenyítő anyaggal 1966-ban.[6]

A szemibullvalénnek csak két vegyérték-tautomerje van (2a és 2b), de a molekulában a Cope-átrendeződés -110 °C-on is végbemegy, bár e hőmérsékleten e reakció gyakran nem egy végbe.
Ennek reakciómechanizmusa izotópkeveréssel megismerhető.[7] A 6 vinilproton a barrelénben (1) sokkal savasabb, mint a két hídfőproton, így deutériumra cserélhetők N-deutériociklohexilaminnal. A 2. vegyület fotolízise ciklopropángyűrűs biradikálist ad. E vegyület új intermedierré válik allilgyökkel két mezomerként. A rendszerközi keresztezés és a gyökös rekombináció azonos mennyiségű 3-as és 4-es szemibullvalént ad. Az új protonelrendeződés igazolja e modellt. A barrelén–szemibullvalén átrendeződés di-π-metán-átrendeződés.

Az alkilszemibullvalének 2006-ban közölt szintézise egy szubsztituált 1,4-dilitiobuta-1,3-dién ciklodimerizációján alapul réz(I)-bromiddal.[8] 140 °C-on az etilszemibullvalén a megfelelő ciklooktatetraén-származékká izomerizálódik.

Barbaralán
[szerkesztés]A barbaralánban egy etilén helyén metilén van, dinamikája a szemibullvalénéhez hasonlít. Ezenkívül a bullvalénszintézisben van ketonköztitermék, a „barbaralon”. Mindkettő névadója Barbara M. Ferrier[9] (1932–2006), a McMaster Egyetem biokémiai és bioorvostani karának professzora.[10]
A név eredete
[szerkesztés]A bullvalén név egy tudós, William „Bull” Doering[11] becenevéből ered,[* 1] aki a tulajdonságait és a vegyérték-tautoméria fogalmát 1963-ban megjósolta.[12] Klärner (2011) szerint Doering heti szemináriumait tanulói titokban „bull session” néven emlegették, és „féltek tőle azok, akik nem készültek eléggé”.[13] A nevet 1961-ben Doering két Yale-en tanuló diákja, Maitland Jones Jr. és Ron Magid adták a molekulának. A név William Doering becenevére utal, és a fulvalénnel való rímelés végett lett kiválasztva, mely iránt a kutatcsoport nagyon érdeklődött.[14]
Megjegyzések
[szerkesztés]- ↑ Author Ault (2001) szerint a név a „bullshit” szóból ered egy nem érdeklődő tanuló miatt
Hivatkozások
[szerkesztés]- ↑ Addison Ault (2001). „The Bullvalene Story. The Conception of Bullvalene, a Molecule That Has No Permanent Structure”. Journal of Chemical Education 78 (7), 924. o. DOI:10.1021/ed078p924.
- ↑ (1974) „Comparison of 13C- and 1H- magnetic resonance spectroscopy as techniques for the quantitative investigation of dynamic processes. The Cope rearrangement in bullvalene.”. Helv Chim Acta 57 (5), 1415–1433. o. DOI:10.1002/hlca.19740570518.
- ↑ Schröder, Gerhard. „Preparation and Properties of Tricyclo[3,3,2,04,6deca-2,7,9-triene (Bullvalene)]” (angol nyelven). Angewandte Chemie International Edition in English 2 (8), 481–482. o. DOI:10.1002/anie.196304814. ISSN 0570-0833.
- ↑ (1966) „9,10-Dihydronaphthalene. Formation from Bullvalene and Nenitzescu's Hydrocarbon, Thermal Reorganization, and Photorearrangement to Bullvalene”. J. Am. Chem. Soc. 88 (9), 2078–2079. o. DOI:10.1021/ja00961a061.
- ↑ (2006) „Synthesis of Oligosubstituted Bullvalones: Shapeshifting Molecules Under Basic Conditions”. J. Am. Chem. Soc. 128 (46), 14738–14739. o. DOI:10.1021/ja063900+. PMID 17105247.
- ↑ (1966) „The Chemistry of Barrelene. III. A Unique Photoisomerization to Semibullvalene”. J. Am. Chem. Soc. 88 (1), 183–184. o. DOI:10.1021/ja00953a045.
- ↑ (1967) „Mechanistic Organic Photochemistry. XXIV. The Mechanism of the Conversion of Barrelene to Semibullvalene. A General Photochemical Process”. J. Am. Chem. Soc. 89 (15), 3932–3933. o. DOI:10.1021/ja00991a064.
- ↑ (2006) „Metal-Mediated Efficient Synthesis, Structural Characterization, and Skeletal Rearrangement of Octasubstituted Semibullvalenes”. J. Am. Chem. Soc. 128 (14), 4564–4565. o. DOI:10.1021/ja0579208. PMID 16594680.
- ↑ Alex Nickon, Ernest F. Silversmith. Organic Chemistry: The Name Game: Modern Coined Terms and Their Origins. Pergamon Press, 133. o. (1987)
- ↑ A tribute to professor emeritus Barbara Ferrier Archiválva 2017. január 2-i dátummal a Wayback Machine-ben., McMaster University, 2006. január 6.
- ↑ (2001) „The Bullvalene Story. The Conception of Bullvalene, a Molecule That Has No Permanent Structure”. J. Chem. Educ. 78 (7), 924. o. DOI:10.1021/ed078p924.
- ↑ (1963) „A Rapidly Reversible Degenerate Cope Rearrangement: Bicyclo[5.1.0]octa-2,5-diene”. Tetrahedron 19 (5), 715–737. o. DOI:10.1016/S0040-4020(01)99207-5. [halott link]
- ↑ Klärner, F.-G. (2011). „William von Eggers Doering (1917–2011)”. Angewandte Chemie International Edition 50, 2885–2886. o. DOI:10.1002/anie.201100453.
- ↑ Nickon, A.; Silversmith, E. F. Organic Chemistry: The Name Game; Pergamon: New York, 1972; p 131.
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a Bullvalene című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.

