Ciklooktatetraén
| Ciklooktatetraén | |||
 |

| ||
| IUPAC-név | Ciklookta-1,3,5,7-tetraén[1] | ||
| Más nevek | Ciklooktatetraén, COT | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| |||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C8H8 | ||
| Moláris tömeg | 104,15 g/mol | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A ciklooktatetraén egy instabil, alifás, nem síkalkatú, folyékony annulén, amelynek anionja, a ciklooktatetraenid (C8H2−8) anion aromás, és komplexeket alkot többek közt lantanoidákkal, aktinoidákkal (pl. uranocén, neptunocén) és alkálifémekkel (pl. kálium-ciklooktatetraenid).[2][3]
Története[szerkesztés]
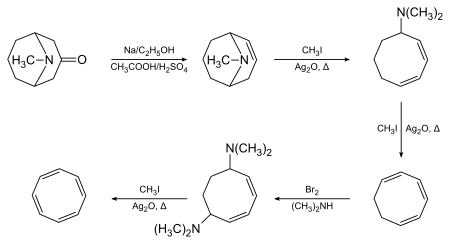
Az 1,3,5,7-ciklooktetetraént először pszeudopelletierinből állította elő Richard Willstätter az alábbi többlépéses reakcióval, melynek kulcslépése a Hofmann-elimináció:[4][5]
Willstätter leírta, hogy a kapott vegyület nem rendelkezett a várt aromássággal. 1939–1943 között amerikai kémikusok sikertelenül próbálták a ciklooktatetraént előállítani. Sikertelenségüket azon következtetéssel magyarázták, hogy Willstätter valójában nem a vegyületet szintetizálta, hanem az izomerjét, a sztirolt. Willstätter e vádakra önéletrajzában válaszolt, ahol leírta, hogy az amerikai kémikusok könnyen tudták redukálni a ciklooktatetraént ciklooktánra, ami lehetetlen a sztirol esetén. A második világháború idején Walter Reppe a ludwigshafeni BASF-nél kifejlesztett egy egylépéses ciklooktatetraén-szintézist acetilénből, ami a Willstätter által létrehozottal azonos anyagot hoz létre.[6] Minden, Willstätter eredeti szintézisével kapcsolatos fennmaradó kétség megszűnt, amikor Arthur C. Cope és munkatársai az MIT-nél 1947-ben bejelentették Willstätter szintézisének lépésről lépésre való megismétlését az eredeti technikák felhasználásával. Ugyanúgy ciklooktatetraént kaptak,[7] és később közölték számos köztitermék spektrometriás jellemzését, ami szintén igazolja Willstätter eredeti munkájának pontosságát.[8]
Szerkezete[szerkesztés]

Már a korai tanulmányokban ismert volt, hogy a COT kémiája nem egy aromás vegyületé.[9] Később a korai elektrondiffrakciós kísérletekből az következett, hogy a C–C kötéshosszok azonosak.[10] Ugyanakkor, H. S. Kaufman röntgendiffrakciós adatai kimutatták, hogy a ciklooktatetraén különböző konformációkat vesz fel, s két eltérő C–C kötéshossz van benne.[11] Ez az eredmény megmutatta, hogy a COT olyan annulén, melyben rögzítettek és váltakoznak az egyes és kettős kötések.
Normálállapotában a ciklooktatetraén nem síkalkatú, hanem kád konformációt vesz fel, ahol a C=C–C szög 126,1°, a C=C–H 117,6°.[12] A ciklooktatetraén pontcsoportja D2d.[13]
Síkalkatú átmeneti állapotában a D4h átmeneti állapot stabilabb a D8h-nál a Jahn–Teller-effektus miatt.[14]
Szintézise[szerkesztés]
Richard Willstätter eredeti szintézise (4 egymást követő elimináció egy ciklooktángyűrűn) relatív kevés ciklooktatetraént eredményez. Reppe ciklooktatetraén-szintézise, ahol magas nyomású acetilén magas hőmérsékletű nikkel-cianid és kalcium-karbid keverékével való kezelése történik, sokkal jobb: kb. 90%-os hatékonyságú:[6]
A COT egyik szerkezeti izomerje, a barrelén fotolízisével is előállítható, ami egy másik izolálható izomer, a szemibullvalén reakciójával állítható elő.[15] A COT származékai szemibullvalén-köztitermékekből is előállíthatók. Az alábbi képen az oktaetilciklooktatetraén (C8(C2H5)8) az oktaetilszemibullvalén termikus izomerizációjával jön létre, ami az 1,2,3,4-tetraetil-1,4-dilitio-1,3-butadién réz(I)-bromid által katalizált dimerizációjával keletkezik.[16]
Mivel a COT instabil, és könnyen keletkeznek belőle szerves peroxidok, kevés hidrokinont adnak a kereskedelmileg hozzáférhető anyaghoz. Tanácsos ellenőrizni korábban kinyitott üveg használatakor, hogy vannak-e benne szerves peroxidok: az üveg nyaka körüli fehér kristályokat peroxidok alkothatják, amik mechanikai behatásra robbanhatnak.
Természetes előfordulása[szerkesztés]
A ciklooktatetraént kimutatták egyes gombákból.[17]
Reakciói[szerkesztés]
Hasonló addíciós reakciókon megy keresztül, mint az alkének, szemben az aromás vegyületekkel. Mono- és poliepoxidok hozhatók létre a peroxisavakkal vagy a dimetil-dioxiránnal való reakcióval. További addíciós reakciók is ismertek. Ezen kívül a poliacetilén szintetizálható a ciklooktatetraén gyűrűnyitásos polimerizációjával.[18] A ciklooktatetraént és oldalláncokkal rendelkező analógjait is felhasználják ligandumokként és szendvicsvegyületekben.
A ciklooktatetraén átrendeződési reakciókon is átmegy, melyek végterméke aromás vegyület. Például higany(II)-szulfát vizes oldatával való oxidációja fenilacetaldehidet,[6][19] monoepoxidjának fény hatására történő átrendeződése benzofuránt eredményez.[20]
Jegyzetek[szerkesztés]
- ↑ Front Matter, Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry, P001–P004. o.. DOI: 10.1039/9781849733069-FP001 (2014. április 25.). ISBN 978-0-85404-182-4
- ↑ Katz, Thomas J. (1960. április 25.). „The cyclooctatetraenyl dianion”. J. Am. Chem. Soc. 82 (14), 3784–3785. o. DOI:10.1021/ja01499a077.
- ↑ JST Nanostructed Materials Project Highlights – Prof. Nakajima's Presentation, 2004. [2008. február 19-i dátummal az eredetiből archiválva]. (Hozzáférés: 2021. július 22.)
- ↑ Mason, S. (1997. február 1.). „The Science and Humanism of Linus Pauling (1901−1994)”. Chem. Soc. Rev. 26, 29–39. o. DOI:10.1039/CS9972600029.
- ↑ (1911) „Über Cyclo-octatetraen”. Berichte der Deutschen Chemischen Gesellschaft 44 (3), 3423–3445. o. DOI:10.1002/cber.191104403216.
- ↑ a b c (1948) „Cyclisierende Polymerisation von Acetylen. I. Über Cyclooctatetraen”. Justus Liebigs Annalen der Chemie 560 (1), 1–92. o. DOI:10.1002/jlac.19485600102.
- ↑ (1947) „The synthesis of cycloöctatetraene from pseudopelletierine”. Journal of the American Chemical Society 69 (4), 976. o. DOI:10.1021/ja01196a513. PMID 20292490.
- ↑ (1947) „Cyclic Polyolefins. I. Synthesis of Cycloöctatetraene from Pseudopelletierine”. Journal of the American Chemical Society 70 (4), 1433–1437. o. DOI:10.1021/ja01184a041. PMID 18915758.
- ↑ Johnson, A. W. (1947. április 25.). „Organic Chemistry”. Sci. Progr. 35 (139), 506–515. o.
- ↑ (1947) „The 'Octa-Benzene', Cyclo-octatetraene (C8H8)”. Nature 160 (4056), 128. o. DOI:10.1038/160128a0.
- ↑ (1948) „Structure of Cyclo-octatetraene”. Nature 161 (4083), 165. o. DOI:10.1038/161165a0.
- ↑ (1978) „High resolution Raman spectroscopy of gases with laser sources. XIII – the pure rotational spectra of 1,3,5,7-cyclooctatetraene and 1,5-cyclooctadiene”. J. Raman Spectr. 7 (6), 353–357. o. DOI:10.1002/jrs.1250070614.
- ↑ (1988. szeptember 15.) „Structure of cyclooctatetraene at 129 K”. Acta Crystallogr. C 44 (9), 1632–1634. o. DOI:10.1107/S0108270188005840.
- ↑ (2010. február 5.) „Recent Studies on the Aromaticity and Antiaromaticity of Planar Cyclooctatetraene”. Symmetry 2 (1), 76–97. o. DOI:10.3390/sym2010076.
- ↑ (1966) „The Chemistry of Barrelene. III. A Unique Photoisomerization to Semibullvalene”. J. Am. Chem. Soc. 88 (1), 183–184. o. DOI:10.1021/ja00953a045.
- ↑ (2006) „Metal-Mediated Efficient Synthesis, Structural Characterization, and Skeletal Rearrangement of Octasubstituted Semibullvalenes”. J. Am. Chem. Soc. 128 (14), 4564–4565. o. DOI:10.1021/ja0579208. PMID 16594680.
- ↑ (2003) „An endophytic Gliocladium sp. of Eucryphia cordifolia producing selective volatile antimicrobial compounds”. Plant Sci. 165 (4), 913–922. o. DOI:10.1016/S0168-9452(03)00299-1.
- ↑ (2009. augusztus 1.) „Two Undergraduate Experiments in Organic Polymers: The Preparation of Polyacetylene and Telechelic Polyacetylene via Ring-Opening Metathesis Polymerization”. J. Chem. Educ. 86 (8), 973. o. DOI:10.1021/ed086p973.
- ↑ (1953. április 25.) „Cyclopolyolefins Derived from Acetylene”. Bulletin of the Institute for Chemical Research, Kyoto University 31 (5), 323–335. o.
- ↑ (1968. április 25.) „Photolysis and photoisomerization of cyclooctatetraene oxide”. Journal of the American Chemical Society 90 (18), 5041–5043. o. DOI:10.1021/ja01020a058.
Fordítás[szerkesztés]
Ez a szócikk részben vagy egészben a Cyclooctatetraene című angol Wikipédia-szócikk fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.