Fluxiós molekula
A fluxiós molekulák olyan molekulák, melyek dinamikus változásai során atomjai egy része vagy egésze szimmetriaekvivalens helyzetek közt megy át.[1] Mivel gyakorlatilag minden molekula fluxiós bizonyos szempontok, például kötésfordulás szerint, a „fluxiós” szó használata a kontextustól és a dinamikát meghatározó módszertől függ. Gyakran egy molekulát akkor tekintenek fluxiósnak, ha spektroszkópiai sávjai a Heisenberg-féle határozatlansági elv által meghatározottnál nagyobb sávszélesedést mutatnak a kémiai cserék miatt.[2] Egyes esetekben lassú fluxió esetén a fluxiós molekulát nem spektroszkópiailag, hanem izotópjelöléssel vagy máshogy határozzák meg.[3]
Spektroszkópiai vizsgálatok[szerkesztés]
Számos fémorganikus vegyület fluxiós.[4] A fluxiósság mindenre kiterjed.
NMR-spektroszkópia[szerkesztés]
Az NMR-spektrumok hőmérsékletfüggő változásai a fluxiós molekulákkal összefüggő dinamikából következnek, ha ezek az NMR által észlelhető frekvenciakülönbségeknek megfelelő sebességgel történnek. E kísérlet a DNMR, és jellemzően különböző hőmérsékleteken való spektrumfelvételből állnak. Ideális esetben az alacsony hőmérsékletű spektrumok a „lassúcsere-határhoz” rendelhetők, mivel magas hőmérsékleten az ekvivalens helyek kiegyenlítődnek. A DNMR előtt a reakciókinetikát nem egyensúlyi keverékeken vizsgálták az egyensúly felé haladást vizsgálva.
Sok molekuláris folyamat fluxiós, ami NMR időskálán is vizsgálható.[5] A későbbi példákon kívül további gyakori példa a bullvalén Cope-átrendeződése és a ciklohexán gyűrűátfordulása.
A hagyományos DNMR-elemzéshez túl lassú folyamatokhoz a spintelítéstranszfer (SST, más néven EXSY, cserespektroszkópia) használható. Ez a frekvenciáról ad információt, ha az 1/T1 feletti.[6]
IR-spektroszkópia[szerkesztés]
Bár kevésbé gyakori, egyes dinamikus változások az infravörös spektroszkópia szintjén is észlelhetők. Példa erre a kevert vegyértékű fémklaszterdimerek elektronátvitele. Két 10 cm−1 eltérésű frekvencia egyesülésére az egyenlet eredménye:[7]
Tehát az IR időskálán lévő sávszélesedést tartalmazó folyamatoknak gyorsabbnak kell lenniük az NMR-időskálán végbemenőknél.
Példák[szerkesztés]
Ciklohexán és hasonló gyűrűk[szerkesztés]
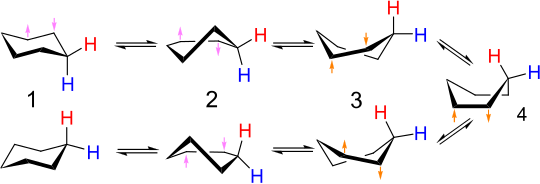
A ciklohexán és számos hasonló gyűrűs vegyület ekvivalens állapotai közti átmenet a gyűrűátfordulás. Az egyik konformáció axiális C–H kötései a másikban ekvatoriálisak lesznek, és fordítva. Standard hőmérsékleten az egyensúly gyorsan beáll. A proton- és 13C-NMR-spektrumok csak szinguletteket mutatnak standard hőmérséklet körül. Alacsony hőmérsékleten a proton-NMR spektrum szingulettje felbomlik, de a 13C-NMR-spektrumé nem változik.[9]
5 koordinációs számú vegyületek Berry-pszeudorotációja[szerkesztés]

Gyakori fluxiós molekula a foszfor-pentafluorid. A 19F-NMR spektruma egy 31P-hez kapcsolódó dublettből áll, ez alapján az ekvatoriális és az axiális fluoratomok NMR-időskálán gyorsan cserélődnek. A 19F-spektroszkópia még −100 °C-on se különbözteti meg az axiális és az ekvatoriális fluoratomokat. Ezen ekvivalencia oka a Berry-pszeudorotáció alacsony aktivációs energiája, mely során gyorsan helyet cserélnek az axiális és az ekvatoriális fluoratomok.[10] A vas-pentakarbonil (Fe(CO)5) a PF5 mintáját követi: csak egy jel észlelhető a 13Cspektrumában standard hőmérséklet körül, alacsony hőmérsékleten két jel észlelhető 2:3 arányban. A kén-tetrafluoridban hasonló minta jelenik meg, bár abban csak 4 ligandum van.
Jól ismert fluxiós ion a metánium (CH+5).[11][12][13] E vegyületben, melynek IR-spektrumát kísérletileg megfigyelték[14][12] és felismerték,[15][16][17] a protoncsere aktivációs energiája a nullponti energia alatt van, így 0 K-en sincs egyértelműen meghatározható szerkezet – a hidrogénatomok mindig mozognak. Egész pontosan a CH+5 protonjainak térbeli elszolása sokkal szélesebb a metánban (CH4) lévő hidrogéneknél.[18][19]
6 koordinációs számú molekulák[szerkesztés]
Míg a fluxiósság az 5 koordinációs számú molekulák esetén gyakori, a 6 koordinációs számúak általában ridegebb oktaéderes molekulákat alkodnak, ahol a 6 ligandum szoros csoportot alkot a központ körül. E vegyületek Ray–Dutt-csavarodással és Bailar-csavarodással átrendeződnek, de ezek energiagátjai elég magasak, hogy ne vezessenek sávszélesedéshez. Egyes vegyületek esetén az átrendeződés egy ligandum disszociációja révén történik, 5 koordinációs számú intermediert adva, mely képes a fenti mechanizmusokra. Egy harmadik módszer, mely a Fe(CO)4(SiMe3)2 és a hasonló hidridkomplexek esetén fordul elő, a ligandumok átrendeződése a négy CO ligandum által meghatározott tetraéder lapjain való ligandumátrendeződés.[20]
Dimetilformamid[szerkesztés]
Fluxiós molekula továbbá a dimetilformamid (DMF).[21]

100 °C körül az 500 MHz-es proton-NMR-spektrum egy metilcsoportjelet mutat. Standard hőmérséklet körül azonban a nem ekvivalens metilcsoportokra külön jelek láthatók. A csere sebessége a két jel egyesülésének hőmérsékletekor számítható. Ez az egyesülési hőmérséklet mérési mezőtől függ. A megfelelő egyenlet:
ahol Δνo a különbség a két cserehely frekvenciája közt. Ezek az alacsony hőmérsékletű határ-NMR-spektrumból számíthatók. Alacsonyabb hőmérsékleten a dinamikus mozgás folytatódik, de az a sávszélesedéshez csak kevéssé járul hozzá.
Például ha Δνo = 1 ppm 500 MHz-en:
- (0,45 ms felezési idő)
„Gyűrűmozgás”[szerkesztés]
A Fe(η5-C5H5)(η1-C5H5)(CO)2 esetén „gyűrűmozgás” jelenik meg.

30 °C-on a proton-NMR-spektrumon 2 csúcs van, egy (δ5,6) a η5-C5H5, egy a η1-C5H5 ligandumhoz tartozik. Ez utóbbi szingulettje alacsony hőmérsékleten szétválik a Fe szénatomok közti ugrása miatt a η1-C5H5 ligandumon.[22] Két mechanizmust feltételeztek, a jelenleg elfogadott az 1,2-átrendeződés.[23]
Jegyzetek[szerkesztés]
- ↑ (2014) „Fluxional”. DOI:10.1351/goldbook.F02463.
- ↑ Drago, Russell S.. Physical Methods in Chemistry, 2nd, Philadelphia: W. B. Saunders (1977). ISBN 0-7216-3184-3
- ↑ J. Sandström. Dynamic NMR Spectroscopy. Academic Press (1982)
- ↑ John W. Faller. Stereochemical Nonrigidity of Organometallic Complexes, Encyclopedia of Inorganic and Bioinorganic Chemistry. Weinheim: Wiley-VCH. DOI: 10.1002/9781119951438.eibc0211 (2011)
- ↑ (1983) „The NMR time scale”. Journal of Chemical Education 60 (11), 933. o. DOI:10.1021/ed060p933.
- ↑ (1997) „Kinetics of Internal Rotation of N,N-Dimethylacetamide: A Spin-Saturation Transfer Experiment”. Journal of Chemical Education 74 (8), 978. o. DOI:10.1021/ed074p978.
- ↑ (2003) „Electron Transfer and Dynamic Infrared-Band Coalescence: It Looks Like Dynamic NMR Spectroscopy, but a Billion Times Faster”. Chemistry: A European Journal 9 (24), 5969ff. o. DOI:10.1002/chem.200305028. PMID 14679508.
- ↑ J, Clayden. Organic chemistry, 2nd, 373. o. (2003). ISBN 9780191666216
- ↑ (2005) „Conformational Study of cis-1,4-Di-tert-butylcyclohexane by Dynamic NMR Spectroscopy and Computational Methods. Observation of Chair and Twist-Boat Conformations”. J. Org. Chem. 70 (26), 10726–10731. o. DOI:10.1021/jo051654z. PMID 16355992.
- ↑ (1953) „Nuclear Magnetic Resonance Multiplets in Liquids”. J. Chem. Phys. 21 (2), 279. o. DOI:10.1063/1.1698874.
- ↑ (1999) „CH5+ Stability and Mass Spectrometry”. Science 286 (5442), 1051a–1051. o. DOI:10.1126/science.286.5442.1051a. ISSN 0036-8075.
- ↑ a b (1999) „CH5+: The infrared spectrum observed”. Science 284 (5411), 135–7. o. DOI:10.1126/science.284.5411.135. PMID 10102811.
- ↑ (1999) „MOLECULAR SPECTROSCOPY:CH5+: The Cheshire Cat Smiles”. Science 284 (5411), 59–61. o. DOI:10.1126/science.284.5411.59. ISSN 0036-8075.
- ↑ (1995) „Dynamics of Carbonium Ions Solvated by Molecular Hydrogen: CH5+(H2)n (n= 1, 2, 3)”. Science 269 (5220), 57–59. o. DOI:10.1126/science.269.5220.57. PMID 17787703.
- ↑ (2005) „Understanding the Infrared Spectrum of Bare CH+5”. Science 309 (5738), 1219–1222. o. DOI:10.1126/science.1113729. PMID 15994376.
- ↑ (2016) „Calculated rotation-bending energy levels of CH+5 and a comparison with experiment”. Journal of Chemical Physics 144 (20), 204304. o. DOI:10.1063/1.4948549. PMID 27250303.
- ↑ (2017) „Rotation-vibration motion of extremely flexible molecules - The molecular superrotor”. Chemical Physics Letters 672, 34–46. o. DOI:10.1016/j.cplett.2017.01.045.
- ↑ (2005) „CH5+: Chemistry's chameleon unmasked”. J. Am. Chem. Soc. 127 (13), 4954–4958. o. DOI:10.1021/ja0482280. PMID 15796561.
- ↑ A CH+5 dinamikus mozgásának ábrázolása Archiválva 2007. december 24-i dátummal a Wayback Machine-ben.
- ↑ (1977) „Stereochemically Nonrigid Six-Coordinate Metal Carbonyl Complexes. 1. Polytopal Rearrangement and X-Ray Structure of Tetracarbonylbis(trimethylsilyl)iron”. Inorganic Chemistry 16 (4), 897–902. o. DOI:10.1021/ic50170a035.
- ↑ (1956) „Rate Processes and Nuclear Magnetic Resonance Spectra. II. Hindered Internal Rotation of Amides”. J. Chem. Phys. 25 (6), 1228–1234. o. DOI:10.1063/1.1743184.
- ↑ (1966) „Stereochemically Nonrigid Organometallic Compounds. I. π-Cyclopentadienyliron Dicarbonyl σ-Cyclopentadiene”. J. Am. Chem. Soc. 1966 (88), 4371. o. DOI:10.1021/ja00971a012.
- ↑ Robert B. Jordan. Reaction Mechanisms of Inorganic and Organometallic Systems, Topics in Inorganic Chemistry (2007). ISBN 978-0195301007
Fordítás[szerkesztés]
Ez a szócikk részben vagy egészben a Fluxional molecule című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Források[szerkesztés]
- D. Papoušek, M. R. Aliev. Molecular Vibrational-Rotational Spectra. Amsterdam: Elsevier (1982)
- E. B. Wilson, J. C. Decius, P. C. Cross. Molecular Vibrations. New York: McGraw-Hill (1955) (reprinted: Dover, 1980)
- (1963) „The symmetry groups of non-rigid molecules”. Molecular Physics 6 (5), 445–460. o. DOI:10.1080/00268976300100501. : The use of permutation-inversion groups for the symmetry classification of the states of fluxional (or non-rigid) molecules.
- P. R. Bunker, P. Jensen. Fundamentals of Molecular Symmetry. CRC Press (1998). ISBN 0-7503-0941-5
- H. W. Kroto, Molecular Rotation Spectra, Wiley, New York, 1975 (Reprinted by Dover 1992), describing the term semi-rigid molecule.
- Philip R. Bunker and Per Jensen, Molecular Symmetry and Spectroscopy, 2nd edition, NRC Research Press, Ottawa, 1998 [1][halott link]



