Foszfor-pentafluorid
| Foszfor-pentafluorid | |||
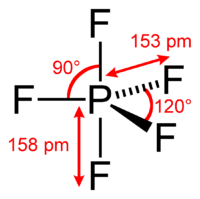 A foszfor-pentafluorid molekulaszerkezete | |||
 A foszfor-pentafluorid kalottamodellje | |||
| IUPAC-név | foszfor-pentafluorid | ||
| Más nevek | foszfor(V)-fluorid pentafluorfoszforán | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 7647-19-0 | ||
| PubChem | 24295 | ||
| ChemSpider | 22715 | ||
| EINECS-szám | 231-602-3 | ||
| RTECS szám | TH4070000 | ||
| |||
| |||
| InChIKey | OBCUTHMOOONNBS-UHFFFAOYSA-N | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | PF5 | ||
| Moláris tömeg | 125,966 g/mol | ||
| Megjelenés | színtelen gáz | ||
| Szag | kellemetlen | ||
| Sűrűség | 5,527 kg/m3 | ||
| Olvadáspont | −93,78 °C | ||
| Forráspont | −84,6 °C | ||
| Oldhatóság (vízben) | hidrolizál | ||
| Kristályszerkezet | |||
| Molekulaforma | trigonális bipiramis | ||
| Dipólusmomentum | 0 D | ||
| Veszélyek | |||
| Lobbanáspont | nem gyúlékony | ||
| Rokon vegyületek | |||
| Azonos kation | foszfor-pentaklorid foszfor-pentabromid foszfor-pentajodid | ||
| Azonos anion | arzén-pentafluorid antimon-pentafluorid bizmut-pentafluorid | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A foszfor-pentafluorid szervetlen vegyület, a foszfor egyik halogenidje, képlete PF5. Színtelen, mérgező gáz, levegőn – hidrolízise miatt – füstölög.[1][2]
Előállítása[szerkesztés]
Elsőként 1876-ban állították elő, a foszfor-pentaklorid arzén-trifluoriddal történő fluorozásával, ez az eljárás továbbra is használatos:[1]
- 3 PCl5 + 5 AsF3 → 3 PF5 + 5 AsCl3
Szerkezete[szerkesztés]
Egykristály röntgendiffrakciós vizsgálatok szerint a molekula szerkezete trigonális bipiramis, így benne két különböző P−F kötés található (axiális és ekvatoriális): az axiális P−F kötés hossza szilárd fázisban eltér az ekvatoriális P−F kötés hosszától, folyadék vagy gáz fázisban azonban a pszeudorotáció miatt nincs ilyen különbség.
Fluor-19 NMR spektroszkópiával még −100 °C hőmérsékleten sem lehet megkülönböztetni az axiális és ekvatoriális fluoratomok környezetét. A tapasztalati egyezőség abból fakad, hogy a Berry-mechanizmus szerinti pszeudorotáció energiagátja alacsony, így az axiális és ekvatoriális fluoratomok helyzete gyorsan felcserélődik. A fluorcentrumok látszólagos ekvivalenciájára elsőként Gutowsky figyelt fel.[3] A jelenség magyarázatát R. Stephen Berry adta meg, aki után azt Berry-mechanizmusnak nevezték el. A pszeudorotáció azért módosítja a PF5 19F-NMR spektrumát, mert az NMR spektroszkópia ezredmásodperces időskálával rendelkezik. Az elektrondiffrakció és röntgenkrisztallográfia nem érzékeli ezt a jelenséget, mivel a szilárd halmazállapotú szerkezet – az oldatbeli molekulákkal ellentétben – statikus és az atomok helyzete nem tud megváltozni.
Jegyzetek[szerkesztés]
- ↑ a b W. Kwasnik "Phosphorus(V) fluoride" in Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY. Vol. 1. p. 190.
- ↑ Greenwood, N.N.. Az elemek kémiája, 1., Budapest: Nemzeti Tankönyvkiadó, 679. o. (1999). ISBN 963 18 9144 5
- ↑ (1953) „Nuclear Magnetic Resonance Multiplets in Liquids”. J. Chem. Phys. 21 (2), 279. o. DOI:10.1063/1.1698874.
Fordítás[szerkesztés]
- Ez a szócikk részben vagy egészben a Phosphorus pentafluoride című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
