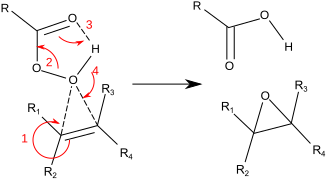Epoxidok

Az epoxidok háromtagú gyűrűs éterek. A molekula alakja közelítőleg egyenlő oldalú háromszög, ami jelentős gyűrűfeszültséget okoz, ezért az epoxidok erősen, más étereknél sokkal inkább reaktívak. Számos alkalmazásuk miatt nagy mennyiségben gyártják őket. A kisebb molekulatömegű epoxidok általában apoláris, színtelen, gyakran illékony vegyületek.[1]
Nevezéktanuk[szerkesztés]
Az epoxid funkciós csoportot tartalmazó vegyületeket lehet epoxi, epoxid, oxirán vagy etoxilin névvel nevezni. Az egyszerű epoxidokat gyakran oxidoknak nevezik. Az etilén (C2H4) epoxidját így etilén-oxidnak (C2H4O) nevezik. Számos vegyületnek hétköznapi neve van, az etilén-oxidot például „oxiránnak” hívják. Némelyik névben szerepel az epoxid funkciós csoportra utalás, ilyen például az 1,2-epoxiheptán, melyet más néven 1,2-heptén-oxidnak is neveznek.
Az epoxidból gyártott polimert epoxinak nevezik, de ezekben az anyagokban nincs epoxidcsoport (leszámítva a műgyanta gyártása közben esetleg el nem reagált néhány visszamaradó csoport).
Előállítása[szerkesztés]
Az iparilag legjelentősebb epoxidok az etilén- és propilén-oxid, ezekből évente mintegy 15, illetve 3 millió tonnát állítanak elő.[2]
Alkének heterogén katalitikus oxidációja[szerkesztés]
Az etilén oxigénnel történő epoxidálása az alább egyenlet szerint játszódik le:
- 7 H2C=CH2 + 6 O2 → 6 C2H4O + 2 CO2 + 2 H2O
Az alkének közvetlen oxigénnel történő reakciója csak ennek az epoxidnak az előállítására használható fel. A reakcióhoz többnyire módosított heterogén ezüst katalizátort használnak.[3] Más alkének, köztük a propilén sem reagál hasznosítható mértékben, bár TS-1 hordozós Au katalizátorok képesek a propilén szelektív epoxidálására.[4]
Olefinek oxidációja szerves peroxidokkal és fémkatalizátorokkal[szerkesztés]
Az etilén-oxid kivételével az epoxidokat alkének peroxidtartalmú reagensekkel történő kezelésével állítják elő, melyek egyetlen oxigénatomot adnak le. A szerves peroxidok hajlamosak a spontán bomlásra vagy akár öngyulladásra, ezért ezek a reakciók nagy elővigyázatosságot igényelnek.
A fémkomplexek hasznos katalizátorai a hidrogén-peroxiddal és alkil-hidroperoxidokkal történő epoxidálási reakcióknak. Az elektrofilebb peroxikarbonsavak fémkatalizátorok alkalmazása nélkül epoxiddá konvertálják az alkéneket. Speciális esetekben más peroxid tartalmú reagenseket, például dimetil-dioxiránt alkalmaznak. A reakciómechanizmus és a kiindulási alkén geometriájától függően cisz és/vagy transz epoxid diasztereomerek keletkezhetnek. Ha a kiindulási anyagban más sztereocentrumok is vannak, akkor ezek is befolyásolhatják az epoxidálás sztereokémiáját. A fémkatalizált epoxidálási reakciókat elsőként terc-butil-hidroperoxiddal (TBHP) vizsgálták.[5] A TBHP fémmel (M) történő kapcsolódása hozza létre az MOOR csoportot tartalmazó aktív peroxi komplexet, amely aztán az alkénre átvisz egy O centrumot.[6]
A propilén-oxid propilénből történő előállítására szerves peroxidokat használnak. A reakcióhoz katalizátor is szükséges. Oxigénforrásként t-butil-hidroperoxid és etillbenzol-hidroperoxid is szolgálhat.[7]
Olefinek peroxidálása peroxikarbonsavakkal[szerkesztés]
Jellemzően laboratóriumi célra a Prilezhaev-reakció használatos,[8][9] melynek során az alként peroxisavval, például m-CPBA-val oxidálják. Példaként álljon itt a sztirol-oxid előállítása sztirol perbenzoesavval történő epoxidálásával:[10]
A reakció az ún. „pillangó mechanizmus” szerint játszódik le.[11] A peroxid elektrofil és az alkén nukleofil között koncertikus reakció játszódik le (a lenti mechanizmusban a számok az egyszerűség kedvéért szerepelnek). A pillangó mechanizmus biztosítja az O−O szigma csillag pálya ideális pozícióját a C−C π-elektronok támadásához.[12] <--Because two bonds are broken and formed to the epoxide oxygen, this is formally an example of a coarctate transition state.-->
A katalitikus enantioszelektív opixidáláshoz, mint amilyen a Sharpless-epoxidálás és a Jacobsen-epoxidálás epoxidation, hidroperoxidokat is használnak. A Shi-epoxidálással együtt ezek a reakciók hasznosak királis epoxidok enantioszelektív szintéziséhez. Oxaziridin reagensek is felhasználhatók epoxidok alkénekből történő készítéséhez.
Homogén katalitikus aszimmetrikus epoxidálás[szerkesztés]
Királis epoxidokból gyakran lehet enantioszelektíven nyerni prokirális alkénekből. Sok fémkomplex aktív katalizátora e reakcióknak, de a legfontosabbak a titán, vanádium és molibdén komplexei.[13][14]
A Sharpless-epoxidálás az egyik legfőbb enantioszelektív kémiai reakció. Felhasználásával primer és szekunder allil-alkoholokból állítanak elő 2,3-epoxialkoholokat.[15][16]

Intramolekuláris SN2 szubsztitúció[szerkesztés]
Ebben az eljárásban dehidrohalogénezés történik. Maga a módszer a Williamson-féle éterszintézis egyik változata, melynek során egy alkoxidion intramolekulárisan lép egy klór helyébe. A kiindulási anyagokat halohidrinnek nevezzük.[18] A világ propilén-oxid termelésének nagy részét ezzel az eljárással állítják elő, propilén-klórhidrinből kiindulva.
Az intramolekuláris epoxid képződés a Darzens-reakció egyik kulcslépése.
A Johnson–Corey–Csajkovszkij-reakció során karbonilcsoportból és szulfónium ilidből képződik epoxid. Ebben a reakcióban klorid helyett szulfónium a távozó csoport.
Nukleofil epoxidálás[szerkesztés]
Elektronban szegény olefineket, például enonokat és akrilszármazékokat nukleofil oxigénvegyületekkel, például peroxidokkal lehet epoxidálni. A reakció mechanizmusa két lépéses. Első lépésben az oxigén nukleofil konjugált addícióval stabilizált karbaniont alakít ki, majd ez a karbanion ugyanezt az oxigénatomot megtámadva kiszorítja arról a távozó csoportot, ezzel bezárva az epoxidgyűrűt.
Bioszintézis[szerkesztés]
A természetben az epoxidok ritkán fordulnak elő. Keletkezési módjuk többnyire az alkénekre citokróm P450 hatására bekövetkező oxigéntranszfer.[19] (De lásd még a rövid életű, jelátvivő molekula szerepet betöltő epoxieikozatriénsavakat[20] és a hasonló epoxidokozapentaénsavakat és epoxieikozatetraénsavakat is.)
Reakcióik[szerkesztés]
Az epoxidok reakciókészségét a gyűrűnyitási reakciók uralják – az epoxidok erős elektrofilek. Ebben a reakcióban alkoholok, víz, aminok, tiolok és számos más reagens is lehet a nukleofil. Ez a reakció az alapja az epoxi ragasztóknak és a glikolok gyártásának. Savas körülmény között a nukleofil támadásának helyét mind a sztérikus hatások (mint normálisan az SN2 reakcióknál), mind a karbokation stabilitása (mint normálisan az SN1 reakcióknál) befolyásolja. Az epoxidok savkatalizált hidrolízise glikol terméket eredményez. A hidrolízis során a vízmolekula nukleofil addícióval lép be az epoxidba. Bázikus körülmények között – összhangban az SN2 folyamat normál menetével – a nukleofil a legkevésbé szubsztituált szénatomon támad. Tiokarbamiddal reagáltatva az epoxidokból szulfidok keletkeznek, ezek neve tiirán.
Az epoxidok polimerizációja poliétert eredményez, például etilén-oxidból polietilén-glikol, más néven polietilén-oxid keletkezik.
Az epoxidok gyűrű bővülési reakciói is ismertek, ilyen például a szén-dioxid beékelődése, melynek révén gyűrűs karbonátok keletkeznek.
Egyéb reakciók[szerkesztés]
- Az epoxidok lítium-alumínium-hidriddel vagy alumínium-hidriddel történő redukciója a megfelelő alkoholt eredményezi.[21] A redukció a hidridion (H−) nukleofil addíciójának következménye.
- Az epoxidok reduktív hasítása β-lítioalkoxidokat ad.[22]
- Volfrám-hexakloriddal és n-butillítiummal redukálva a megfelelő alkén keletkezik:[23]
Felhasználásuk[szerkesztés]
- Példák epoxidokra
-
A biszfenol-A-diglicidil-éter a háztartási „epoxi” egyik összetevője
-
A glicidol, egy gyakori vegyipari köztitermék kémiai szerkezete
-
Az epotilonok természetben előforduló epoxidok
-
Epoxidált linolein, az epoxidált szójababolaj fő alkotója, iparilag fontos lágyító
Az etilén-oxidot széles körben használják detergensek és felületaktív anyagok – etoxilálással történő – gyártására. Hidrolízisével etilénglikol nyerhető.
Az epoxidok és aminok közötti reakció az alapja az epoxi ragasztók és szerkezeti anyagok előállításának. Gyakran használt amin térhálósító a trietilén-tetramin (TETA).
Hivatkozások[szerkesztés]
- ↑ Ullmann Vegyipari Enciklopédia
- ↑ Siegfried Rebsdat, Dieter Mayer "Ethylene Oxide" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005.doi:10.1002/14356007.a10_117 Article Online Posting Date: March 15, 2001.
- ↑ http://www.tandfonline.com/doi/abs/10.1080/01614948708078611
- ↑ http://pubs.acs.org/doi/abs/10.1021/ie0513090
- ↑ Indictor, N.; Brill, W. F. J. Org. Chem., 1965, 30 (6), 2074. (doi:10.1021/jo01017a520).
- ↑ W. R. Thiel "Metal catalyzed oxidations. Part 5. Catalytic olefin epoxidation with seven-coordinate oxobisperoxo molybdenum complexes: a mechanistic study" Journal of Molecular Catalysis A: Chemical 1997, Volume 117, pp. 449–454. doi:10.1016/S1381-1169(96)00291-9
- ↑ Dietmar Kahlich, Uwe Wiechern, Jörg Lindner “Propylene Oxide” in Ullmann's Encyclopedia of Industrial Chemistry, 2002 by Wiley-VCH, Weinheim. doi:10.1002/14356007.a22_239
- ↑ March, Jerry. 1985. Advanced Organic Chemistry, Reactions, Mechanisms and Structure. 3rd ed. John Wiley & Sons. ISBN 0-471-85472-7.
- ↑ Nikolaus Prileschajew (1909). „Oxydation ungesättigter Verbindungen mittels organischer Superoxyde”. Berichte der deutschen chemischen Gesellschaft 42 (4), 4811–4815. o. DOI:10.1002/cber.190904204100.
- ↑ Harold Hibbert and Pauline Burt (1941). „Styrene Oxide”. Org. Synth.. ; Coll. Vol. 1: 494
- ↑ Paul D. Bartlett (1950). „Recent work on the mechanisms of peroxide reactions”. Record of Chemical Progress 11, 47–51. o.
- ↑ John O. Edwards. Peroxide Reaction Mechanisms. Interscience, New York, 67–106. o. (1962)
- ↑ D. J. Berrisford, C. Bolm,. K. B. Sharpless "Ligand-Accelerated Catalysis" Angew. Chem. Int. Ed. Engl. 2003, volume 95, pp. 1059–1070. doi:10.1002/anie.199510591
- ↑ Sheldon, R. A. Journal of Molecular Catalysis, 1980, 1, 107-206. (doi:10.1016/0304-5102(80)85010-3).
- ↑ Katsuki, T.; Sharpless, K. B. (1980). „The first practical method for asymmetric epoxidation”. J. Am. Chem. Soc. 102 (18), 5974. o. DOI:10.1021/ja00538a077.
- ↑ Hill, J. G.; Sharpless, K. B.; Exon, C. M.; Regenye, R. Org. Syn., Coll. Vol. 7, p. 461 (1990); Vol. 63, p. 66 (1985). (Article)
- ↑ Pham, Ha Q.. „Epoxy Resins”. Ullmann's Encyclopedia of Industrial Chemistry. DOI:10.1002/14356007.a09_547.pub2.
- ↑ Koppenhoefer, B.; Schurig, V. (1993). „(R)-Alkyloxiranes of High Enantiomeric Purity from (S)-2-Chloroalkanoic Acids via (S)-2-Chloro-1-Alkanols: (R)-Methyloxirane”. Org. Synth.. ; Coll. Vol. 8: 434
- ↑ C. J. Thibodeaux, W.-c. Chang, H.-w. Liu "Enzymatic Chemistry of Cyclopropane, Epoxide, and Aziridine Biosynthesis" Chem. Rev., 2012, vol. 112, pp 1681–1709. doi:10.1021/cr200073d
- ↑ Boron, Walter F.. Medical Physiology: A Cellular And Molecular Approach. Elsevier/Saunders (2003)
- ↑ Bruce Rickborn and Wallace E. Lamke (1967). „Reduction of epoxides. II. The lithium aluminum hydride and mixed hydride reduction of 3-methylcyclohexene oxide”. J. Org. Chem. 32, 537-539. o. DOI:10.1021/jo01278a005.
- ↑ B. Mudryk (1995). „1,3-Diols From Lithium Β-lithioalkoxides Generated By The Reductive Lithiation Of Epoxides: 2,5-dimethyl-2,4-hexanediol”. Org. Synth. 72, 173. o. DOI:10.15227/orgsyn.072.0173.
- ↑ K. Barry Sharpless, Martha A. Umbreit, Marjorie T. Nieh, Thomas C. Flood (1972). „Lower valent tungsten halides. New class of reagents for deoxygenation of organic molecules”. J. Am. Chem. Soc. 94 (18), 6538–6540. o. DOI:10.1021/ja00773a045.
Fordítás[szerkesztés]
- Ez a szócikk részben vagy egészben az Epoxide című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.