Podofillotoxin

| |||
| Podofillotoxin | |||
| IUPAC-név | |||
| (10R,11R,15R,16R)-16-hydroxy-10-(3,4,5-trimethoxyphenyl)-4,6,13-trioxatetracyclo[7.7.0.03,7.011,15]hexadeca-1,3(7),8-trien-12-one | |||
| Más nevek | (5R,5aR,8aR,9R)-9-hydroxy-5-(3,4,5-trimethoxyphenyl)-5,8,8a,9-tetrahydrofuro[3',4':6,7]naphtho[2,3-d][1,3]dioxol-6(5aH)-one | ||
| Kémiai azonosítók | |||
| CAS-szám | 518-28-5 | ||
| PubChem | 10607 | ||
| ChemSpider | 10162 | ||
| DrugBank | DB01179 | ||
| KEGG | D05529 | ||
| ChEBI | 50305 | ||
| ATC kód | D07BB04 | ||
| |||
| InChIKey | YJGVMLPVUAXIQN-XVVDYKMHSA-N | ||
| UNII | L36H50F353 | ||
| ChEMBL | 61 | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C22H22O8 | ||
| Moláris tömeg | 414,41 g/mol | ||
| Olvadáspont | 183,3–184 °C | ||
| Farmakokinetikai adatok | |||
| Biológiai felezési idő |
1.0 to 4.5 hours. | ||
| Terápiás előírások | |||
| Terhességi kategória | C (HU) | ||

| |||
| Podofillotoxin | |||
| IUPAC-név | |||
| (10R,11R,15R,16R)-16-hydroxy-10-(3,4,5-trimethoxyphenyl)-4,6,13-trioxatetracyclo[7.7.0.03,7.011,15]hexadeca-1,3(7),8-trien-12-one | |||
| Más nevek | (5R,5aR,8aR,9R)-9-hydroxy-5-(3,4,5-trimethoxyphenyl)-5,8,8a,9-tetrahydrofuro[3',4':6,7]naphtho[2,3-d][1,3]dioxol-6(5aH)-one | ||
| Kémiai azonosítók | |||
| CAS-szám | 518-28-5 | ||
| PubChem | 10607 | ||
| ChemSpider | 10162 | ||
| DrugBank | DB01179 | ||
| KEGG | D05529 | ||
| ChEBI | 50305 | ||
| ATC kód | D07BB04 | ||
| |||
| InChIKey | YJGVMLPVUAXIQN-XVVDYKMHSA-N | ||
| UNII | L36H50F353 | ||
| ChEMBL | 61 | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C22H22O8 | ||
| Moláris tömeg | 414,41 g/mol | ||
| Olvadáspont | 183,3–184 °C | ||
| Farmakokinetikai adatok | |||
| Biológiai felezési idő |
1.0 - 4.5 óra. | ||
| Terápiás előírások | |||
| Terhességi kategória | C (HU) | ||
A podofillotoxin egy lignán, amelyet a Podophyllum fajok gyökereiből és rizómáiból vonnak ki. A vegyületet először 1880-ban izolálták.[1] A kevésbé finomított formája podofillumgyanta néven ismert, de mivel súlyos mellékhatásokat okozhat, ma már nem alkalmazzák a gyógyászatban.[2][3][4]
Orvosi felhasználás[szerkesztés]
A podofillotoxint széles körben alkalmazták az orvoslásban, mivel mind a sejtes, mind a virális DNS-replikációt gátolja az ehhez szükséges enzimekhez való kötődésével, továbbá destabilizálja a mikrotubulusokat és gátolja a sejtosztódást, ezért antimitotikus hatóanyagnak tekintik. A podofillotoxint és származékait székletlazító, purgatív, vírusellenes szerként, hólyaghúzó, antihelmintikus és daganatellenes szerként alkalmazták, de hatásosak lehetnek plakkos psoriasis esetén is.[5] A podofillotoxin alkalmazása mára visszaszorult, elsősorban külsőleges felhasználása jelélemző. Származékai, az etopozid, etopofosz és a tenipozid a daganatellenes szerek közé tartoznak,[6][7][8] amelyeket sikeresen alkalmaznak számos rákos megbetegedésben, ideértve a here-, emlő-, hasnyálmirigy-, tüdő-, gyomor- és petefészekrákot, illetve bizonyos limfómákat.[9][10]
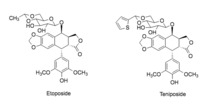
A podofillotoxin tartalmú krémet általában erős helyi vírusellenes hatása miatt rendelik.[12] Külső szemölcsökkel járó HPV-fertőzések, valamint molluscum contagiosum (uszodaszemölcs) fertőzések kezelésére használják.[12]
Mellékhatások[szerkesztés]
A podofillotoxint szisztémásan magas toxicitása és súlyos mellékhatásai miatt nem, csak topikálisan alkalmazzák.[13] Leggyakoribb mellékhatásaként általában az alkalmazás helyét körülvevő szövet irritációja, pl. égő érzés, bőrpír, fájdalom, viszketés, duzzanat jelentkezik.[14] Később kisméretű sebek és hámlás jelentkezhet, ezért célszerű úgy alkalmazni a készítményt, hogy a környező, nem fertőzött szövetekkel ne érintkezzen.[15] Helyileg biztonságosan alkalmazható, azonban lenyelés esetén központi idegrendszeri depressziót, valamint enteritist okozhat. A podofillumgyanta szintén ilyen hatásokat fejt ki.[16]
A podofillotoxin mind egerek, mind patkányok esetén embriotoxikusnak bizonyult, ezér sem a podofillumgyantát, sem a podofillotoxin tartalmú készítményeket nem használják terhesség alatt.[17] Mivel nincsen arról információ, hogy helyileg alkalmazva a készítményeket, kiválasztódik-e a podofillotoxin az anyatejbe, szoptató nők számára sem ajánlottak.[18]
Hatásmechanizmus[szerkesztés]
Míg a podofillotoxin destabilizálja a mikrotubulusokat a tubulinhoz kötődve, így akadályozza a sejtosztódást,[19][20] addig egyes származékai a topoizomeráz II enzimhez (Topo II) mutatnak affinitást a sejtosztódás késői S és korai G2 szakaszában. Az etopozid stabilizálja a topoizomeráz II enzim által okozott ideiglenes DNS-törést, megzavarja annak javítását, ennek következtében gátolja a DNS letekerését és replikációját.[21]
Kémiai tulajdonságai[szerkesztés]
Szerkezeti jellemzők[szerkesztés]
A podofillotoxin szerkezetét az 1930-as években derítették fel.[22] A vegyület négy királis centrumot tartalmaz.
A különböző podofillotoxinszármazékok hatása eltérő lehet. Az A gyűrű nem szükséges az antimitotikus hatáshoz, viszont a C gyűrű aromatizálása hatásvesztéshez vezet, valószínűleg attól, hogy az E gyűrű így nem axiális helyzetben áll. Ezenkívül a C-2 és C-3 sztereokémiája konfigurál egy transz-laktont, amelynek nagyobb aktivitása van, mint a cisz megfelelőjének. A kiralitás a C-1-nél pedig szintén fontos, mivel az E gyűrű axiális állását vonja maga után.[23]
Bioszintézis[szerkesztés]
A podofillotoxin bioszintézisét sok éven keresztül nem sikerült teljesen tisztázni; 2015 szeptemberében azonban sikerült a bioszintézisben szerepet játszó hat, addig hiányzó enzimet azonosítani.[24] Számos korábbi tanulmány szerint a koniferil-alkohol egy elektron-oxidáns jelenlétében sztereospecifikus gyökös köztitermék dimerizálásával (+) - pinorezinollá alakul.[6] Ezt követően a pinorezinol a ko-faktor NADPH jelenlétében redukálódik először laricirezinollá, majd szekoizolaricirezinollá. A szekoizolariziresinol laktonizálása matairezinolt eredményez. A szekoizolaricirezinol feltételezhetően átalakítható yateinné megfelelő quinometán intermedierek révén, mely végül podofillotoxint fog eredményezni.
Kémiai szintézis[szerkesztés]
A podofillotoxint laboratóriumi körülmények között is sikeresen előállították; a szintézis azonban sok lépésből áll, ami alacsony összhozamot eredményez. Ezért továbbra is hatékonyabb a podofillotoxin természetes forrásból történő kinyerése.[9]
Négy szintézis útvonalat alkalmaztak a podofillotoxin előállítására változó sikerrel: oxo- észter útvonalat,[25] egy dihidroxi-sav laktonizációját,[26] konjugált addíciós termék ciklizációját,[27] és a Diels-Alder reakciót.[28]
Természetes előfordulás[szerkesztés]
A podofillotoxin 0,3- 1,0 m/m%-ban van jelen a Podophyllum peltatum rizómájában. [21][29] Egy másik gyakori forrása a Sinopodophyllum hexandrum Royle ( Berberidaceae ) rizómája.
Jegyzetek[szerkesztés]
- ↑ (2009) „A review on hemisynthesis, biosynthesis, biological activities, mode of action, and structure-activity relationship of podophyllotoxins: 2003-2007”. Current Medicinal Chemistry 16 (3), 327–49. o. DOI:10.2174/092986709787002682. PMID 19149581.
- ↑ Podophyllum Resin. The American Society of Health-System Pharmacists. (Hozzáférés: 2016. december 8.)
- ↑ WHO Model Formulary 2008. World Health Organization, 307. o. (2009). ISBN 9789241547659
- ↑ Cragg, Gordon M.. Anticancer Agents from Natural Products, Second Edition, 2, CRC Press, 97. o. (2011. április 26.). ISBN 9781439813836
- ↑ (2004. szeptember 15.) „Podophyllotoxin: distribution, sources, applications and new cytotoxic derivatives” (angol nyelven). Toxicon 44 (4), 441–459. o. DOI:10.1016/j.toxicon.2004.05.008. ISSN 0041-0101.
- ↑ a b (2004. szeptember 1.) „Podophyllotoxin: distribution, sources, applications and new cytotoxic derivatives”. Toxicon 44 (4), 441–59. o. DOI:10.1016/j.toxicon.2004.05.008. PMID 15302526.
- ↑ (1998. június 1.) „Podophyllotoxins: current status and recent developments”. Current Medicinal Chemistry 5 (3), 205–52. o. PMID 9562603.
- ↑ (2000. május 1.) „Podophyllotoxin” (angol nyelven). Phytochemistry 54 (2), 115–120. o. DOI:10.1016/S0031-9422(00)00094-7. ISSN 0031-9422.
- ↑ a b (2000. május 1.) „Podophyllotoxin”. Phytochemistry 54 (2), 115–20. o. DOI:10.1016/s0031-9422(00)00094-7. PMID 10872202.
- ↑ Hartmann, J??rg T (2006. április 26.). „Camptothecin and Podophyllotoxin Derivatives: Inhibitors of Topoisomerase I and II ??? Mechanisms of Action, Pharmacokinetics and Toxicity Profile” (angol nyelven). Drug Safety 29 (3), 209–230. o. DOI:10.2165/00002018-200629030-00005. ISSN 0114-5916.
- ↑ (2015. január 1.) „Recent progress on C-4-modified podophyllotoxin analogs as potent antitumor agents”. Medicinal Research Reviews 35 (1), 1–62. o. DOI:10.1002/med.21319. PMID 24827545.
- ↑ a b Ardalani (2016. április 26.). „Podophyllotoxin: a novel potential natural anticancer agent.”. Avicenna Journal of Phytomedicine 7 (4), 285–294. o. PMID 28884079.
- ↑ (2021. június 1.) „Novel podophyllotoxin and benzothiazole derivative induces transitional morphological and functional changes in HaCaT cells” (angol nyelven). Toxicology in Vitro 73, 105144. o. DOI:10.1016/j.tiv.2021.105144. ISSN 0887-2333.
- ↑ (2001. április 1.) „Condyloma eradication: self-therapy with 0.15-0.5% podophyllotoxin versus 20-25% podophyllin preparations--an integrated safety assessment”. Regulatory Toxicology and Pharmacology 33 (2), 117–37. o. DOI:10.1006/rtph.2000.1446. PMID 11350195.
- ↑ PRODUCT INFORMATION WARTEC® SOLUTION. GlaxoSmithKline Australia Pty Ltd. (Hozzáférés: 2013. január 6.)
- ↑ (1979. augusztus 1.) „Podophyllum toxicity: case report and literature review”. The Journal of Family Practice 9 (2), 237–40. o. PMID 458391.
- ↑ (1989. július 1.) „Is Podophyllin Safe for Use in Pregnancy?”. Archives of Dermatology 125 (7), 1000–1. o. DOI:10.1001/archderm.1989.01670190134022. PMID 2742385.
- ↑ Podophyllotoxin | DermNet New Zealand. www.dermnetnz.org. (Hozzáférés: 2018. május 6.)
- ↑ Hamidreza (2017. június 1.). „Podophyllotoxin: a novel potential natural anticancer agent”. Avicenna Journal of Phytomedicine 7 (4). DOI:10.22038/ajp.2017.8779.
- ↑ (2000. december 1.) „Antitumor properties of podophyllotoxin and related compounds”. Current Pharmaceutical Design 6 (18), 1811–39. o. DOI:10.2174/1381612003398582. PMID 11102564.
- ↑ a b (2000) „Molecules of Interest: Podophyllotoxin”. Phytochemistry 54 (2), 115–120. o. DOI:10.1016/s0031-9422(00)00094-7. PMID 10872202.
- ↑ (1932) „Über Podophyllin”. Justus Liebigs Ann. Chem. 494, 126–142. o. DOI:10.1002/jlac.19324940113.
- ↑ (2005) „Podophyllotoxin derivatives: current synthetic approaches for new anticancer agents”. Current Pharmaceutical Design 11 (13), 1695–717. o. DOI:10.2174/1381612053764724. PMID 15892669.
- ↑ (2015. szeptember 1.) „Six enzymes from mayapple that complete the biosynthetic pathway to the etoposide aglycone”. Science 349 (6253), 1224–8. o. DOI:10.1126/science.aac7202. PMID 26359402.
- ↑ Kende (1981. június 1.). „Total synthesis of (.+-.)-4'-demethyl-4-epipodophyllotoxin by insertion-cyclization”. The Journal of Organic Chemistry 46 (13), 2826–2828. o. DOI:10.1021/jo00326a056.
- ↑ Macdonald (1988. augusztus 1.). „A highly stereoselective synthesis of podophyllotoxin and analogues based on an intramolecular Diels-Alder reaction”. The Journal of Organic Chemistry 53 (16), 3663–3669. o. DOI:10.1021/jo00251a003.
- ↑ Ziegler (1978. március 1.). „Synthetic studies on lignan lactones: aryl dithiane route to (.+-.)-podorhizol and (.+-.)-isopodophyllotoxone and approaches to the stegane skeleton”. The Journal of Organic Chemistry 43 (5), 985–991. o. DOI:10.1021/jo00399a040.
- ↑ (1971. december 1.) „Intramolecular Diels-Alder reactions. VII. Electroreduction of .alpha.,.beta.-unsaturated esters. I. Synthesis of rac-deoxypicropodophyllin by intramolecular Diels-Alder reaction plus trans addition of hydrogen”. The Journal of Organic Chemistry 36 (24), 3740–3743. o. DOI:10.1021/jo00823a017.
- ↑ (1951) „Components of Podophyllin. V. The Constitution of Podophyllotoxin”. Journal of the American Chemical Society 73 (6), 2909–2916. o. DOI:10.1021/ja01150a143.
