Peptidoglikán
A peptidoglikán, más néven murein cukrokból és aminosavakból álló polimer, ami a baktériumok sejtmembránján kívül hálószerű peptidoglikánréteget alkot, amely a legtöbb baktériumra (Bacteria domén)[1] [2]:66–67 jellemző. A cukorkomponens felváltva áll β-(1,4)-kötött N-acetilglükózaminból (NAG) és N-acetilmuraminsavból (NAM). Az N-acetilmuraminsavhoz három-öt aminosavból álló peptidlánc kapcsolódik. A peptidlánc egy másik szál peptidláncával keresztkötéseket alkothat, így létrehozva a térhálós szerkezetet.[2][3] A peptidoglikán a baktérium sejtfalának szerkezetében fontos szerepet játszik: megerősíti azt, és a sejtplazma ozmózisnyomását ellensúlyozza. A peptidoglikán a baktériumsejtek osztódásában is szerepet játszik. Ez az ismétlődő kapcsolódás sűrű peptidoglikán-réteget eredményez, ami fontos a sejt alakjának megőrzéséhez és a magas ozmózisnyomásnak való ellenálláshoz, és folyamatosan cserélődik a peptidoglikán-termelődés révén. A peptidoglikán-hidrolízis és -szintézis két folyamat, amelyek a sejtnövekedéshez és -osztódáshoz szükségesek, amely a meglévő anyag felosztásából, az új anyag beillesztéséből és a meglévő anyag új anyaghoz való kötéséből álló folyamat.[4]
A peptidoglikán-réteg sokkal vastagabb Gram-pozitív baktériumokban (20-80 nm), mint a Gram-negatívakban (7-8 nm).[5] A pH-értéktől függően a peptidoglikán a sejtfal száraz tömegének 40-90%-át alkotja Gram-pozitív baktériumokban, de csak mintegy 10%-át Gram-negatívakban. Így a peptidoglikán magas szintje alapján megállapítható, hogy a baktérium Gram-pozitív.[6] A Gram-pozitív törzsekben fontos szerepet játszik a csatolásban és a szerotípusok elkülönítéséhez.[7] Mind Gram-pozitív, mind Gram-negatív baktériumok esetén áthaladhatnak a peptidoglikánon kb. 2 nm-es részecskék.[8]
Szerkezet[szerkesztés]
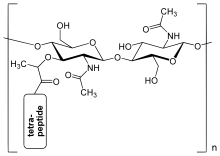
A baktérium sejtfalának peptidoglikán-rétege egy két aminocukorból (N-acetilglükózaminból (GlcNAc vagy NAGA) és N-acetilmuraminsavból (MurNAc vagy NAGA)) álló réteg. A cukrokat β-(1,4)-glikozidos kötés köti össze. A MurNAc rövid (4–5 tagú) aminosavlánchoz csatlakozik, mely l-alanint, d-glutaminsavat, mezo-diaminopimelinsavat és d-alanint tartalmaz a Gram-negatív Escherichia coli esetén, illetve l-alanint, d-glutamint, l-lizint és d-alanint tartalmaz a tetrapeptidek közti 5 glicines híddal a Gram-pozitív Staphylococcus aureus esetén.
Az aminosavak közti keresztkötéseket a különböző lineáris aminocukorláncokban a DD-transzpeptidáz hozza létre, erős, rideg térszerkezetet eredményezve. Az aminosav-sorozat és molekuláris szerkezet fajról fajra változik.[9]
-
A peptidoglikán szerkezete. NAG = N-acetilglükózamin (más néven GlcNAc vagy NAGA), NAM = N-acetilmuraminsav (más néven MurNAC vagy NAMA).
-
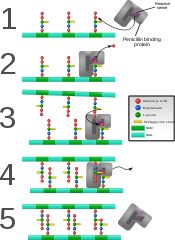
A penicillinkötő protein keresztkötéseket alkot az újonnan létrejött baktériumsejtfallal.
A membrán elzárásával a peptidoglikán megvédi a sejtet turgornyomása okozta lízisétől. A sejtfal alakját megőrzi növekedésekor, mivel a frissen hozzáadott anyag félgömb alakú fallá válik az utódsejtekben.[10]
A peptidoglikán típusairól és taxonómiai következményeikről beszámoltak K. H. Schleiferék.[11]
Bioszintézis[szerkesztés]
A peptidoglikán monomerei a citoszolban szintetizálódnak, majd egy szállítómembránhoz, a baktoprenolhoz kapcsolódnak. A baktoprenol a sejtmembránon keresztül szállítja a monomereket, ahol a meglévő peptidoglikánhoz kapcsolódnak.[12]
- A peptidoglikán szintézisének első lépésében a glutamin aminocsoportot ad át a fruktóz-6-foszfátnak.[13] Ez a reakció, melyet az EC 2.6.1.16 (GlmS) katalizál, a fruktóz-6-foszfátot glükózamin-6-foszfáttá alakítja.
- A második lépésben egy acetilcsoport kerül át az acetil-CoA-ról a glükózamin-6-foszfát aminocsoportjára, így N-acetil-glükózamin-6-foszfát keletkezik.[14]
- A harmadik lépésben az N-acetil-glükózamin-6-foszfát izomerizálódik, így az átalakul N-acetil-glükózamin-1-foszfáttá.[14]
- A negyedik lépésben az N-acetil-glükózamin-1-foszfát az UTP-hez kötődik. Az uridin-trifoszfát energiaforrásként is tud működni. Ebben a reakcióban egy szervetlen pirofoszfát eltávozik, helyére a monofoszfát kerül, így keletkezik az UDP-N-acetil-glükózamin (2,4) (ha UDP az energiaforrás, szervetlen foszfát távozik). E kezdeti szakasz során keletkezik az NAG prekurzora a peptidoglikánban.
- Az ötödik lépésben néhány UDP-N-acetil-glükózamin (UDP-GlcNAc) átalakul UDP-MurNAc-vá (UDP-N-acetilmuraminsav) egy laktilcsoport hozzáadásával a glükózaminhoz. Szintén e reakcióban a C3-hidroxilcsoport eltávolít egy foszfátot a foszfoenolpiruvát α-szénatomjáról. Ez egy enolszármazékot hoz létre.
- Az enol laktil-molekularészletté alakul a hatodik lépésben.[14]
- A hetedik lépésben az UDP–MurNAc UDP-MurNAc-pentapeptiddé alakul 5 aminosav hozzáadásával, jellemzően a d-alanil-d-alanin dipeptid felhasználásával.[14] Minden ilyen reakció ATP-t igényel.[14] Ezt nevezik az első szakasznak.
A második szakasz a citoplazmatikus membránban történik. Ez a membránon belül van, ahol a baktoprenol peptidoglikán-prekurzorokat szállít a sejtmembránon keresztül
- Az undekaprenil-foszfát megtámadja az UDP-MurNAc pentát, a PP-MurNac pentát, egy lipidet (lipid I) létrehozva.
- Az UDP-GlcNAc ezután a MurNAC-hoz kerül, így egy diszacharid keletkezik, a Lipid-PP-MurNAc penta-GlcNAc (lipid II), ami szintén a peptidoglikán prekurzora.[14]
- A lipid II-t a flippáz (MurJ) szállítja, melyet 2014-ben fedeztek fel.[15] Ekkor a glikánlánchoz adja hozzá a peptidoglikán-glikoziltranszferáz (GTáz, EC 2.4.1.129). Ez a folyamat a transzglikoziláció. Ekkor A GlcNAc hidroxilcsoportja a glikán MurNAc-jához kötődik, amely a lipid-PP-t eltávolítja a glikánláncról.[14]
- Végül a DD-transzpeptidáz (TPáz, EC 3.4.16.4) keresztkötéseket hoz létre a glikánláncok közt. E fehérje ismert még penicillinkötő fehérjeként is. Néhány változata glikoziltranszferázként is működik, míg mások külön enzimnek hagyják ezt.[13]
Immunrendszer általi felismerése[szerkesztés]
A peptidoglikán-felismerés az evolúció során állandó folyamat.[16] Az egyes baktériumfajok esetén a szerkezet hasonló, de bizonyos eltérések növelhetik a diverzitást. Ezek közé tartozik a cukorpolimerek hosszának, szerkezetének eltérése, a keresztkötések eltérése vagy az aminosavak változása (főképp a 3. helyen).[16][17] Ezek célja a sejtfal tulajdonságainak megváltozása, mely fontos szerepet játszik a patogenezisben.[16]
A peptidoglikánokat számos enzim (például lizozim, glükózaminidáz, endopeptidáz) képes lebontani,[16] immunstimuláló töredékeket (más néven muropeptideket) létrehozva,[18]amik fontosak a gazda–patogén interakció létrehozásában,[17] ilyen például az MDP (muramil-dipeptid, NAG (N-acetilglükózamin vagy az iE-DAP (γ-d-glutamil-mezo-diaminopimelinsav).[16][18]
A bélbaktériumok peptidoglikánja fiziológiás körülmények közt is áthalad a bélfalon.[18] A peptidoglikánok és töredékeik áthaladása lehet közvetlen (hordozófüggetlen) és közvetett (hordozófüggő), illetve baktériummediált (szekréciós rendszerek, membránvezikulum-forgalom) vagy gazdasejtmediált (receptormediált, peptidtranszporterek).[18] A bakteriális szekréciós rendszerek a virulenciafaktorok a baktérium sejthártyáján keresztül a külső környezetbe történő szállítására fehérjekomplexek.[19] Az intracelluláris bakteriális patogének az eukarióta sejteket támadják (ami fagolizoszóma-keletkezéshez vagy autofágiához vezethet, vagy a baktériumokat bekebelezik a fagociták (makrofágok, monociták, neutrofilek. A baktériumtartalmú fagoszóma egyesülhet endoszómákkal vagy lizoszómákkal, így a baktérium lebomlik, és peptidoglikán-töredékek és muropeptidek keletkeznek.[18]
Receptorok[szerkesztés]
Az immunrendszer érzékeli a megmaradt peptidoglikánt és peptidoglikán-töredékeket PRR-ekkel (mintafelismerő receptorok), amik kiválasztódnak, sejten belül vagy a sejtfelszínen fejeződnek ki.[16]
Peptidoglikán-felismerő fehérjék[szerkesztés]
A PGLYRP-k állandóak a rovaroktól az emlősökig.[18] Az emlősök 4 oldékony peptidoglikán-felismerő fehérjét (PGLYRP-1, PGLYRP-2, PGLYRP-3, PGLYRP-4) választanak ki, amik felismerik a muramil-penta- vagy tetrapeptidet.[16] Ezek lipopoliszacharidokhoz és más molekulákhoz is kötődhetnek a peptidoglikán-kötő helyen kívüli kötőhelyeken.[19] A peptidoglikán felismerése után a PGLYRP-k aktiválják a polifenol-oxidázokat (PPO), a Toll- vagy az immunhiány- (IMD) jelző útvonalakat. Ez antimikrobiális peptidek (AMP) termeléséhez vezet.[19]
Minden emlős PGLYRP-je egyedi kifejeződési mintázattal rendelkezik. A PGLYRP-1 jellemzően a neutrofilek és eozinofilek granuláiban fejeződik ki.[16] A PGLYRP-3 és 4 fehérjéket többek közt a bőr, a verejtékmirigyek, a szemek és a bélrendszer fejezik ki.[18] A PGLYRP-1, 3 és 4 diszulfidkötött homo- és heterodimereket alkotva fejtik ki baktericid hatásukat.[18] A baktériumsejtfal peptidoglikánjaival való kötés a baktérium sejthalálát okozhatja a különböző bakteriális transzkripciós szabályzófehérjékre való hatása miatt.[16] A PGLYRP-k segíthetik a baktérium elölését más PRR-ekkel való együttműködéssel, így javítva a baktériumok fagociták általi felismerését.[16]
A PGLYRP-2-t elsősorban a máj fejezi ki és választja ki a vérkeringésbe.[16] Ezenkívül kifejeződhet a bőr keratinocitáiban, valamint a száj és a belek epitélsejtjeiben.[18] Szemben a többi PGLYRP-vel, a PGLYRP-2 nem rendelkezik közvetlen baktericid aktivitással. Peptidoglikán-amidázként működik, hidrolizálja a laktil-amid kötést a MurNAc és a peptidoglikán alappeptidjének 1. aminosava közt.[16][18] Feltételezések szerint a PGLYRP-2 célja a túlzott immunválasz, a gyulladás okozta szövetkárosodás megakadályozása a NOD2 ligandumokra, mivel e muropeptideket már nem ismeri fel a NOD2 a peptid és a MurNAc szétválasztása után.[18] Sok tanulmány szerint a peptidoglikán-felismerő fehérjecsalád tagjai fontosak a bél epitélsejtjeinek toleranciájában a kommenzalista baktériumok felé.[19][20] Kimutatták, hogy a PGLYRP-2 és -4 kifejeződése befolyásolhatja a bélbaktériumok összetételét.[19]
2020-ban felfedezték, hogy a PGLYRP-ket és a NOD-típusú receptorokat és peptidoglikán-transzportereket a fejlődő egéragy nagymértékben kifejezi.[21] A PGLYRP-2-t számos agyi rész neuronjai kifejezik, például a prefrontális kéreg, a hippokampusz és a kisagy, így lehetnek közvetlen hatásai a peptidoglikánnak a neuronokra. A PGLYRP-2-t ezenkívül a kisgyermekek nagyagya is kifejezi, de a legtöbb érett kérgi szövet nem. A PGLYRP-1-et is kifejezi az agy, ez azonban felnőttkorban is kifejeződik.[21]
NOD-típusú receptorok[szerkesztés]
A peptidoglikán egyik legismertebb receptorai a NOD-típusú receptorok (NLR-ek), ezen belül főképp a NOD1 és a NOD2. A NOD1 receptor iE-DAP (γ-d-glutamil-mezo-diaminopimelinsav) kötésekor aktiválódik, míg a NOD2 az MDP-t ismeri fel az LRR doménekkel.[19] Az aktiváció önoligomerizációhoz vezet, ami két jelzősorozat aktivációjához vezet. Az egyik az NF-κB-t aktiválja a RIP2-n, TAK1-en és IKK-n keresztül,[22] a másik a MAPK-sorozatot indítja el. Ezen útvonalak aktivációja citokin- és kemokintermelést okoz.[16]
A NOD1-et számos sejttípus kifejezi, például a mieloid fagociták, az epitél-[16] és az idegsejtek.[21] A NOD2-t a monociták, makrofágok, bélepitél-, Paneth-, dendrites, csontsejtek, oszteoblasztok, keratinociták és más epitélsejttípusok fejezik ki.[17] Citoszolszenzorokként a NOD1-nek és NOD2-nek vagy citoszolba lépő baktériumokat kell észlelnie, vagy a peptidoglikánnak kell a citoszolba lépő töredékekre bomlania, amik a szenzorok működésbe lépését előidézik.[16]
2020-ban kimutatták, hogy az NLRP3-at a NOD1-től és NOD2-től független mechanizmussal aktiválja a peptidoglikán.[18] A makrofágokban a peptidoglikán bomlásából képződő N-acetilglükózaminról kimutatták, hogy gátolja a hexokinázaktivitást, és annak felszabadítását okozza a mitokondrium membránján át, és hogy segíti az NLRP3 inflammaszóma aktiválását egy megnövekedett mitokondriális membránpermeabilitás okozta mechanizmus révén.[18]
Az NLRP1-et is citoplazmatikus peptidoglikánszenzornak tekintik. Érzékeli az MDP-t és IL-1-szekréciót erősít a NOD2-höz kötődve.[19][17]
C-típusúlektin-receptorok (CLR-ek)[szerkesztés]
A C-típusú lektinek nagyrészt Ca2+-függő fehérjék, melyek számos szénhidráthoz kötődnek, beleértve a peptidoglikán glikánvázát), és nem specifikus immunreceptorokként funkcionálnak.[18] A peptidoglikánhoz kötődő CLR-ek közé tartoznak az MBL (mannózkötő lektin), a fikolinok, a Reg3A (regenerációsgén-családbeli fehérje 3A) és a PTCLec1.[19] Az emlősökben ők indítják be a komplementsorozat lektinútvonalát.[18]
Toll-típusú receptorok[szerkesztés]
A TLR-ek funkciója a közvetlen peptidoglikán-felismerésben vitatott.[16] Egyes tanulmányok szerint a peptidoglikánt a TLR2 érzékeli.[23] De ezt okozhatják a sejtfali lipoproteinek és lipoteichoinsavak, amik gyakran együtt választódnak ki a peptidoglikánnal. Ezenkívül a peptidoglikán szerkezetének eltérései is okozhatják az eltérő eredményeket.[16][18]
Vakcinaként vagy adjuvánsként[szerkesztés]
A peptidoglikán immunológiailag aktív, ami az immunsejteket megnövekedett citokinexpresszióra és az antitestfüggő specifikus immunválasz segítésére sarkallhatja vakcinával együtt vagy adjuvánsként.[19] A peptidoglikán alapegységét, az MDP-t használták eredetileg a Freund-adjuváns aktív komponenseként.[19] A Staphylococcus aureus peptidoglikánját egereket védő vakcinaként használva kimutatták, hogy a vakcinainjekció után 40 hétig megnövekedett a S. aureus halálos dózisa.[24]
Inhibíció és bontás[szerkesztés]
Néhány antibiotikum, például a penicillin hat a peptidoglikán-termelésre a penicillinkötő fehérjékhez vagy DD-transzpeptidázokhoz kötődve,[7] amelyek a peptidoglikánban az oligopeptidek közti kötéseket létrehozzák. Egy baktérium kettéhasadással való szaporodásához több mint egymillió peptidoglikán-alegységnek (NAM-NAG+oligopeptid) kell kapcsolódnia a meglévő egységekhez.[25] A transzpeptidázkódoló gének antibiotikummal való csökkent kölcsönhatást okozó mutációi fontos okai az antibiotikum-rezisztencia megjelenésének.[26]
A muraimicinek a foszfo-N-acetilmuramoil-pentapeptid-transzlokázt (MraY) UDP-MurNAc-pentapeptiddel (UM5A) kompetitíven gátolják.[27]
A peptidoglikán-szintézis más lépései is megcélozhatók. A bacitracin például a C55-izoprenil-pirofoszfát-felhasználást célozza. A lantibiotikumok, amik közé a nizin is tartozik, a lipid II-t támadják.[28]
A könnyekben található lizozim, a nem specifikus immunrendszer része antibakteriális hatását a β-(1,4)-glikozidos kötések felszakításával éri el (lásd fentebb). A lizozim sokkal hatékonyabb a Gram-pozitív baktériumokban, ahol a peptidoglikán sejtfal szabad, mint a negatívakban, ahol azt lipopoliszacharid veszi körül.[22] Néhány peptidoglikán-módosulat lizozim-rezisztenciát okozhat. A baktériumok bomlékonyságát befolyásolhatja az antibiotikumoknak való kitettség is. A kitett baktériumok rövidebb cukrokat tartalmazó peptidoglikánt állítanak elő, kevés keresztkötéssel, amit könnyebben bont a lizozim.[19]
Pszeudopeptidoglikán[szerkesztés]
Az archeák nem rendelkeznek peptidoglikánnal,[29] helyettük egyes fajaik sejtjei körül pszeudopeptidoglikán (más néven pszeudomurein) található, ahol a szénhidrátok β-(1,3)-kötött N-acetilglükózamin és N-acetiltaloszaminuronsav. Ez a sejtfalaikat ellenállóvá teszi a lizozimmel szemben.[30]
Jegyzetek[szerkesztés]
- ↑ (1990. június 1.) „Towards a natural system of organisms: proposal for the domains Archaea, Bacteria, and Eucarya”. Proceedings of the National Academy of Sciences of the United States of America 87 (12), 4576–4579. o. DOI:10.1073/pnas.87.12.4576. PMID 2112744.
- ↑ a b Brock Biology of Microorganisms, 14, Boston: Pearson Education Limited, 66–67. o. (2015). ISBN 978-1-292-01831-7
- ↑ Animation of Synthesis of Peptidoglycan Layer. PharmaXChange.info, 2011. március 20.
- ↑ (2013. június 1.) „Elasticity and biochemistry of growth relate replication rate to cell length and cross-link density in rod-shaped bacteria”. Biophysical Journal 104 (12), 2607–2611. o. DOI:10.1016/j.bpj.2013.04.028. PMID 23790368.
- ↑ Purcell A: Bacteria. Basic Biology, 2016. március 18.
- ↑ Bacteria, Encyclopedia of Earth. Washington DC: National Council for Science and the Environment (2014. október 12.)
- ↑ a b szerk.: Baron S: Structure, Structure. In: Baron's Medical Microbiology, 4th, Univ of Texas Medical Branch (1996). ISBN 978-0-9631172-1-2
- ↑ Demchick PH, Koch AL (1996. február 1.). „The permeability of the wall fabric of Escherichia coli and Bacillus subtilis”. Journal of Bacteriology 178 (3), 768–73. o. DOI:10.1128/jb.178.3.768-773.1996. PMID 8550511.
- ↑ Sherris Medical Microbiology, 4, McGraw Hill (2004). ISBN 978-0-8385-8529-0
- ↑ (2008. december 1.) „Cell shape and cell-wall organization in Gram-negative bacteria”. Proceedings of the National Academy of Sciences of the United States of America 105 (49), 19282–19287. o. DOI:10.1073/pnas.0805309105. PMID 19050072.
- ↑ (1972. december 1.) „Peptidoglycan types of bacterial cell walls and their taxonomic implications”. Bacteriological Reviews 36 (4), 407–477. o. DOI:10.1128/MMBR.36.4.407-477.1972. PMID 4568761.
- ↑ II. THE PROKARYOTIC CELL: BACTERIA. [2010. július 26-i dátummal az eredetiből archiválva]. (Hozzáférés: 2011. május 1.)
- ↑ a b (2018. január 1.) „Peptidoglycan in obligate intracellular bacteria”. Molecular Microbiology 107 (2), 142–163. o. DOI:10.1111/mmi.13880. PMID 29178391.
- ↑ a b c d e f g White, D.. The physiology and biochemistry of prokaryotes, 3rd, NY: Oxford University Press Inc. (2007)
- ↑ L. T. Sham, E. K. Butler, M. D. Lebar, D. Kahne, T. G. Bernhardt, N. Ruiz (2014. július). „Bacterial cell wall. MurJ is the flippase of lipid-linked precursors for peptidoglycan biogenesis”. Science 345 (6193), 220–222. o. DOI:10.1126/science.1254522. PMID 25013077.
- ↑ a b c d e f g h i j k l m n o p q A. J. Wolf, D. M. Underhill (2018. április). „Peptidoglycan recognition by the innate immune system”. Nature Reviews. Immunology 18 (4), 243–254. o. DOI:10.1038/nri.2017.136. PMID 29292393.
- ↑ a b c d K. L. Bersch, K. E. DeMeester, R. Zagani, S. Chen, K. A. Wodzanowski, S. Liu, S. Mashayekh, H. C. Reinecker, C. L. Grimes (2021. április). „Bacterial Peptidoglycan Fragments Differentially Regulate Innate Immune Signaling”. ACS Central Science 7 (4), 688–696. o. DOI:10.1021/acscentsci.1c00200. PMID 34056099.
- ↑ a b c d e f g h i j k l m n o p P. A. Bastor, R. Wheeler, I. G. Boneca (2021. január). „Uptake, recognition and responses to peptidoglycan in the mammalian host”. FEMS Microbiology Reviews 45 (1), fuaa044. o. DOI:10.1093/femsre/fuaa044. PMID 32897324.
- ↑ a b c d e f g h i j k Q. Sun, X. Liu, X. Li (2022. február). „Peptidoglycan-based immunomodulation”. Applied Microbiology and Biotechnology 106 (3), 981–993. o. DOI:10.1007/s00253-022-11795-4. PMID 35076738.
- ↑ (2022. december 1.) „Peptidoglycan recognition protein SC (PGRP-SC) shapes gut microbiota richness, diversity and composition by modulating immunity in the house fly Musca domestica”. Insect Molecular Biology 32 (2), 200–212. o. DOI:10.1111/imb.12824. PMID 36522831.
- ↑ a b c (2020. augusztus 1.) „Bacterial Peptidoglycans from Microbiota in Neurodevelopment and Behavior”. Trends in Molecular Medicine 26 (8), 729–743. o. DOI:10.1016/j.molmed.2020.05.003. PMID 32507655.
- ↑ a b Janeway's immunobiology, Casey Weaver, Charles Janeway, 9th, 45, 96–98. o. (2017). ISBN 978-0-8153-4505-3. OCLC 933586700
- ↑ A. Yoshimura, E. Lien, R. R. Ingalis, E. Tuomanen, R. Dziarski, D. Golenbock (1999. július 1.). „Cutting edge: recognition of Gram-positive bacterial cell wall components by the innate immune system occurs via Toll-like receptor 2”. Journal of Immunology 163 (1), 1–5. o. DOI:10.4049/jimmunol.163.1.1. PMID 10384090.
- ↑ (2011. december 1.) „The Staphylococcus aureus peptidoglycan protects mice against the pathogen and eradicates experimentally induced infection”. PLOS ONE 6 (12), e28377. o. DOI:10.1371/journal.pone.0028377. PMID 22145040.
- ↑ Bauman R. Microbiology with Diseases by Taxonomy, 2nd, Benjamin Cummings (2007). ISBN 978-0-8053-7679-1
- ↑ Spratt BG (1994. április 1.). „Resistance to antibiotics mediated by target alterations”. Science 264 (5157), 388–93. o. DOI:10.1126/science.8153626. PMID 8153626.
- ↑ Saeid Malek Zadeh (2020. szeptember 2.). „Theoretical Study of Intermolecular Interactions between Critical Residues of Membrane Protein MraYAA and Promising Antibiotic Muraymycin D2”. ACS Omega 5 (36), 22739–22749. o. DOI:10.1021/acsomega.0c01551. PMID 32954121.
- ↑ (2017. március 1.) „A review on cell wall synthesis inhibitors with an emphasis on glycopeptide antibiotics”. MedChemComm 8 (3), 516–533. o. DOI:10.1039/c6md00585c. PMID 30108769.
- ↑ (1977. május 1.) „Lack of peptidoglycan in the cell walls of Methanosarcina barkeri”. Archives of Microbiology 113 (1–2), 57–60. o. DOI:10.1007/BF00428580. PMID 889387.
- ↑ (1998. április 1.) „Cell wall polymers in Archaea (Archaebacteria)”. Cellular and Molecular Life Sciences 54 (4), 305–308. o. DOI:10.1007/s000180050156. PMID 9614965.
Fordítás[szerkesztés]
Ez a szócikk részben vagy egészben a Peptidoglycan című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.