Nitrit


A nitrition szervetlen anion, képlete NO2−. A benne található N–O kötések egyenlő hosszúak, és egymással nagyjából 120°-os szöget zárnak be. Egy proton hozzáadásával jön belőle létre a nem stabil salétromossav, mely gyenge sav. A nitritet oxidálni és redukálni is lehet. A reakció terméke a használt oxidáló- vagy redukálószer anyagi minőségtől és erősségétől is függ. A nitrition ambidentát ligandum, a komplexekben legalább öt különböző módon koordinálódhat.[1] A nitrition a biokémiában is fontos szerepet játszik, az erős értágító hatású nitrogén-monoxid kiindulási anyaga. A nitritet húsok besózásához, füstöléséhez is használják. A szerves kémiában a NO2-csoport a salétromsavas észterekben és a nitrovegyületekben szerepel.
A nitrition[szerkesztés]
Nitritsók[szerkesztés]
A nátrium-nitritet iparilag úgy állítják elő, hogy „nitrózus gázokat” vezetnek nátrium-hidroxid vagy nátrium-karbonát vizes oldatába.[1]
- NO + NO2 + 2NaOH (vagy Na2CO3) → 2NaNO2 +H2O (vagy CO2)
A terméket átkristályosítással tisztítják. Az alkálifémek nitritjei olvadáspontjukig (a KNO2-é 441 °C) vagy annál magasabb hőmérsékletig is stabilak. Az ammónium-nitrit előállítható dinitrogén-trioxidból, mely formálisan a salétromossav anhidridje:
- 2NH3 + H2O +N2O3 → 2NH4NO2
Melegítés hatására ez a vegyület robbanásszerűen bomolhat.
A szerves kémiában a nitriteket diazotálási reakciókban alkalmazzák.
Szerkezete[szerkesztés]

A nitrition szimmetrikus felépítésű (a C2v pontcsoportba tartozik), a két N–O kötése egyenlő hosszúságú. A vegyértékkötés-elmélet leírása szerint olyan rezonáns hibrid, melynek két kanonikus alakja egymás tükörképe. A molekulapálya-elmélet szerint mindkét oxigénatom szigma-kötéssel kapcsolódik a nitrogénatomhoz, továbbá a nitrogén- és az oxigénatomoknak a molekula síkjára merőleges p-pályáiból delokalizált pi-kötés alakul ki. Az ion negatív töltése egyenlő mértékben oszlik meg a két oxigénatom között. A nitrogén- és a két oxigénatom is egy-egy nemkötő elektronpárral rendelkeznek, így a nitrition Lewis-bázis. A fémionokkal szemben így ambidentát ligandumként viselkedhet: akár az oxigén-, akár a nitrogénatom képes a nemkötő elektronpárjával koordinálódni.
Sav-bázis tulajdonságok[szerkesztés]
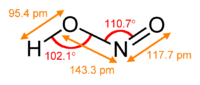
Vizes oldatokban a salétromossav gyenge savnak számít.
A salétromossav nagyon illékony – gázfázisban leginkább a sík szerkezetű transz-formában fordul elő. Oldatban instabil, az alábbi diszproporcionálódási reakció játszódik le:
- 3HNO2 (aq) ⇌ H3O+ + NO3- + 2NO
0 °C-on ez a reakció lassan játszódik le.[1] A nitrogén-monoxid egyik laboratóriumi előállítási módja az, hogy nitrites oldathoz redukálószer – például vas(II) – jelenlétében savat engednek.
Oxidáció és redukció[szerkesztés]
A nitrogénatom oxidációs száma a nitritben +3. Ez azt jelenti, hogy oxidációval +4 vagy +5 is lehet ez az érték, de redukcióval akár −3-ig is csökkenthető. Az alábbi táblázat néhány, a salétromossavat közvetlenül tartalmazó reakció redoxpotenciálját adja meg.[3]
Félreakció E0/V NO3- + 3H+ + 2e- ⇌ HNO2 + H2O +0,94 2HNO2+ 4H+ + 4e- ⇌ H2N2O2 + 2H2O +0,86 N2O4 + 2H+ + 2e- ⇌ 2HNO2 +1,065 2HNO2+ 4H+ + 4e- ⇌ N2O + 3H2O +1,29
Az adatokat ki lehet bővíteni, hogy alacsonyabb oxidációs számú termékeket is mutasson. Például:
- H2N2O2 + 2H+ + 2e- ⇌ N2 + 2H2O; E0 = 2,65 V
Az oxidációs folyamatok végén általában nitrátion jön létre, melyben a nitrogén oxidációs száma +5. A permanganáttal történő oxidáció például felhasználható a nitrit (titrálással történő) mennyiségi elemzéshez.
- 5NO2- + 2MnO4- + 6H+ → 5NO3- + Mn2+ + 3H2O
A redukciós folyamatok terméke attól függ, milyen és mennyire erélyes redukálószert használunk. Ha kén-dioxidot használnak, a termék NO és N2O; ón(II) alkalmazásával H2N2O2 hiposalétromossav jön létre; hidrogén-szulfidot használva egészen ammóniáig megy a redukció. Ha N2H5+ hidrazinium kationnal végezve a redukciót a robbanékony hidrogén-azid (HN3) keletkezik:
- HNO2 + N2H5+ → HN3 + H2O + H3O+
Mely tovább reagálhat nitrittel:.
- HNO2 + HN3 → N2O + N2 + H2O
Ez a reakció annyiban szokatlan, hogy négyféle oxidációs számú nitrogént tartalmazó vegyületek szerepelnek benne.[1]
Koordinációs komplexek[szerkesztés]
A nitrition legalább öt különféle úton tud kötéseket kialakítani.[1]
- Ha a nitrogén a központi fémionhoz kapcsolódik, akkor nitro- komplex jön létre.
- Ha az egyik oxigén koordinálódik a központi ionhoz, akkor nitrito- komplex alakul ki.
- Ha mindkét oxigénatom egy központhoz kapcsolódik, akkor kelát komplex keletkezik.
- A nitrition aszimmetrikus hídként is kapcsolódhat két fémionhoz: az egyikkel a nitrogén, a másikkal az egyik oxigén létesít kapcsolatot.
- Egy oxigénatom hídként kapcsol össze két fémiont.
Alfred Werner behatóan tanulmányozta a nitro-nitro izomériát (1. és 2. kötési mód). A kobalt-pentaminnak nitrittel létrehozott vörös izomere nitrito komplex, [Co(NH3)5(ONO)]2+; ez metastabil, és átizomerizálódik a sárga nitrovegyületté: [Co(NH3)5(NO2)]2+. Nitritet tartalmazó kelát komplexre (3-as kötési mód) példa: [Cu(bipy)2(O2N)]NO3, ahol a „bipy” a 2,2'-bipiridil bidentát ligandum. Ebben a komplexben a két bipy ligandum a rézion négy koordinációs helyét foglalja el, így a nitritnek két helyen kell kötődnie, hogy a rézion körül oktaéderes elrendeződés alakuljon ki.
Nitrit a biokémiában[szerkesztés]
A húsok besózásához nátrium-nitritet használnak, mivel ez megakadályozza a baktériumok elszaporodását, és a húsban lévő mioglobinnal vonzó sötétvörös színt kölcsönöz neki. A nitrit viszonylag erősen mérgező volta miatt a húsokban csak 200 milliomod résznyi (ppm) nitrit lehet. A halálos dózis ember esetén 1 kg testtömegre vetítve 22 mg. Bizonyos körülmények között – ilyen például a főzés – a húsban lévő nitritek az aminosavak bomlástermékeivel ismert rákkeltő anyagokká, nitrózaminokká alakulhatnak.[4]
A nitrit jelenlétét a Griess-teszttel lehet kimutatni és elemezni. A reakció során a NO2− tartalmú mintából szulfanilsav és naftil-1-amin hatására savas közegben mélyvörös azovegyület keletkezik.[5] A nitritet számos baktérium képes ammóniává vagy nitrogén-monoxiddá redukálni. Oxigénhiányos környezetben a nitritből nitrogén-monoxid alakulhat ki, mely értágítóként viselkedik. Több mechanizmust is leírtak a nitrit-NO átalakulásra: xantin-oxidoreduktáz, nitrit-reduktáz vagy NO-szintáz hatására végbemenő enzimatikus redukció, illetve savas közegben végbemenő nem enzimatikus diszproporciós reakció.
Szerves nitritek és nitrovegyületek[szerkesztés]


A szerves kémiában a nitritek a salétromossav észterei, melyek nitrozoxi funkciós csoportot tartalmaznak. A nitrovegyületekben C-NO2 csoport található. A nitritek általános képlete RONO, ahol R aril- vagy alkilcsoport. Amil-nitritet vagy más alkil-nitritet szívbetegségekre ható gyógyszerekben alkalmaznak. Alkil-nitriteket általában a Meyer-szintézissel állítanak elő,[6][7] melynek során alkil-halogenid és fém-nitrit reakciójában nitroalkánok és nitritek keveréke keletkezik.
A nitrovegyületek egyik egyszerű példája a nitrobenzol. Az aromás nitrálási reakcióban egy C−H kötés felhasad, és a kötő elektronpár a szénatomon marad. Ez a két elektron addícionál a nitróniumionra.
Fordítás[szerkesztés]
Ez a szócikk részben vagy egészben a Nitrite című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Hivatkozások[szerkesztés]
- ↑ a b c d e Greenwood, pp 461-464
- ↑ IUPAC SC-Database Archiválva 2017. június 19-i dátummal a Wayback Machine-ben A comprehensive database of published data on equilibrium constants of metal complexes and ligands
- ↑ Greenwood, p 431
- ↑ Jakszyn P, Gonzalez CA (2006. július 21.). „Nitrosamine and related food intake and gastric and oesophageal cancer risk: a systematic review of the epidemiological evidence”. World J Gastroenterol 12 (27), 4296–4303. o. PMID 16865769.
- ↑ V. M. Ivanov (2004). „The 125th Anniversary of the Griess Reagent”. Journal of Analytical Chemistry 59 (10), 1002–1005. o. DOI:10.1023/B:JANC.0000043920.77446.d7. Translated from V. M. Ivanov (2004). „”. Zhurnal Analiticheskoi Khimii 59 (10), 1109–1112. o.
- ↑ Victor Meyer (1872). „Ueber die Nitroverbindungen der Fettreihe”. Justus Liebig's Annalen der Chemie 171 (1), 1–56. o. DOI:10.1002/jlac.18741710102. ; Victor Meyer, J. Locher (1876). „Ueber die Pseudonitrole, die Isomeren der Nitrolsäuren”. Justus Liebig's Annalen der Chemie 180 (1-2), 133–155. o. DOI:10.1002/jlac.18761800113. ; V. Meyer and Stüber (1872). „Vorläufige Mittheilung”. Chemische Berichte 5, 203–205. o. DOI:10.1002/cber.18720050165. ; Victor Meyer, O. Stüber (1872). „Ueber die Nitroverbindungen der Fettreihe”. Chemische Berichte 5, 399. o. DOI:10.1002/cber.187200501121. ; Victor Meyer, A. Rilliet (1872). „Ueber die Nitroverbindungen der Fettreiche. Dritte Mittheilung”. Chemische Berichte 5, 1029–1034. o. DOI:10.1002/cber.187200502133. ; Victor Meyer, C. Chojnacki (1872). „Ueber die Nitroverbindungen der Fettreihe. Vierte Mittheilung”. Chemische Berichte 5, 1034–1038. o. DOI:10.1002/cber.187200502134.
- ↑ Robert B. Reynolds, Homer Adkins (1929). „The Relationship of the Constitution of Certain Alky Halides to the Formation of Nitroparaffins and Alkyl Nitrites”. Journal of the American Chemical Society 51 (1), 279–287. o. DOI:10.1021/ja01376a037.
