Hidroxilamin
| Hidroxilamin | |||
 |

| ||
| |||
| IUPAC-név | hidroxilamin | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 7803-49-8 | ||
| PubChem | 787 | ||
| ChemSpider | 766 | ||
| |||
| |||
| InChIKey | AVXURJPOCDRRFD-UHFFFAOYSA-N | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | NH2OH | ||
| Moláris tömeg | 33,0298 g/mol | ||
| Megjelenés | fehér tűk | ||
| Sűrűség | 1,20 g·cm–3 (14 °C)[1] | ||
| Olvadáspont | 33,1 °C[1] | ||
| Forráspont | 142 °C[1] | ||
| Oldhatóság (vízben) | hideg vízben jól oldódik meleg vízben bomlik | ||
| Kristályszerkezet | |||
| Dipólusmomentum | 0,67553 debye | ||
| Termokémia | |||
| Std. képződési entalpia ΔfH |
−39,9 kJ/mol | ||
| Standard moláris entrópia S |
? J K−1 mol−1 | ||
| Veszélyek | |||
| EU osztályozás | Robbanásveszélyes (E) Ártalmas (Xn) Veszélyes a környezetre (N)[1] | ||
| NFPA 704 | |||
| R mondatok | R2, R21/22, R37/38, R40, R41, R43, R48/22, R50[1] | ||
| S mondatok | (S2), S26, S36/37/39, S46, S61[1] | ||
| Rokon vegyületek | |||
| Rokon hidroxilammóniumsók | hidroxilammónium-klorid hidroxilammónium-nitrát hidroxilammónium-szulfát | ||
| Rokon vegyületek | ammónia hidrazin | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
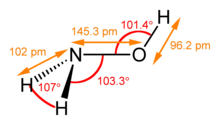
A hidroxilamin egy színtelen, instabil, rombos kristályszerkezetű tűk alakjában kristályosodó vegyület. A képlete NH2OH. Feloldódik hideg vízben és alkoholban. Vizes oldatban gyenge bázisként viselkedik, erős redukálószer. Közepesen mérgező hatású. A salétromsav redukciójakor képződik.
Kémiai tulajdonságai
[szerkesztés]A hidroxilamin gyenge bázis, ha vízzel reagál, hidroxilammónium-ionok és hidroxidionok keletkeznek belőle.
Óvatos melegítés hatására elbomlik, hirtelen hevítés hatására felrobban. A bomlás reakcióegyenlete:
Erős redukálószer. Ezüstsókból fémezüstöt, higanysókból fémhiganyt szabadít fel. Vörös színű réz(I)-oxidot tesz szabaddá a lúgos réz-tartarát oldatból. Savas vagy semleges kémhatású közegben elszínteleníti a kálium-permanganát oldatát. A higany(II)-klorid oldatából higany(I)-kloridot választ ki, ami fehér csapadék alakjában válik ki. Lassan ammónium-nitráttá oxidálódik levegőn. Nátrium hatására a hidroxilcsoportjának hidrogénje nátriumra cserélődik, a reakció igen heves. A keletkező vegyület képlete: NH2ONa. Savakkal sókat (hidroxilammónium-sókat) képez, a sói szintén erős redukálószerek. Reakcióba lép halogénekkel is, ekkor halogénsavak és nitrogén képződnek.
Előállítása
[szerkesztés]Ha tömény salétromsavban a hidrogénnél negatívabb standardpotenciálú fémeket oldanak fel, a fejlődő naszcensz hidrogén hatására a salétromsav hidroxil-aminná redukálódhat. Akkor is képződik, ha a salétromsavat amalgámozott ólomkatódon elektrolitikusan redukálnak.
Felhasználása
[szerkesztés]A hidroxilamint redukálószerként alkalmazzák, illetve felhasználják a kaprolaktám gyártásakor, ami poliamid típusú műanyagok alapanyaga.
Források
[szerkesztés]- Erdey-Grúz Tibor: Vegyszerismeret
- Nyilasi János: Szervetlen kémia
Hivatkozások
[szerkesztés]




