Foszfol
| Foszfol | |||
 |

| ||
| IUPAC-név | 1H-foszfol | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 288-01-7 | ||
| PubChem | 164575 | ||
| ChemSpider | 144273 | ||
| |||
| |||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C4H5P | ||
| Moláris tömeg | 84,06 g/mol | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
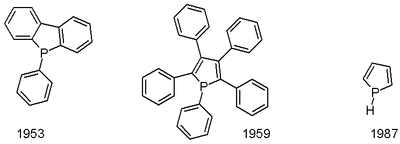
A foszfol szerves vegyület, a pirrol foszfortartalmú analógja, kémiai képlete C4H4PH. A foszfol megnevezéssel az alap heterociklusos vegyület szubsztituált származékaira is utalhatnak. Ezek a vegyületek elméleti szempontból érdekesek, de átmenetifémek ligandumaként és bonyolultabb foszfororganikus vegyületek prekurzoraként is szolgálnak.
Szerkezet, kötésrendszer[szerkesztés]
A hasonló 5-tagú heterociklusos pirrollal, tiofénnel, furánnal ellentétben a foszfolok aromássága csökkent mértékű, ami tükrözi a foszfor azon tulajdonságát, hogy nemkötő elektronpárja nehezen delokalizálódik.[1] Ezen különbség fő jele a foszfor piramidalizációja. Az aromásság hiányát a foszfolok reakciókészsége is mutatja.[2]
Előállítása[szerkesztés]
A foszfol alapvegyületet először 1983-ban írták le. Lítium-foszfolid alacsony hőmérsékletű protonálásával állították elő.[3] A pentafenilfoszfolról 1953-ban számoltak be.[4] A foszfolok előállításának egyik lehetősége a McCormack-reakció, melynek során egy 1,3-dién addícionál foszfin-kloridra (RPCl2), majd dehidrohalogéneződik.[5] Fenilfoszfolok nyerhetőek cirkonaciklopentadiénekből PhPCl2-nal végzett reakcióval.[6]
Reakciókészség[szerkesztés]
A szekunder – P−H kötést tartalmazó – foszfolok viselkedését ennek a csoportnak a reakciókészsége határozza meg. A szubsztituálatlan foszfol könnyen átrendeződik: a P-ról a H a 2-es szénatomra vándorol, majd a molekula dimerizálódik.
A foszfolok többsége tercier, jellemzően P-metil-vagy P-fenil vegyület. Ezek nem aromás volta reakciókészségükben nyilvánul meg, de a P−C kötések nem reagálnak. Például elektrofil alkinekkel Diels–Alder-reakcióba lépnek. Bennük a foszforatom bázisos, ligandumként szolgál.
A 2,5-difenil-foszfolok funkcionalizálása deprotonálással, majd azt követő P-acilezéssel történhet, ekkor az 1H, 2H, 3H foszfolid egyensúly az acilcsoport 1:3 vándorlását okozza.[7] β-funkcionális foszfabenzolok (foszfininek vagy foszforinek) is készíthetők imidoil-kloriddal történő funkcionalizálás és beékelési reakció révén.[8]
Hivatkozások[szerkesztés]
- ↑ (2007) „The important role of the phosphorus lone pair in phosphole aromaticity”. Heteroatom Chemistry 18, 754. o. DOI:10.1002/hc.20364.
- ↑ (2016) „Phosphaphenalenes: An Evolution of the Phosphorus Heterocycles”. SynLett 27, 2293–2300. o. DOI:10.1055/s-0035-1562506.
- ↑ (1983) „Proton [1,5] shifts in P-unsubstituted 1H-phospholes. Synthesis and chemistry of 2H-phosphole dimers”. J. Am. Chem. Soc. 105, 6871–6877. o. DOI:10.1021/ja00361a022.
- ↑ A Guide to Organophosphorus Chemistry Louis D. Quin 2000 John Wiley & Sons ISBN 0-471-31824-8
- ↑ W. B. McCormack (1973). „3-Methyl-1-Phenylphospholene oxide”. Org. Synth.. ; Coll. Vol. 5: 787
- ↑ Paul J. Fagan and William A. Nugent (1998). „1-Phenyl-2,3,4,5-Tetramethylphosphole”. Org. Synth.. ; Coll. Vol. 9: 653
- ↑ (2005) „A straightforward synthesis of 3-acylphospholes.”. Organic Letters 7 (20), 4511–4513. o. DOI:10.1021/ol051816d. PMID 16178571.
- ↑ (2005) „One-Pot Conversion of Phospholide Ions into β-Functional Phosphinines”. Angewandte Chemie International Edition 44, 1082–1084. o. DOI:10.1002/anie.200462020. PMID 15662672.
Fordítás[szerkesztés]
Ez a szócikk részben vagy egészben a Phosphole című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.