„N-Acetilglükózamin” változatai közötti eltérés
Új oldal, tartalma: „{{CÍM:''N''-Acetilglükózamin}} {{Chembox | Verifiedfields = changed | Watchedfields = changed | verifiedrevid = 413080540 | Name = ''N''-Acetilglükózamin | ImageFile1 = N-Acetylglucosamine.svg | ImageSize1 = 160 | ImageFile2 = Haworth projection of N-Acetylglucosamine.svg | ImageSize2 = 120 | ImageCaption2 = Haworth-projekció | IUPACName = β-{{dexter}}-(Acetilamino)2-dezoxiglükopiranóz | OtherNames = ''N''-Acetil-{{dexter}}-glükózamin, GlcNAc, NAG |…” Címke: HTML-sortörés |
(Nincs különbség)
|
A lap 2024. január 19., 18:13-kori változata
| N-Acetilglükózamin | |||

| |||
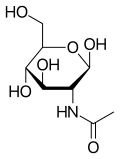
| |||
| IUPAC-név | β-d-(Acetilamino)2-dezoxiglükopiranóz | ||
| Más nevek | N-Acetil-d-glükózamin, GlcNAc, NAG | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 7512-17-6 | ||
| PubChem | 24139 | ||
| ChemSpider | 22563 | ||
| EINECS-szám | 231-368-2 | ||
| KEGG | C03878 | ||
| ChEBI | 28009 | ||
| |||
| |||
| InChIKey | OVRNDRQMDRJTHS-FMDGEEDCSA-N | ||
| Beilstein | 1247660 | ||
| Gmelin | 721281 | ||
| UNII | V956696549 | ||
| ChEMBL | 447878 | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C8H15NO6 | ||
| Moláris tömeg | 221.21 | ||
| Olvadáspont | 211 | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
Az N-acetilglükózamin (GlcNAc) a glükóz amidszármazéka. A glükózamin és az ecetsav közti szekunder amin. Számos biológiai rendszerben fontos.
A baktériumok sejtfalát alkotó biopolimer része, mely váltakozó GlcNAc- és N-acetilmuraminsav-egységekből áll, melyek a MurNAc tejsavrészénél oligopeptideken keresztül keresztkötéseket létesítenek. E szerkezet a peptidoglikán, korábbi nevén murein.
A GlcNAc az ízeltlábúak, például a rovarok és a rákok külső vázát, a puhatestűek radulájának, a fejlábúak rostrumának és a legtöbb gomba sejtfalának fő alkotója, a kitin monomerje.
Glükuronsavval polimerizálva hialuronsavat alkot.
A GlcNAc az elasztáz felszabadulását humán granulocitákból 8–17%-kal csökkenti, de ez kisebb, mint az N-acetilgalaktózaminé (92–100%).[1]
Orvosi használat
Vizsgálták autoimmun betegségek kezelésében, 2011-es és 2023-as kísérletek sikerről számoltak be.[2][3]
O-GlcNAc-iláció
Az O-GlcNAc-iláció egy GlcNAc-egység hozzáadása egy fehérje szerinjéhez vagy treoninjához.[4] A foszforilációhoz hasonlóan az N-acetilglükózamin hozzáadása vagy eltávolítása aktiválja, illetve deaktiválja az enzimeket és a transzkripciós faktorokat.[4] Ezek gyakran azonos szerinért/treoninért versenyeznek.[4] Az O-GlcNAc-iláció gyakoribb a kromatinon, és stresszválasznak tekintik.[4]
A hiperglikémia növeli az O-GlcNAc-ilációt, inzulinrezisztenciát okozva.[5] Ez az O-GlcNAc-iláció diszfunkciója. Az O-GlcNAc-iláció csökkenése összefügg a kognitív hanyatlással. Idős egerekben az O-GlcNAc-iláció növekedése a hippocampusban javítja a tértanulást és a memóriát.[6]
Jegyzetek
- ↑ Kamel M, Hanafi M, Bassiouni M (1991). „Inhibition of elastase enzyme release from human polymorphonuclear leukocytes by N-acetyl-galactosamine and N-acetyl-glucosamine”. Clinical and Experimental Rheumatology 9 (1), 17–21. o. PMID 2054963.
- ↑ Grigorian A, Araujo L, Naidu NN, Place DJ, Choudhury B, Demetriou M (2011. november 1.). „N-acetylglucosamine inhibits T-helper 1 (Th1)/T-helper 17 (Th17) cell responses and treats experimental autoimmune encephalomyelitis”. The Journal of Biological Chemistry 286 (46), 40133–40141. o. DOI:10.1074/jbc.M111.277814. PMID 21965673.
- ↑ Sy M, Newton BL, Pawling J, Hayama KL, Cordon A, Yu Z, Kuhle J, Dennis JW, Brandt AU, Demetriou M (2023. szeptember 1.). „N-acetylglucosamine inhibits inflammation and neurodegeneration markers in multiple sclerosis: a mechanistic trial”. Journal of Neuroinflammation 20 (1), 209. o. DOI:10.1186/s12974-023-02893-9. PMID 37705084.
- ↑ a b c d Hart GW, Slawson C, Ramirez-Correa G, Lagerlof O (2011). „Cross talk between O-GlcNAcylation and phosphorylation: roles in signaling, transcription, and chronic disease”. Annual Review of Biochemistry 80, 825–858. o. DOI:10.1146/annurev-biochem-060608-102511. PMID 21391816.
- ↑ Ma J, Hart G (2013. augusztus 1.). „Protein O-GlcNAcylation in diabetes and diabetic complications”. Expert Review of Proteomics 10 (4), 365–380. o. DOI:10.1586/14789450.2013.820536. PMID 23992419.
- ↑ Wheatley EG, Albarran E, White CW, Bieri G, Sanchez-Diaz C, Pratt K, Snethlage CE, Ding JB, Villeda SA (2019. október 1.). „Neuronal O-GlcNAcylation Improves Cognitive Function in the Aged Mouse Brain”. Current Biology 29 (20), 3359–3369.e4. o. DOI:10.1016/j.cub.2019.08.003. PMID 31588002.
Fordítás
Ez a szócikk részben vagy egészben a N-Acetylglucosamine című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
