N-brómszukcinimid
| N-brómszukcinimid | |||
 |

| ||
| IUPAC-név | 1-bróm-2,5-pirrolidindion | ||
| Más nevek | N-brómszukcinimid, NBS | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 128-08-5 | ||
| ChemSpider | 60528 | ||
| ChEBI | 53174 | ||
| |||
| |||
| InChIKey | PCLIMKBDDGJMGD-UHFFFAOYSA-N | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C4H4BrNO2 | ||
| Moláris tömeg | 177,98 g/mol | ||
| Megjelenés | fehér szilárd anyag | ||
| Sűrűség | 2,098 g/cm³ (szilárd) | ||
| Olvadáspont | 175–178 °C | ||
| Forráspont | 339 °C | ||
| Oldhatóság (vízben) | 14,7 g/l (25 °C-on) | ||
| Oldhatóság (CCl4) | oldhatatlan (25 °C-on) | ||
| Veszélyek | |||
| Főbb veszélyek | irritáló | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
Az N-brómszukcinimid vagy NBS gyökös szubsztitúciós, elektrofil addíciós és elektrofil szubsztitúciós reakciókban használatos szerves kémiai reagens. Kényelmesen kezelhető brómgyök (Br•) forrás.
Előállítása
[szerkesztés]Kereskedelmi forgalomban is beszerezhető. Laboratóriumi előállításakor szukcinimid jeges vizes oldatához nátrium-hidroxidot és brómot adnak, ekkor az NBS csapadékként kiválik, melyet szűréssel gyűjtenek össze.[forrás?]
A Wohl–Ziegler-reakcióban jobb kihozatal érhető el a tisztítatlan NBS-sel, de más esetekben a nem kellően tiszta (kissé sárgás) reagens megbízhatatlan eredményt okozhat. Az NBS 90–95 °C-os vízből történő átkristályosítással tisztítható (10 g NBS 100 ml vízben).[1]
Reakciói
[szerkesztés]Alkénekre történő addíció
[szerkesztés]Az NBS az 1 alkénnel vizes oldatban a 2 brómhidrin keletkezése közben reagál. A reakció legkedvezőbb módja az NBS apránként történő beadagolása az alkén 50%-os vizes DMSO, DME, THF, vagy terc-butanol oldatába 0 °C-on.[2] A reakció során képződő bromóniumion és annak azonnali vízmolekulával történő támadása a Markovnyikov-szabály szerinti addíciónak kedvez, és szelektíven az anti sztereokémiájú termék keletkezik.[3]
Melléktermékként α-brómketonok és dibróm-származékok keletkeznek. Ezek mennyisége minimálisra csökkenthető, ha frissen átkristályosított NBS-t használunk.
Változatos bifunkcionális alkéneket lehet szintetizálni, ha víz helyett más nukleofilt alkalmazunk.[4]
Allil és benzil helyzetű brómozás
[szerkesztés]Az NBS-sel történő allil vagy benzil helyzetű brómozás szokásos körülményei a vízmentes CCl4-ben oldott NBS refluxoltatása gyökös iniciátor – többnyire azobiszizobutironitril (AIBN) vagy benzoil-peroxid – vagy besugárzás, esetleg mindkettő alkalmazása mellett, ezzel elősegítve a gyökös reakció iniciálását.[5][6] A reakció során köztitermékként képződő allil- és benzilgyökök más gyököknél stabilabbak, így a reakció fő terméke allil-, illetve benzil-bromid lesz. Ezt az eljárást Wohl–Ziegler-reakciónak is nevezik.[7][8]
A reakció során biztosítani kell a szén-tetraklorid vízmentességét, mivel víz jelenlétében a kívánt termék valószínűleg elhidrolizálna.[9] A víz- és savmentes körülményeket többnyire bárium-karbonát hozzáadásával biztosítják.
Bár a fenti reakcióban többféle allil-bromid izomer is képződhetne, de csak egyféle termék keletkezik, mert a 4-es helyzetű gyök stabilabb a metilgyökhöz képest.
Karbonilvegyületek brómozása
[szerkesztés]Az NBS a karbonilvegyületeket α-helyzetben brómozza gyökös (a fentiekhez hasonló) vagy sav által katalizált reakcióban. Az 1 hexanoil-klorid például NBS-sel alfa-helyzetben brómozható savkatalízis mellett.[10]
Célszerűbb eljárás az enolátok, enoléterek vagy enol-acetátok NBS-sel történő α-brómozása, mivel ennek jobb a kitermelése és kevesebb mellékterméket eredményez.[11][12]
Aromás vegyületek brómozása
[szerkesztés]Elektronban gazdag aromás vegyületek, például fenolok, anilinek és különféle aromás heterociklusok[13] brómozhatóak NBS-sel.[14][15] Oldószerként DMF-et használva nagyfokú para-szelektivitás biztosítható.[16]
Hofmann-lebontás
[szerkesztés]Erős bázis, például DBU jelenlétében az NBS primer amidokkal karbamát terméket ad Hofmann-lebontási reakcióban.[17]
Alkoholok szelektív oxidációja
[szerkesztés]Nem gyakori, de előfordulhat, hogy az NBS oxidálja az alkoholokat. E. J. Corey és munkatársai úgy találták, hogy szekunder alkoholok szelektíven oxidálhatóak primer alkoholok jelenlétében, ha vizes dimetoxietánban (DME) oldott NBS-t alkalmaznak.[18]
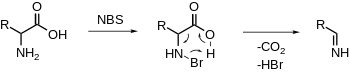
α-aminosavak oxidatív dekarboxilezése
[szerkesztés]Az NBS elektrofil módon brómozza az amint, ezt dekarboxilezés követi, és imin képződik. További hidrolízis hatására aldehid és ammónia keletkezik.[19][20]
Biztonsági tudnivalók
[szerkesztés]Bár az NBS az elemi brómnál könnyebben és biztonságosabban kezelhető, belégzését kerülni kell. Tárolás közben bróm felszabadulása közben bomlik, ezért hűtőszekrényben tárolandó. Tiszta állapotban fehér színű, de brómmal szennyezve szürkés vagy barnás elszíneződést mutat.
Az NBS-sel végzett reakciók általában exotermek, ezért nagyobb léptékű alkalmazása további elővigyázatosságot igényel.
Hivatkozások
[szerkesztés]- ↑ (1959) „N-Bromosuccinimide. I. Allylic Bromination, a General Survey of Reaction Variables”. J. Am. Chem. Soc. 81 (18), 4863–4873. o. DOI:10.1021/ja01527a027.
- ↑ „Selective epoxidation of terminal double bonds”. Org. Synth..; Coll. Vol. 6: 560
- ↑ Beger, J. (1991). „Präparative Aspekte elektrophiler Dreikomponentenreaktionen mit Alkenen”. J. Prakt. Chem. 333 (5), 677–698. o. DOI:10.1002/prac.19913330502.
- ↑ (2004) „Bromofluorination of alkenes”. Org. Synth..; Coll. Vol. 10: 128
- ↑ Djerassi, Carl (1948). „Brominations with N-Bromosuccinimide and Related Compounds. The Wohl–Ziegler Reaction”. Chem. Rev. 43 (2), 271–317. o. DOI:10.1021/cr60135a004. PMID 18887958.
- ↑ (1963) „4-Bromo-2-heptene”. Org. Synth..; Coll. Vol. 4: 108
- ↑ (1919) „Bromierung ungesättigter Verbindungen mit N-Brom-acetamid, ein Beitrag zur Lehre vom Verlauf chemischer Vorgänge”. Berichte der deutschen chemischen Gesellschaft (A and B Series) 52, 51. o. DOI:10.1002/cber.19190520109.
- ↑ (1942) „Die Synthese des Cantharidins”. Justus Liebig's Annalen der Chemie 551, 1. o. DOI:10.1002/jlac.19425510102.
- ↑ (1984) „Regioselective ring opening of selected benzylidene acetals. A photochemically initiated reaction for partial deprotection of carbohydrates”. J. Org. Chem. 49 (6), 992. o. DOI:10.1021/jo00180a008.
- ↑ (1988) „2-Bromohexanoyl chloride”. Org. Synth..; Coll. Vol. 6: 190
- ↑ (1973) „α-Halocarbonyl compounds. II. Position-specific preparation of α-bromoketones by bromination of lithium enolates. Position-specific introduction of α,β-unsaturation into unsymmetrical ketones”. J. Org. Chem. 38 (14), 2576. o. DOI:10.1021/jo00954a045.
- ↑ (1992) „Various Glycosyl Donors with a Ketone or Oxime Function next to the Anomeric Centre: Facile Preparation and Evaluation of their Selectivities in Glycosidations”. Synthesis 1992, 179-84. o. DOI:10.1055/s-1992-34167.
- ↑ (1998) „Regioselective synthesis of 3-substituted indoles”. Org. Synth..; Coll. Vol. 9: 417
- ↑ (1981) „Bromination and chlorination of pyrrole and some reactive 1-substituted pyrroles”. J. Org. Chem. 46 (11), 2221. o. DOI:10.1021/jo00324a005.
- ↑ (2005) „Synthesis of 5-bromoisoquinoline and 5-bromo-8-nitroisoquinoline”. Org. Synth. 81, 98. o.
- ↑ (1979) „N-Bromosuccinimide-dimethylformamide: a mild, selective nuclear monobromination reagent for reactive aromatic compounds”. J. Org. Chem. 44 (25), 4733. o. DOI:10.1021/jo00393a066.
- ↑ (2004) „Methyl carbamate formation via modified Hofmann rearrangement reactions”. Org. Synth..; Coll. Vol. 10: 549
- ↑ (1979) „Total synthesis of (±)-2-isocyanopupukeanane”. Tetrahedron Lett. 20 (30), 2745–2748. o. DOI:10.1016/S0040-4039(01)86404-2.
- ↑ Ramachandran, M. S. (1990. január 1.). „N-Chlorosuccinimide-Promoted Oxidative Decarboxylation of α-Amino Acids in Aqueous Alkaline Medium”. Bulletin of the Chemical Society of Japan 63 (8), 2397–2403. o. [2023. március 23-i dátummal az eredetiből archiválva]. DOI:10.1246/bcsj.63.2397. (Hozzáférés: 2018. március 17.)
- ↑ Song, Xuezheng (2014. október 15.). „Novel Strategy to Release and Tag N-Glycans for Functional Glycomics”. Bioconjugate Chemistry 25 (10), 1881–1887. o. DOI:10.1021/bc500366v. ISSN 1043-1802. PMID 25222505. PMC 4197647.
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a N-Bromosuccinimide című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.