MT-ATP6
| MT-ATP6 | |
| Azonosítók | |
| Jel | ATP6, MT-ATP6 |
| Entrez | 4508 |
| OMIM | 516060 |
| UniProt | P00846 |
| Egyéb adatok | |
| Lokusz | Mitokondrium [1] |
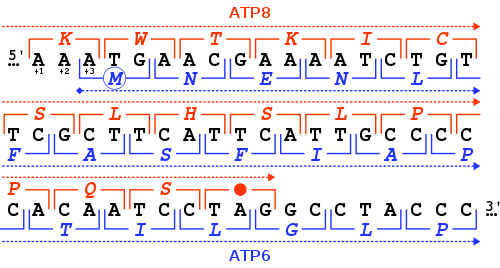
Az MT-ATP6 (más néven ATP6, teljes nevén mitokondriálisan kódolt ATP-szintáz, 6. membránalegység) mitokondriális gén, mely az ATP-szintáz Fo 6. alegységét kódolja. Ez a nagy transzmembrán F-típusú ATP-szintáz (más néven V. komplex) Fo komplexének része.[1] Ez az enzim az elektrontranszportlánc oxidatív foszforilációjának utolsó lépéséért felel. Egy része protonok áramlását teszi lehetővé speciális membránon keresztül a mitokondriumokba, egy másik az így felszabaduló energiát használja fel az ADP ATP-tá alakításához. Az MT-ATP6 gén mutációi a Leigh-szindróma eseteinek 10-20%-ában találhatók.[2]
Szerkezet[szerkesztés]

Az MT-ATP6 gén a normál mitokondriális működéshez szükséges gént kódol. A humán MT-ATP6 gén 681 bázispár hosszú.[3] Különös jellemzője, hogy az MT-ATP8 gén végével az első 46 nukleotidja átfed. Az MT-ATP6 leolvasási kerethez képest az MT-ATP8 gén a +1 keretben ér véget TAG stop kodonnal.
Az MT-ATP6 fehérje 24,8 kDa-os és 226 aminosavból áll.[4][5] A fehérje az F1Fo ATP-szintáz alegysége, mely 14 magi és 2 mitokondriális alegységből áll. A-alegységként az MT-ATP6 a nem katalitikus transzmembrán Fo részben található.[3]
Az enzim nómenklatúrájának története hosszú. Az F1 rész a „Fraction 1”-ról, az Fo az e részt gátló oligomicin-kötő képességéről kapta nevét.[6][7] Az Fo rész a mitokondriális membránba ágyazott protonpórus. 4 fő alegységből, (A, B, C) és emberben további 6 alegységből (d, e, f, g, F6 és 8 (más néven A6L)). Ezen alegység Escherichia coli-homológjának 3D-s szerkezetét elektron-mikroszkópiás adatokon alapulva modellezték (az PDB: 1c17 M-lánca). Ez transzmembrán 4-α-csoportot alkot.
Funkció[szerkesztés]
Ez az alegység a protoncsatorna fő komponense, és fontos lehet a protonok membránon keresztül való átvitelében. Az F1 katalízise a központi tönk és az Fo c-gyűrűje forgásától függ, melyeket a protonok membránon át való haladása hajt az Fo c-gyűrűje és az A-alegység közt. A perifériás tönk az A-alegységet az F1 domén külső felszínéhez kapcsolja, és feltehetően az A-alegység és az F1α3β3 katalitikus rész központi forgó résszel együtt való forgását akadályozó állórész.[8]
Klinikai jelentőség[szerkesztés]
Az MT-ATP6 és más, az oxidatív foszforilációt befolyásoló mitokondriális gének mutációi összefüggnek számos neurodegeneratív és cardiovascularis rendellenességgel, ilyen betegségek például az ATP-szintáz-hiány, a Leber-látóideg-neuropátia (LHON), a mitokondriális enkefalomiopátia stroke-szerű epizódokkal (MELAS), a Leigh-szindróma és a NARP-szindróma. A legtöbb testi sejt több ezer mitokondriumot tartalmaz, bennük egy vagy több mitokondriális DNS-másolattal. Egyes mitokondriális betegségek súlyossága az adott mutációval rendelkező mitokondriumok arányától függ. Az MT-ATP6-mutáció miatt Leigh-szindrómás emberekben gyakran a mitokondriumok nagyon magas százaléka (90–95%) rendelkezik a mutációval. A NARP kevésbé súlyos tüneteinek oka a kisebb mutánsmitokondrium-arány (70–90%). Mivel e két betegség okai azonos genetikai változások, és egy család különböző tagjaiban is előfordulhat, kutatók szerint ezek átfedő jellemzők spektrumát jelentik, nem két külön szindrómát.[2]
Mitokondriális ATP-szintáz-hiány[szerkesztés]
A mitokondriális ATP-szintáz-hiány az ATP-szintáz mennyiségének csökkenése vagy funkcióvesztése, mely számos, sok szervet és szervrendszert, különösen az idegrendszert és a szívet érintő tünetet okozhat. E betegség újszülött- vagy kora gyermekkorban életveszélyes lehet. Az érintetteknél a tünetek lehetnek evészavarok, lassú növekedés, hipotónia, letargia és késői fejlődés. Kialakulhat bennük továbbá megnövekedett vértejsavszint (tejsavacidózis), mely szédülést, hányást, gyengeséget és tachipnoét okozhat. Hiperammonémia is jelentkezhet, mely bizonyos esetekben enkefalopátiát és más szervi károsodásokat is okozhat.[9] Ataxiát, mikrokefáliát, késői fejlődést és értelmi fogyatékot észleltek az MT-ATP6-ban kereteltolódásos mutációval rendelkezőknél. Ezt okozza a 8612. helyre kerülő C, mely 36 aminosavas fehérjét hoz létre, valamint a 8610. és 8614. helyen lévő két T→C egypontos nukleotid-polimorfizmus, melyek homopolimer citozinszakaszt hoznak létre.[10]
A mitokondriális ATP-szintáz-hiány további tünete a hipertrófiás kardiomiopátia. Erre a szívizom vastagodása (hipertrófiája) jellemző, mely szívelégtelenséget okozhat.[9] Az m.8528T>C mutáció az MT-ATP6 és MT-ATP8 átfedő részében történik, és több gyermekkori kardiomiopátiás betegben is leírták. Ez az MT-ATP6 kezdőkodonját treoninra módosítja, az MT-ATP8 55. aminosavját triptofánról argininre.[11][12] A mitokondriális ATP-szintáéz hiányra ezenkívül sajátos arcmintázat jellemző magas homlokkal, lefelé hajló palpebralis fissurákkal, erőteljes orrcsonttal, alacsony fülekkel, vékony ajkakkal és micrognathiával.[9]
Leigh-szindróma[szerkesztés]
Az MT-ATP6 patogén változatai mtDNS-asszociált Leigh-szindrómát okoznak, mely általában újszülött- vagy kora gyermekkorban jelenik meg. Az érintettekben késői fejlődés, izomgyengeség vagy nehézlégzés jelentkezhet.[2] További mtDNS-asszociált Leigh-szindrómát okozó mutációk az MT-TL1-, MT-TK-, MT-TW-, MT-TV-, MT-ND1-, MT-ND2-, MT-ND3-, MT-ND4-, MT-ND5-, MT-ND6- és MT-CO3-mutációk. A mitokondriális energiafelszabadítás rendellenességei neurodegeneratív betegségeket, például Leigh-szindrómát okozhatnak, melynek először 1 és 3 éves kor közt jelentkeznek tünetei. Ezek általában vírusfertőzés után jelentkeznek, és a tünetek közé tartoznak a mozgászavarok, a perifériás neuropátia, a hipotónia, a spasticitas és a cerebellaris ataxia. Nagyjából az érintettek fele 3 éves kor előtt meghal légzési vagy szívelégtelenségben. A Leigh-szindróma anyai ágon örökölt betegség, diagnózisa e gének és az MT-ATP6 tesztelésével állítható fel.[13] A Leigh-szindrómával összefüggő mutációkban egy nukleotid változik az MT-ATP6 génben. A leggyakoribb a T8993G. E mutációk az ATP-szintáz funkcióját vagy stabilitását csökkentik, gátolva az ATP-termelést és az oxidatív foszforilációt. Bár pontos mechanizmusa ismeretlen, feltehetően a gátolt oxidatív foszforiláció a sejt számára elérhető kevesebb energia miatt okoz sejthalált. Egyes sok energiát igénylő szövetek és szervek, például az agy, az izmok és a szív különösen érzékenyek a sejt számára elérhető energia csökkenésére. Az agyban történő sejthalál okozza feltehetően a Leigh-szindrómában történő változásokat, melyek hozzájárulnak a tünetekhez. A többi érzékeny szövet sejthalála is hozzájárulhat a tünetekhez. A heteroplazmatikus T9185C mutáció egy állandósult leucin prolinra történő cseréjét okozza a 220. kodonnál, a T9191C pedig a 222. kodonnál cseréli a leucint prolinra, Leigh-típusú fenotípust okozva. Előbbi enyhe, reverzibilis fenotípust okoz, ahol a beteg vér- és izommintáinak 97%-a megerősíti a mutációt, utóbbi súlyosabb fenotípust okoz, mely a beteg halálát okozza 2 éves korban.[14]
NARP-szindróma[szerkesztés]
Az ATP6 gén egyes Leigh-szindrómát okozó mutációi hasonló, de kevésbé súlyos szindrómát is okoznak, ez a NARP-szindróma.[15] Kis mennyiségű MT-ATP6-mutációt azonosítottak a NARP-ban. Ezek mindegyikében az MT-ATP6 gén egy nukleotidja tér el. A Leigh-szindrómához hasonlóan a leggyakoribb mutáció a timin cseréje a 8993. helyen guaninra (T8993G). A NARP-okozó mutációk megváltoztathatják az ATP-szintáz szerkezetét vagy működését, csökkentve a mitokondriumok ATP-termelő képességét. Bár e mutációk pontos hatásai ismeretlenek, tovább vizsgálják a kutatók az MT-ATP6 gén változásainak összefüggését az ATP-termeléssel, az izomgyengeséggel, a látásvesztéssel és a NARP többi tünetével.[2]
Familiális kétoldali striatális nekrózis[szerkesztés]
A Leigh-szindrómához hasonló familiális kétoldali striatális nekrózist is okozhatja az MT-ATP6 gén változása. Az ilyen mutációt mutató kevés ismert esetben a gyermekek fejlődése késett, továbbá mozgáskoordinációs tünetek, hipotónia és mikrokefália jelentkeztek. Nem ismert, miért okozzák MT-ATP6-mutációk ezeket a kétoldali striatális nekrózisos gyermekekben.[2]
Kölcsönhatások[szerkesztés]
Az MT-ATP6 legalább 20 biner fehérje-fehérje kölcsönhatással rendelkezik, ebből 17 kokomplex kölcsönhatás. Kölcsönhat az SP1-gyel.[16]
Kutatás[szerkesztés]
A SENS Research Foundation tanulmánya az MT-ATP6 gén csere-DNS-ének sikeres allotóp expressziójáról számolt be sejtmagi DNS-ben.[17]
Jegyzetek[szerkesztés]
- ↑ Anderson S, Bankier AT, Barrell BG, de Bruijn MH, Coulson AR, Drouin J, Eperon IC, Nierlich DP, Roe BA, Sanger F, Schreier PH, Smith AJ, Staden R, Young IG (1981. április 1.). „Sequence and organization of the human mitochondrial genome”. Nature 290 (5806), 457–65. o. DOI:10.1038/290457a0. PMID 7219534.
- ↑ a b c d e MT-ATP6. Genetics Home Reference. NCBI
- ↑ a b Entrez Gene: MT-ATP6 mitochondrially encoded ATP synthase 6
- ↑ Zong NC, Li H, Li H, Lam MP, Jimenez RC, Kim CS, Deng N, Kim AK, Choi JH, Zelaya I, Liem D, Meyer D, Odeberg J, Fang C, Lu HJ, Xu T, Weiss J, Duan H, Uhlen M, Yates JR, Apweiler R, Ge J, Hermjakob H, Ping P (2013. október 1.). „Integration of cardiac proteome biology and medicine by a specialized knowledgebase”. Circulation Research 113 (9), 1043–53. o. DOI:10.1161/CIRCRESAHA.113.301151. PMID 23965338.
- ↑ ATP synthase subunit A, mitochondrial. Cardiac Organellar Protein Atlas Knowledgebase (COPaKB). [2018. július 19-i dátummal az eredetiből archiválva]. (Hozzáférés: 2024. január 17.)
- ↑ Kagawa Y, Racker E (1966. május 1.). „Partial resolution of the enzymes catalyzing oxidative phosphorylation”. The Journal of Biological Chemistry 241 (10), 2461–6. o. DOI:10.1016/S0021-9258(18)96640-8. PMID 4223640.
- ↑ Mccarty RE (1992. november 1.). „A plant biochemist's view of H+-ATPases and ATP synthases”. The Journal of Experimental Biology 172 (Pt 1), 431–441. o. DOI:10.1242/jeb.172.1.431. PMID 9874753.
- ↑ Carbajo RJ, Kellas FA, Runswick MJ, Montgomery MG, Walker JE, Neuhaus D (2005. augusztus 1.). „Structure of the F1-binding domain of the stator of bovine F1Fo-ATPase and how it binds an alpha-subunit”. Journal of Molecular Biology 351 (4), 824–38. o. DOI:10.1016/j.jmb.2005.06.012. PMID 16045926.
- ↑ a b c Mitochondrial complex V deficiency (angol nyelven). Genetics Home Reference. NCBI. (Hozzáférés: 2018. augusztus 3.)
- ↑ Jackson CB, Hahn D, Schröter B, Richter U, Battersby BJ, Schmitt-Mechelke T, Marttinen P, Nuoffer JM, Schaller A (2017. június 1.). „A novel mitochondrial ATP6 frameshift mutation causing isolated complex V deficiency, ataxia and encephalomyopathy”. European Journal of Medical Genetics 60 (6), 345–351. o. DOI:10.1016/j.ejmg.2017.04.006. PMID 28412374.
- ↑ Imai A, Fujita S, Kishita Y, Kohda M, Tokuzawa Y, Hirata T, Mizuno Y, Harashima H, Nakaya A, Sakata Y, Takeda A, Mori M, Murayama K, Ohtake A, Okazaki Y (2016. március 1.). „Rapidly progressive infantile cardiomyopathy with mitochondrial respiratory chain complex V deficiency due to loss of ATPase 6 and 8 protein”. International Journal of Cardiology 207, 203–5. o. DOI:10.1016/j.ijcard.2016.01.026. PMID 26803244.
- ↑ Ware SM, El-Hassan N, Kahler SG, Zhang Q, Ma YW, Miller E, Wong B, Spicer RL, Craigen WJ, Kozel BA, Grange DK, Wong LJ (2009. május 1.). „Infantile cardiomyopathy caused by a mutation in the overlapping region of mitochondrial ATPase 6 and 8 genes”. Journal of Medical Genetics 46 (5), 308–14. o. DOI:10.1136/jmg.2008.063149. PMID 19188198.
- ↑ Thorburn DR, Rahman S.szerk.: Pagon RA, Adam MP, Ardinger HH, Wallace SE, Amemiya A, Bean LJ, Bird TD, Dolan CR, Fong CT, Smith RJ, Stephens K: Mitochondrial DNA-Associated Leigh Syndrome and NARP, GeneReviews. Seattle (WA): University of Washington, Seattle (1993)
- ↑ Moslemi AR, Darin N, Tulinius M, Oldfors A, Holme E (2005. október 1.). „Two new mutations in the MTATP6 gene associated with Leigh syndrome”. Neuropediatrics 36 (5), 314–8. o. DOI:10.1055/s-2005-872845. PMID 16217706.
- ↑ Baracca A, Sgarbi G, Mattiazzi M, Casalena G, Pagnotta E, Valentino ML, Moggio M, Lenaz G, Carelli V, Solaini G (2007. július 1.). „Biochemical phenotypes associated with the mitochondrial ATP6 gene mutations at nt8993”. Biochimica et Biophysica Acta (BBA) - Bioenergetics 1767 (7), 913–9. o. DOI:10.1016/j.bbabio.2007.05.005. PMID 17568559.
- ↑ 20 binary interactions found for search term MT-ATP6. IntAct Molecular Interaction Database. EMBL-EBI. (Hozzáférés: 2018. augusztus 24.)
- ↑ Boominathan A, Vanhoozer S, Basisty N, Powers K, Crampton AL, Wang X, Friedricks N, Schilling B, Brand MD, O'Connor MS (2016. november 1.). „Stable nuclear expression of ATP8 and ATP6 genes rescues a mtDNA Complex V null mutant”. Nucleic Acids Research 44 (19), 9342–9357. o. DOI:10.1093/nar/gkw756. PMID 27596602.
Fordítás[szerkesztés]
Ez a szócikk részben vagy egészben a MT-ATP6 című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
További információk[szerkesztés]
- Holme E, Greter J, Jacobson CE, Larsson NG, Lindstedt S, Nilsson KO, Oldfors A, Tulinius M (1992. december 1.). „Mitochondrial ATP-synthase deficiency in a child with 3-methylglutaconic aciduria”. Pediatric Research 32 (6), 731–5. o. DOI:10.1203/00006450-199212000-00022. PMID 1287564.
- Torroni A, Achilli A, Macaulay V, Richards M, Bandelt HJ (2006. június 1.). „Harvesting the fruit of the human mtDNA tree”. Trends in Genetics 22 (6), 339–45. o. DOI:10.1016/j.tig.2006.04.001. PMID 16678300.
- Ingman M, Kaessmann H, Pääbo S, Gyllensten U (2000. december 1.). „Mitochondrial genome variation and the origin of modern humans”. Nature 408 (6813), 708–13. o. DOI:10.1038/35047064. PMID 11130070.
- Manfredi G, Fu J, Ojaimi J, Sadlock JE, Kwong JQ, Guy J, Schon EA (2002. április 1.). „Rescue of a deficiency in ATP synthesis by transfer of MTATP6, a mitochondrial DNA-encoded gene, to the nucleus”. Nature Genetics 30 (4), 394–9. o. DOI:10.1038/ng851. PMID 11925565.
- Torigoe T, Izumi H, Ishiguchi H, Uramoto H, Murakami T, Ise T, Yoshida Y, Tanabe M, Nomoto M, Itoh H, Kohno K (2002. szeptember 1.). „Enhanced expression of the human vacuolar H+-ATPase c subunit gene (ATP6L) in response to anticancer agents”. The Journal of Biological Chemistry 277 (39), 36534–43. o. DOI:10.1074/jbc.M202605200. PMID 12133827.
- Mishmar D, Ruiz-Pesini E, Golik P, Macaulay V, Clark AG, Hosseini S, Brandon M, Easley K, Chen E, Brown MD, Sukernik RI, Olckers A, Wallace DC (2003. január 1.). „Natural selection shaped regional mtDNA variation in humans”. Proceedings of the National Academy of Sciences of the United States of America 100 (1), 171–6. o. DOI:10.1073/pnas.0136972100. PMID 12509511.
- Ingman M, Gyllensten U (2003. július 1.). „Mitochondrial genome variation and evolutionary history of Australian and New Guinean aborigines”. Genome Research 13 (7), 1600–6. o. DOI:10.1101/gr.686603. PMID 12840039.
- Kong QP, Yao YG, Sun C, Bandelt HJ, Zhu CL, Zhang YP (2003. szeptember 1.). „Phylogeny of east Asian mitochondrial DNA lineages inferred from complete sequences”. American Journal of Human Genetics 73 (3), 671–6. o. DOI:10.1086/377718. PMID 12870132.
- Temperley RJ, Seneca SH, Tonska K, Bartnik E, Bindoff LA, Lightowlers RN, Chrzanowska-Lightowlers ZM (2003. szeptember 1.). „Investigation of a pathogenic mtDNA microdeletion reveals a translation-dependent deadenylation decay pathway in human mitochondria”. Human Molecular Genetics 12 (18), 2341–8. o. DOI:10.1093/hmg/ddg238. PMID 12915481.
- Reuter TY, Medhurst AL, Waisfisz Q, Zhi Y, Herterich S, Hoehn H, Gross HJ, Joenje H, Hoatlin ME, Mathew CG, Huber PA (2003. október 1.). „Yeast two-hybrid screens imply involvement of Fanconi anemia proteins in transcription regulation, cell signaling, oxidative metabolism, and cellular transport”. Experimental Cell Research 289 (2), 211–21. o. DOI:10.1016/S0014-4827(03)00261-1. PMID 14499622.
- Dubot A, Godinot C, Dumur V, Sablonnière B, Stojkovic T, Cuisset JM, Vojtiskova A, Pecina P, Jesina P, Houstek J (2004. január 1.). „GUG is an efficient initiation codon to translate the human mitochondrial ATP6 gene”. Biochemical and Biophysical Research Communications 313 (3), 687–93. o. DOI:10.1016/j.bbrc.2003.12.013. PMID 14697245.
- Coble MD, Just RS, O'Callaghan JE, Letmanyi IH, Peterson CT, Irwin JA, Parsons TJ (2004. június 1.). „Single nucleotide polymorphisms over the entire mtDNA genome that increase the power of forensic testing in Caucasians”. International Journal of Legal Medicine 118 (3), 137–46. o. DOI:10.1007/s00414-004-0427-6. PMID 14760490.
- Carrozzo R, Rizza T, Stringaro A, Pierini R, Mormone E, Santorelli FM, Malorni W, Matarrese P (2004. július 1.). „Maternally-inherited Leigh syndrome-related mutations bolster mitochondrial-mediated apoptosis”. Journal of Neurochemistry 90 (2), 490–501. o. DOI:10.1111/j.1471-4159.2004.02505.x. PMID 15228605.
- GeneReviews/NCBI/NIH/UW-bejegyzés az mtDNS-asszociált Leigh-szindrómáról és a NARP-ról
- MT-ATP6+protein,+human a U.S. National Library of Medicine Medical Subject Headings (MeSH) honlapján
