Hipoklorit
| Hipoklorit | |||
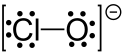
| |||

| |||
| IUPAC-név | Hipoklorit | ||
| Szabályos név | Klorát(I) | ||
| Más nevek | Klóroxid | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 14380-61-1 | ||
| PubChem | 61739 | ||
| ChemSpider | 55632 | ||
| ChEBI | 29222 | ||
| |||
| |||
| InChIKey | WQYVRQLZKVEZGA-UHFFFAOYSA-N | ||
| Gmelin | 682 | ||
| UNII | T5UM7HB19N | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A hipoklorit, más néven klóroxid anion, képlete ClO−. Számos kationnal alkot vegyületet, ezek a hipokloritok. Gyakoriak a nátrium- (háztartási fehérítő) és a kalcium-hipoklorit (a fehérítőpor összetevője, az úszómedencékhez használt „klór”).[1] A Cl–O távolság a ClO−-ban 1,69 Å.[2]
A név a hipoklórossav észtereire, vagyis kovalensen kötött ClO– csoportot tartalmazó szerves vegyületekre is utalhat, például a klórozószer terc-butil-hipokloritra.[3]
A legtöbb hipokloritsó vizes oldatként használatos. Elsősorban fehérítésre, fertőtlenítésre és vízkezelésre használják. Ezenkívül klórozásra és oxidációra is használatosak.
Reakciók
[szerkesztés]Savas reakció
[szerkesztés]A hipokloritok savas reakciója a klórral egyensúlyban lévő hipoklórossavat ad. Az alacsonyabb pH az alábbi reakciót jobbra tolja, klórt felszabadítva, mely veszélyes lehet:
Stabilitás
[szerkesztés]A hipokloritok általában instabilak, sok vegyület csak oldatban létezik. A lítium-hipokloritot (LiOCl), a kalcium-hipokloritot (Ca(OCl)2) és a bárium-hipokloritot (Ba(OCl)2) vízmentes vegyületként izolálták. Mindegyikük szilárd. Ezenkívül néhány vegyület előállítható vizes oldatban. Általában a hígabb oldat stabilabb. Nem határozható meg trend az alkáliföldfémsók esetén, mivel számos nem hozható létre. A berillium-hipoklorit ismeretlen. A tiszta magnézium-hipoklorit nem állítható elő, azonban a szilárd Mg(OH)OCl ismert.[4]
Hevítéskor a hipoklorit kloridra, oxigénre és klorátra bomlik:
E reakció exoterm, és koncentrált hipokloritok esetén irányíthatatlanná, robbanásszerűvé válhat.[5]
Az alkálifém-hipokloritok stabilitása csökken a nagyobb alkálifémekkel. A vízmentes lítium-hipoklorit standard hőmérsékleten stabil, de a vízmentes nátrium-hipoklorit robban.[6] A pentahidrát (NaOCl·(H2O)5) 0 °C felett instabil,[7] de a háztartási fehérítők hígabb oldatai stabilabbak. A kálium-hipoklorit csak oldatban ismert.[4]
A lantanoida-hipokloritok instabilak, de arról számoltak be, hogy stabilabbak vízmentesen, mint víz jelenlétében.[8] A hipoklorit a Ce(III)-at Ce(IV)-gyé oxidálni.[9]
A vízmentes hipoklórossav nem stabil, mivel klórt alkotva bomlik. Bomlásakor bizonyos formában oxigén is keletkezik.
Reakciók ammóniával
[szerkesztés]A hipokloritok ammóniával reagálva előbb klóramint (ClNH2), majd diklóramint (Cl2NH), végül nitrogén-trikloridot (NCl3) adnak.[1]
Előállítás
[szerkesztés]Hipokloritsók
[szerkesztés]A hipokloritsók klór és alkáli- és alkáliföldfém-hidroxidok reakciójával keletkeznek. Ez 20-25 °C-on történik, hogy ne jöjjön létre klorát. Ezt gyakran használják nátrium- és kalcium-hipoklorit ipari előállítására.
Sok nátrium-hipokloritot állítanak elő elektrokémiai úton el nem választott klóralkáli-folyamattal. Ebben sós víz elektrolízisével keletkezik Cl2, mely vízben hipokloritot ad. Ez nem savas közegben folytatandó a klór felszabadulását megakadályozandó:
Egyes hipokloritok sómetatézissel is előállíthatók kalcium-hipoklorit és fém-szulfátok közt. E reakció vízben játszódik le, és az oldhatatlan, így kicsapódó kalcium-szulfát képződésén alapul:
Szerves hipokloritok
[szerkesztés]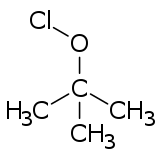
A hipokloritészterek általában a megfelelő alkoholokból állítható elő bizonyos reagensekkel (például klór, hipoklórossav, diklór-monoxid vagy savas hipokloritok) való kezeléssel.[3]
Biokémia
[szerkesztés]Szerves klórvegyületek bioszintézise
[szerkesztés]A kloroperoxidázok szerves vegyületek klórozását katalizáló enzimek. Ez a szervetlen kloridot és hidrogén-peroxidot egyesíti Cl+-ekvivalenst adva, mely a szubsztrát protonját cseréli le:
A „Cl+” forrása a hipoklórossav (HOCl).[11] Sok szerves klórvegyület bioszintézise történik így.
Immunválaszban
[szerkesztés]Fertőzésre válaszolva a humán neutrofil granulociták kevés hipokloritot állítanak elő.[12] Ezek vírusokat és baktériumokat kebeleznek be a fagoszómában, ahol azokat megemésztik.
Az emésztés része egy enzimmediált oxidálószer-termelés, mely során reaktív oxigénszármazékok, például az NADPH-oxidáz termelte szuperoxid keletkeznek. A szuperoxid oxigénné és a klorid hipoklorittá való mieloperoxidáz által katalizált alakításában felhasznált peroxiddá bomlik.[13][14][15]
Alacsony hipoklorit-koncentrációk a baktériumok hősokkproteinjeire hatnak, stimulálva sejten belüli chaperon szerepüket, a baktériumok összeállását okozva később elhaló csomókba.[16] E tanulmány alapján alacsony, μM-os hipokloritszintek az Escherichia coli és Vibrio cholerae védekezési mechanizmusát aktiválják, de ennek következményei nem tisztázottak.[16]
Ipari és háztartási használat
[szerkesztés]A hipokloritok, különösen a nátrium- és a kalcium-hipoklorit széles körben használhatók az iparban és a háztartásban egyaránt fehérítőként, hajvilágosításra és folteltávolításra. Ezek voltak az első forgalmazott fehérítők, nem sokkal azután, hogy e tulajdonságot Claude Berthollet 1785-ben felfedezte.
A hipokloritok széles spektrumú fertőtlenítőként és szagsemlegesítőként is használhatók. Ezen alkalmazás nem sokkal azután kezdődött, hogy Antoine Germain Labarraque ezt felfedezte 1820 körül – Louis Pasteur kórokozó-elmélete előtt.
Laboratóriumi használat
[szerkesztés]Oxidálószerként
[szerkesztés]A hipoklorit a klór-oxoanionok közül a legerősebb oxidálószer a félcella-standardpotenciálok összehasonlítása alapján; az adatok alapján a klór-oxoanionok savas közegben erősebb oxidálószerek.[17]
| Ion | Savas reakció | E° (V) | Semleges/lúgos reakció | E° (V) |
|---|---|---|---|---|
| Hipoklorit | 1,63 | 0,89 | ||
| Klorit | 1,64 | 0,78 | ||
| Klorát | 1,47 | 0,63 | ||
| Perklorát | 1,42 | 0,56 |
A hipoklorit elég erős oxidálószer a Mn(III) Mn(V)-té alakításához a Jacobsen-epoxidáció során és a Ce3+ Ce4+-gyé oxidálásához.[9] Ezen erős oxidációs képességért hatékony fehérítő és fertőtlenítő.
A szerves kémiában a hipokloritok primer alkoholok karbonsavvá oxidálásához használhatók.[18]
Klórozószerként
[szerkesztés]A hipokloritsók klórozószerként használhatók. Például a fenolokat klórfenolokká alakítja. A kalcium-hipoklorit a piperidint N-klórpiperidinné alakítja.
Kapcsolódó anionok
[szerkesztés]A klór −1, +1, +3, +5 vagy +7 oxidációs számú lehet anionokban (ezenkívül felvehet +4 oxidációs számot a klór-dioxidban).
| Klór oxidációs száma | −1 | +1 | +3 | +5 | +7 |
|---|---|---|---|---|---|
| Név | klorid | hipoklorit | klorit | klorát | perklorát |
| Képlet | Cl− | ClO− | ClO−2 | ClO−3 | ClO−4 |
| Szerkezet | 
|

|

|
Jegyzetek
[szerkesztés]- ↑ a b Greenwood, Norman N., Earnshaw, Alan. Chemistry of the Elements, 2nd, Butterworth-Heinemann (1997). ISBN 0-08-037941-9
- ↑ (2021) „After 200 Years: The Structure of Bleach and Characterization of Hypohalite Ions by Single-Crystal X-Ray Diffraction”. Angew. Chem. Int. Ed. 60 (46), 24400–24405. o. DOI:10.1002/anie.202108843. PMID 34293249.
- ↑ a b Mintz, M. J. (1969). „t-Butyl hypochlorite”. Organic Syntheses 49, 9. o. DOI:10.15227/orgsyn.049.0009.
- ↑ a b Egon Wiberg.szerk.: Bernhard J. Aylett, Nils Wiberg: Inorganic chemistry, 1st English ed. ford.: Mary Eagleson, William Brewer:, San Diego, Calif.; Berlin: Academic Press, W. de Gruyter, 444. o. (2001). ISBN 978-0123526519
- ↑ Clancey, V.J. (1975). „Fire hazards of calcium hypochlorite”. Journal of Hazardous Materials 1 (1), 83–94. o. DOI:10.1016/0304-3894(75)85015-1.
- ↑ Urben, Peter. Bretherick's Handbook of Reactive Chemical Hazards, 7th, 1433. o. (2006). ISBN 978-0-08-052340-8
- ↑ Brauer, G.. Handbook of Preparative Inorganic Chemistry; Vol. 1, 2nd, Academic Press, 309. o. (1963)
- ↑ Vickery, R. C. (1950. április 1.). „Some reactions of cerium and other rare earths with chlorine and hypochlorite”. Journal of the Society of Chemical Industry 69 (4), 122–125. o. DOI:10.1002/jctb.5000690411.
- ↑ a b V. R. Sastri. Modern Aspects of Rare Earths and their Complexes., 1st, Burlington: Elsevier, 38. o. (2003). ISBN 978-0080536682
- ↑ t-Butyl Hypochlorite, Encyclopedia of Reagents for Organic Synthesis. DOI: 10.1002/047084289X.rb388.pub2 (2006). ISBN 0471936235
- ↑ (2010) „New and classic families of secreted fungal heme peroxidases”. Appl Microbiol Biotechnol 87 (3), 871–897. o. DOI:10.1007/s00253-010-2633-0. PMID 20495915.
- ↑ (2014) „Taurine and inflammatory diseases”. Amino Acids 46 (1), 7–20. o. DOI:10.1007/s00726-012-1361-4. PMID 22810731.
- ↑ (1976) „Studies on the chlorinating activity of myeloperoxidase”. Journal of Biological Chemistry 251 (5), 1371–1374. o. DOI:10.1016/S0021-9258(17)33749-3. PMID 176150.
- ↑ Thomas, E. L. (1979). „Myeloperoxidase, hydrogen peroxide, chloride antimicrobial system: Nitrogen-chlorine derivatives of bacterial components in bactericidal action against Escherichia coli”. Infect. Immun. 23 (2), 522–531. o. DOI:10.1128/IAI.23.2.522-531.1979. PMID 217834.
- ↑ (1981. január 1.) „Biological reactivity of hypochlorous acid: implications for microbicidal mechanisms of leukocyte myeloperoxidase.”. Proceedings of the National Academy of Sciences of the United States of America 78 (1), 210–4. o. DOI:10.1073/pnas.78.1.210. PMID 6264434.
- ↑ a b Jakob, U. (2008. november 14.). „Bleach Activates A Redox-Regulated Chaperone by Oxidative Protein Unfolding”. Cell 135 (4), 691–701. o, Kiadó: Elsevier. DOI:10.1016/j.cell.2008.09.024. PMID 19013278.
- ↑ Sablon:Cotton&Wilkinson5th
- ↑ Organic Chemistry, 2nd, Oxford: Oxford University Press, 195. o. (2012). ISBN 978-0-19-927029-3
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a Hypochlorite című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.




















