Dioxigén-difluorid
| Dioxigén-difluorid | |||
 A dioxigén-difluorid pálcikamodellje |
 A dioxigén-difluorid kalotta-modellje | ||
| Szabályos név | fluorooxi-hipofluorit | ||
| Más nevek | monofluorooxigenil-hipofluorit difluor-dioxid | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| Rövidítés | FOOF | ||
| CAS-szám | 7783-44-0 | ||
| PubChem | 123257 | ||
| ChemSpider | 109870 | ||
| ChEBI | 47866 | ||
| |||
| |||
| InChIKey | REAOZOPEJGPVCB-UHFFFAOYSA-N | ||
| Gmelin | 1570 | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | O2F2 | ||
| Moláris tömeg | 69,996 g·mol−1 | ||
| Megjelenés | szilárd állapotban narancssárga | ||
| Sűrűség | 1,45 g/cm³ (forrásponton) | ||
| Olvadáspont | −154 °C | ||
| Forráspont | −57 °C (extrapolált) | ||
| Oldhatóság (egyéb oldószerekben) | bomlik | ||
| Termokémia | |||
| Std. képződési entalpia ΔfH |
19,2 kJ/mol | ||
| Standard moláris entrópia S |
277,2 J/mol K | ||
| Hőkapacitás, C | 62,1 J/mol K | ||
| Rokon vegyületek | |||
| Rokon vegyületek | O3F2 | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A dioxigén-difluorid a fluor és oxigén egyik vegyülete, képlete O2F2. Narancssárga szilárd anyag formájában létezik, mely −163 °C hőmérsékleten megolvadva vörös folyadékká alakul. Rendkívül erős oxidálószer, és már −160 °C-on is naponta 4%-a fluorra és oxigénre bomlik; élettartama szobahőmérsékleten rendkívül rövid.[1] Szinte minden anyaggal reagál, mellyel érintkezésbe kerül – még a vízjéggel is.
Gyakorlati alkalmazása nincs, de elméleti szempontból jelentős volt. Egyik laboratórium felhasználása plutónium-hexafluoridnak példátlanul alacsony hőmérsékleten történő szintézise volt, melynek jelentőségét az adta, hogy a korábbi módszerek olyan magas hőmérsékletet igényeltek, amelyen a plutónium-hexafluorid gyorsan elbomlott.[2]
Előállítása[szerkesztés]
Előállítható úgy, ha kisnyomású (optimálisan 7–17 mmHg) fluor- és oxigéngáz 1:1 arányú keverékét 25–30 mA erősségű, 2,1–2,4 kV-os elektromos kisülésnek teszik ki.[3] Otto Ruff is hasonló módszert használt 1933-ban a vegyület első szintéziséhez.[4] Egy másik eljárás szerint O2 és F2 keverékét rozsdamentes acél tartályban −196 °C-ra hűtik, majd az elemeket több órán át 3 MeV-os fékezési sugárzásnak teszik ki. Egy harmadik eljárásban fluor és oxigén keverékét 700 °C-ra hevítik, majd folyékony oxigénnel gyorsan lehűtik.[5] Mindegyik szintetikus módszer az alábbi egyenlettel írható le:
- O2 + F2 → O2F2
Az ózon-difluorid hőbomlása során is keletkezik:[6]
- O3F2 → O2F2 + ½ O2
Szerkezete és tulajdonságai[szerkesztés]
Az oxigén oxidációs száma a legtöbb vegyületben −2, ám az O2F2 molekulában oxidációs száma az igen ritka +1-es érték.
A molekula szerkezete – nagy, közelítőleg 90°-os diéderes szöge és C2 szimmetriája miatt – a hidrogén-peroxidra (H2O2) emlékeztet. Ez a geometria összhangban van a VETE elmélet által jósolttal.
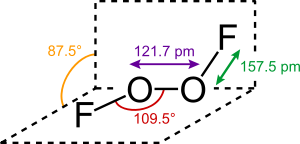
A molekula kötésrendszere sok találgatásra adott okot, különösen a nagyon rövid O−O és hosszú O−F kötéstávolságok miatt. Az O−O kötéstávolság 2 pm-en belül egyezik a dioxigénben (O2) található O=O kettős kötés 120,7 pm-es értékével. Több kötésrendszert is javasoltak ennek leírására, köztük O−O hármas kötést olyan destabilizált O–F egyszeres kötésekkel, melyek a fluoratomok magányos elektronpárjai és az O−O kötés π-pályái között fellépő taszítás hatására megnyúltak.[7] A fluormolekulában levő hosszú és gyenge kovalens kötésért is a fluor nemkötő elektronpárjai által keltett taszítás felelős. Számítógépes kémiai eredmények szerint a dioxigén-difluoridban az O−O kötés körüli elfordulás energiagátja rendkívül magas, 81,17 kJ/mol (a hidrogén-peroxidban 29,45 kJ/mol), ami közel van az O−F kötés 81,59 kJ/mol-os disszociációs energiájához.[8]
A dioxigén-difluoridban a 19F NMR kémiai eltolódása 865 ppm, messze a legnagyobb érték az összes fluorvegyület közül, ami megerősíti ennek a vegyületnek a különleges elektronszerkezeti sajátságait. Instabilitása ellenére a vegyület termokémiai adatai ismertek.[9]
Reakciókészsége[szerkesztés]
Könnyen oxigénre és fluorra bomlik. Már −160 °C hőmérsékleten naponta 4%-a elbomlik[1] az alábbi egyenlet szerint:
- O2F2 → O2 + F2
Másik fő tulajdonsága rendkívüli oxidáló ereje, noha minden reakcióját −100 °C körüli hőmérsékleten hajtják végre.[10] Több, ezen vegyülettel végzett kísérletsorozat is tűzeseteket vagy robbanásokat okozott. Néhány vegyület, mely O2F2-vel heves reakcióba lépett: etil-alkohol, metán, ammónia, sőt még a jég is.[10]
Bór-trifluoriddal (BF3) és foszfor-pentafluoriddal (PF5) a megfelelő dioxigenil sót adja:[1][11]
- 2 O2F2 + 2 PF5 → 2 [O2]+[PF6]− + F2
Jegyzetek[szerkesztés]
- ↑ a b c Holleman, A. F.. Inorganic Chemistry. Academic Press (2001). ISBN 0-12-352651-5
- ↑ (1984. április 25.) „Low temperature synthesis of plutonium hexafluoride using dioxygen difluoride”. Journal of the American Chemical Society 106 (9), 2726–2727. o. DOI:10.1021/ja00321a056.
- ↑ Kwasnik, W.. Dioxygen Difluoride, Handbook of Preparative Inorganic Chemistry, 2nd, NY: Academic Press, 162. o. (1963. április 25.)
- ↑ Ruff, O. (1933). „Neue Sauerstofffluoride: O2F2 und OF”. Zeitschrift für anorganische und allgemeine Chemie 211 (1–2), 204–208. o. DOI:10.1002/zaac.19332110122.
- ↑ Mills, Thomas (1991). „Direct synthesis of liquid-phase dioxygen difluoride”. Journal of Fluorine Chemistry 52 (3), 267–276. o. DOI:10.1016/S0022-1139(00)80341-3.
- ↑ Kirshenbaum, A. D. (1959). „Ozone Fluoride or Trioxygen Difluoride, O3F2”. Journal of the American Chemical Society 81 (6), 1277. o. DOI:10.1021/ja01515a003.
- ↑ Bridgeman, A. J. (1999). „Bonding in mixed halogen and hydrogen peroxides”. Journal of the Chemical Society, Dalton Transactions 1999 (22), 4077–4082. o. DOI:10.1039/a904968a.
- ↑ „Quantum Chemical Descriptions of FOOF: The Unsolved Problem of Predicting Its Equilibrium Geometry”. The Journal of Physical Chemistry A 105 (13), 3269–3276. o. DOI:10.1021/jp002852r.
- ↑ Lyman, John L. (1989). „Thermodynamic Properties of Dioxygen Difluoride (O2F2) and Dioxygen Fluoride (O2F)”, Kiadó: American Chemical Society and the American Institute of Physics for the National Institute of Standards and Technology. [2016. március 4-i dátummal az eredetiből archiválva]. (Hozzáférés: 2013. augusztus 5.)
- ↑ a b Streng, A. G. (1963). „The Chemical Properties of Dioxygen Difluoride”. Journal of the American Chemical Society 85 (10), 1380–1385. o. DOI:10.1021/ja00893a004.
- ↑ Solomon, Irvine J. (1964). „New Dioxygenyl Compounds”. Inorganic Chemistry 3 (3), 457. o. DOI:10.1021/ic50013a036.
Fordítás[szerkesztés]
Ez a szócikk részben vagy egészben a Dioxygen difluoride című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
További olvasnivalók[szerkesztés]
- Perfluoroperoxide in Linstrom, P.J.; Mallard, W.G. (eds.) NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD. http://webbook.nist.gov (angolul)
- D. Lowe: Things I Won't Work With: Dioxygen Difluoride. In the Pipeline. [2011. július 8-i dátummal az eredetiből archiválva]. (Hozzáférés: 2011. június 4.) (angolul)
