Gyök (kémia)



A gyökök olyan atomok, molekulák vagy ionok, amelyek egy vagy több párosítatlan vegyértékelektronnal rendelkeznek. A külső atompályán lévő, egyedülálló elektronok miatt igen nagy reakciókészséggel és rövid élettartammal bírnak.[1] A gyakorlatban a gyökök gyakran olyan oxigén-, nitrogén-, kén- vagy szénközpontú molekulákat, illetve molekularészleteket jelentenek, amelyek elektronszerzés céljából nagyon gyorsan kémiai reakcióba lépnek más vegyületekkel.[2] Ez a folyamat végeredményben ahhoz vezet, hogy a célmolekula szerkezetében és funkciójában változást okoznak.[3]
A kismértékben eltérő jelentésű szabad gyökök kifejezést jellemzően a biokémia területén használják, általában azokat a gyököket jelölik így, amelyek élettartama elég hosszú ahhoz, hogy az élő szervezet anyagaival reakcióba lépjenek. A szabad gyökök élő sejten kifejtett hatásainak jelentős élettani következményei lehetnek. Ennek során az élő szervezetben olyan redoxi kaszkádrendszert indítanak meg, amely károsíthatja a fehérjéket, a nukleinsavakat és a lipideket.[4] Károsító hatásukat azzal fejtik ki, hogy az adott szervezet ép sejtjeiből is igyekeznek elvonni a szükséges elektront. Sejtrongáló tevékenységük miatt sejtméregnek is nevezik a szabad gyököket.[5] Nevezetes példa a hidroxilgyök (HO•) molekulája, amely egy hidrogénnel kevesebbet tartalmaz a vízmolekulához képest, és az oxigénjéhez egy szabad vegyérték kapcsolódik.
- – gyökös bomlás
- – ionos bomlás
Felfedezésük[szerkesztés]
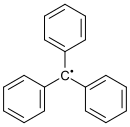
Faraday 1847-es közleménye is említést tesz létezésükről. Fenton 1894-ben közölte le, hogy bizonyos fémek jelenlétében a H2O2 hidroxilgyökök (OH•) képződését képes katalizálni. Az első beazonosított szerves szabad gyök a trifenil-metil-gyök volt, amelyet Moses Gomberg 1900-ban fedezett fel (University of Michigan, USA). Történelmileg a gyök kifejezést használták a molekula kötött részeinek kifejezésére, leírására, különösen, ha azok változatlanok maradtak a kémiai reakciókban. Ma ezeket funkciós csoportoknak nevezik.
Farmakológiai hatásaik[szerkesztés]
A szabad gyökök szerepének megértése nagy előrelépést jelentett az orvostudományban, és bizonyos betegségek esetében jelentősen megváltoztatta a kialakulásukkal és kezelésükkel kapcsolatos felfogást.[6] Szabad gyökök az élő szervezetben élettani körülmények között is keletkeznek, de bejuthatnak külső környezetből is, élelmiszerekkel (avasodás a legismertebb oxidációs folyamat), belégzéssel vagy bőrön keresztül. A káros szabad gyökök jelentős részét az emberi szervezet képes hatástalanítani. A védelmi mechanizmusok enzimes és nem enzimes elemek összefüggő rendszeréből állnak, ám ezek sok esetben elégtelenek. Számos tudományos felismerés igazolja a szabad gyökök közvetlen vagy közvetett hatását a szignáltranszdukcióra.[7] A szervezet redox-homeosztázisát bonyolult, érzékeny rendszer biztosítja, amelyben külső és belső tényezők egyaránt szerepet kapnak. Az élő szervezet működésének feltétele a szabad gyök–antioxidáns egyensúly, amely nélkülözhetetlen a sejtproliferáció és az apoptotikus sejtpusztulás szigorú szabályozásához.
Számos krónikus betegség kialakulásában jelentős szerepe van a szabad gyök–antioxidáns egyensúly eltolódásának, így pl.: daganatos betegségekben, immunrendszerrel kapcsolatos elváltozásokban, zsírmájban, epekőbetegségben, gyulladásos bélbetegségekben, vastagbélrákban.[8] Számos betegség patofiziológiájában feltételezik a szabad gyökök és az általuk okozott oxidatív stressz szerepét,[9] azonban e folyamatoknak pontosabb megismerése, annak eldöntése, hogy az oxidatív stressz oka vagy következménye az egyes betegségeknek, még nem teljesen tisztázott.[10] E betegségek lefolyása idején a természetes antioxidáns védekezés csökkenését mutatták ki. A kutatók felvetették, hogy a természetes antioxidáns anyagok pótlásával esetleg az oxidatív károsodás csökkenthető, és ezzel a betegségek előrehaladása késleltethető.[11]
Jegyzetek[szerkesztés]
- ↑ prof. dr. Dinya Zoltán: A flavonoidok bemutatása, alkalmazási területei. 3. old. jr. G.L. Bt. 2013.
- ↑ Cadenas, 1989.
- ↑ Kamikáze molekulák: A szabad gyökök befolyásolása a C-vitamintól a Viagráig SZABÓ CSABA - VII. szemeszter, 2005.09.26.
- ↑ (Pacifici et al., 1991)
- ↑ Dr. Juhász Miklós. Szabad gyökök és antioxidánsok – a legjobb antioxidáns növények. Szeged: SZTE Növénybiológiai Tanszék (2012. december)
- ↑ Kamikáze molekulák: A szabad gyökök befolyásolása a C-vitamintól a Viagráig ENG SZABÓ CSABA - VII. szemeszter, 2005.09.26.
- ↑ (McKenzie 1996, Pavlick 2002, Ramachandiran 2002)
- ↑ MTA Doktora Pályázat Doktori Értekezés: A redox–homeosztázis változása és az antioxidánsok jelentősége máj- és bélbetegségekben, Dr. Blázovics Anna Budapest, 2005
- ↑ Fehér J, Vereckei A. szabad gyök reakciók jelentősége az orvostudományban. Medicina, Biogal, Budapest, 1985
- ↑ Halliwell B. Free radicals, antioxidants and human disease: curiosity, cause, or consequence? Lancet 344, 721-724, 1994
- ↑ Maxwell S. Prospects for the use of antioxidant therapies. Drugs 49(3), 345-361, 1995
További információk[szerkesztés]
- Gupta VK, Sharma SK. Plants as natural antioxidants. Natural Product Radiance 2006; 5(4): 326-334.
- Prakash A, Rigelhof F, Miller E. Antioxidant activity. http://www.medlabs.com/Downloads/Antiox_acti_.pdf
- Halliwell B. Free radicals and antioxidants: updating a personal view. Nutr Rev 2012; 70(5): 257-65.
- ASMUS K. D., BONIFACIC M. (2000): Free radical chemistry. In: Handbook of Oxidants and Antioxidants in Exercise. Sen C.K., Packer L., Hänninen O.P. (eds.), Elsevier


