„Keton” változatai közötti eltérés
| [ellenőrzött változat] | [ellenőrzött változat] |
nowiki off Címke: 2017-es forrásszöveg-szerkesztő |
→Jegyzetek: Törlésre váró sablon eltávolítása:, removed: {{Oxigéntartalmú szerves vegyületek}} AWB |
||
| 22. sor: | 22. sor: | ||
{{jegyzetek}} |
{{jegyzetek}} |
||
{{Oxigéntartalmú szerves vegyületek}} |
|||
{{Nemzetközi katalógusok}} |
{{Nemzetközi katalógusok}} |
||
{{portál|kémia}} |
{{portál|kémia}} |
||
A lap jelenlegi, 2020. november 12., 14:25-kori változata
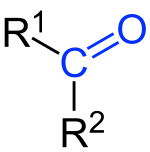

A ketonok oxocsoportot (═O) tartalmazó, oxigéntartalmú szerves vegyületek, melyeknél a funkciós csoport egy láncközi vagy gyűrűs C-atomhoz kapcsolódik. Általános képletük: R1–CO–R2. A képletben szereplő R1, R2 láncokat a keton oldalláncainak nevezzük.
Szabályos nevüket a megfelelő szénhidrogénlánc nevének végéhez illesztett -on végződéssel jelöljük. Az -on végződés előtt feltüntetjük annak a szénatomnak a számát, amelyhez az oxocsoport kapcsolódik. Így az aceton (CH3–CO–CH3) szabályos, kémiai nómenklatúra szerinti neve propán-2-on. Egyes ketonok régies neve is használatos.
A ketonok legegyszerűbb képviselője az aceton. Innen a neve is a német Aketone rövidítéséből.[1]
Fizikai tulajdonságok[szerkesztés]
A kisebb- és közepes szénatomszámú ketonok jellegzetes, az éterekéhez hasonló szagú folyadékok. Forráspontjuk az alkoholokénál és a karbonsavakénál alacsonyabb, mivel nem képesek hidrogén-híd kialakítására, viszont a szénhidrogénekénél magasabb, mivel a poláris molekulák dipól-dipól kölcsönhatásba léphetnek egymással. A kis szénatomszámú ketonok jól oldódnak vízben, a szénatomszám növekedésével az oldhatóság egyre csökken, az ötös szénatomszámú ketonok már vízben gyakorlatilag nem oldódnak. Az összes keton jól oldódik alkoholban és éterben.
Kémiai tulajdonságok[szerkesztés]
A ketonok oldalláncai jellegük szerint szubsztitúciós, addíciós, vagy egyéb reakciókban vehetnek részt.
A ketonok az aldehidekkel ellentétben enyhe oxidációs hatásra nem oxidálódnak, így nem adják sem az ezüsttükör-, sem a Fehling-próbát. Megfelelően erős oxidációs hatásra (pl. HNO3) azonban lánchasadás mellett oxidálhatók, ekkor különféle szénatomszámú karbonsavak keletkeznek.
Előállításuk[szerkesztés]
A ketonok előállítása a nekik megfelelő szekunder alkohol oxidációjával történhet. Előállíthatók továbbá a megfelelő karbonsavak kalciumsóinak hevítésével is.
Jegyzetek[szerkesztés]
- ↑ Fülöp József: Rövid kémiai értelmező és etimológiai szótár. Celldömölk: Pauz–Westermann Könyvkiadó Kft. 1998. 78. o. ISBN 963 8334 96 7
