Hidrazonok
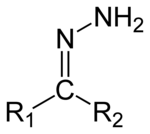
A hidrazonok olyan szerves vegyületek, melyekben R1R2C=NNH2 funkciós csoport található.[1] A ketonok és aldehidek olyan származékainak tekinthetők, melyekben az oxigénatomot NNH2 funkciós csoport helyettesíti. Többnyire hidrazin és ketonok vagy aldehidek reakciójában keletkeznek.[2][3]
Felhasználásuk[szerkesztés]
Az aromás hidrazonszármazékok keletkezését a kis molekulatömegű aldehidek és ketonok koncentrációjának – például gázáramból történő – méréséhez használják fel. A szilika hordozóra bevonatként felvitt dinitrofenilhidrazin például egy ilyen adszorpciós rendszer alapja. A keletkezett hidrazonokat ezután lemossák és UV-detektálású HPLC-vel analizálják.
A karbonil-cianid-p-(trifluor-metoxi)-fenil-hidrazont (rövidítve FCCP) a molekuláris biológiában az ATP szintézis és az oxigén oxidatív foszforilációval történő redukciójának szétkapcsolására használják. A fenilhidrazin glükózzal reagálva oszazont képez. Az orvosi biotechnológiában hidrazon alapú kapcsolási reakciókkal kötik a gyógyszermolekulát a megcélzott – például bizonyos ráksejt elleni – antitesthez. A hidrazon alapú kötés semleges pH-n (a vérben) stabil, de a sejtek lizoszómájának savas környezetében gyorsan felbomlik. A gyógyszermolekula így a sejt belsejében szabadul fel, ahol kifejti hatását.[4]
Vizes oldatban az alifás hidrazonok 102–103-szor érzékenyebbek a hidrolízisre, mint az analóg oximok.[5]
Reakcióik[szerkesztés]
A hidrazonok reaktánsként vesznek részt a vinilvegyületet eredményező hidrazon jódozás, Shapiro-, valamint Bamford–Stevens-reakciókban. A Kizsnyer–Wolff-redukció hidrazon köztiterméken keresztül játszódik le. Hidrazonokat Japp–Klingemann-reakcióval is lehet szintetizálni β-keto-savakból vagy β-keto-észterekből és aril-diazóniumsókból. A közelmúltban – környezetbarát – mechanokémiai eljárással szintetizáltak gyógyszerészetileg ígéretes fenol-hidrazonokat.[6] A hidrazonokat azinokká alakítják, ha 3,5-diszubsztituált 1H-pirazolok előállítása a cél,[7] ez a reakció hidrazin-hidráttal végezve is jól ismert.[8][9]
N,N′-dialkilhidrazonok[szerkesztés]
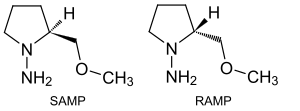
Az N,N′-dialkilhidrazonokban[10] a C=N kötés hidrolizálható, oxidálható vagy redukálható, az N-N kötés pedig szabad aminná redukálható. A C=N kötés szénatomja reakcióba léphet fémorganikus nukleofilekkel. Az alfa hidrogénatom 10 nagyságrenddel savasabb, mint a ketonban, ezért erősebb nukleofil. Ha deprotonálják, például lítium-diizopropilamiddal, akkor azaenolát keletkezik, mely alkil-halogenidekkel alkilezhető – ezt a reakciót Elias James Corey és Dieter Enders fejlesztette ki 1978-ban.[11][12] Az aszimmetriás szintézisekben a SAMP és RAMP királis hidrazin segédanyagok aszimmetrikusan hatnak a királis hidrazon köztitermékre.[13][14][15]
Galéria[szerkesztés]
- Hidrazonok
-
Jellemző példa hidrazonra: benzofenon-hidrazon
-
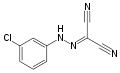
Karbonil-cianid-m-klór-fenil-hidrazon
-
Giromitrin (acetaldehid metilformil-hidrazon), toxin
-
Dihidralazin, vérnyomáscsökkentő hatóanyag
Jegyzetek[szerkesztés]
- ↑ March, Jerry (1985), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (3rd ed.), New York: Wiley, ISBN 0-471-85472-7
- ↑ (1977) „Monoalkylation of α,β-Unsaturated Ketones via Metalloenamines: 1-butyl-10-methyl-Δ1(9)-2-octalone”. Org. Synth. 57, 69. o. ; Coll. Vol. 6: 242
- ↑ (1970) „Acetone hydrazone”. Org. Synth. 50, 3. o. ; Coll. Vol. 6: 10
- ↑ (2005. szeptember 7.) „Arming antibodies: prospects and challenges for immunoconjugates”. Nature Biotechnology 23 (9), 1137–46. o. DOI:10.1038/nbt1141. PMID 16151407.
- ↑ (2008) „Hydrolytic stability of hydrazones and oximes”. Angew. Chem. Int. Ed. 47 (39), 7523–6. o. DOI:10.1002/anie.200802651. PMID 18712739.
- ↑ (2014) „Solvent-free mechanochemical route for green synthesis of pharmaceutically attractive phenol-hydrazones”. RSC Adv. 4 (100), 56736–56742. o. DOI:10.1039/c4ra10489g.
- ↑ Lasri, Jamal (2018). „Metal-free and FeCl3-catalyzed synthesis of azines and 3,5-diphenyl-1H-pyrazole from hydrazones and/or ketones monitored by high resolution ESI+-MS”. Indian Journal of Chemistry, Section B 57B (3), 362–373. o.
- ↑ (2008) „New one step synthesis of 3,5-disubstituted pyrazoles under microwave irradiation and classical heating”. Journal of Heterocyclic Chemistry 45 (2), 503–505. o. DOI:10.1002/jhet.5570450231.
- ↑ (2014) „One-pot synthesis of 3,5-diphenyl-1H-pyrazoles from chalcones and hydrazine under mechanochemical ball milling”. Heterocycles 89 (1), 103–112. o. DOI:10.3987/COM-13-12867.
- ↑ (2010) „N,N-dialkylhydrazones in organic synthesis. From simple N,N-dimethylhydrazones to supported chiral auxiliaries”. Chemical Reviews 110 (3), 1386–1434. o. DOI:10.1021/cr900067y. PMID 20000672.
- ↑ (1976) „Applications of N,N-dimethylhydrazones to synthesis. Use in efficient, positionally and stereochemically selective C_C bond formation; oxidative hydrolysis to carbonyl compounds”. Tetrahedron Letters 17 (1), 3. o. DOI:10.1016/S0040-4039(00)71307-4.
- ↑ (1978) „Herstellung und synthetische Verwendung von metallierten Dimethylhydrazonen Regio- und stereoselektive Alkylierung von Carbonylverbindungen”. Chemische Berichte 111 (4), 1337–1361. o. DOI:10.1002/cber.19781110413.
- ↑ (1977) „Enantioselective alkylation of aldehydes via metalated chiral hydrazones”. Tetrahedron Letters 18 (23), 191–194. o. DOI:10.1016/S0040-4039(01)92585-7.
- ↑ (1987) „(S)-(−)-1-Amino-2-methoxymethylpyrrolidine (SAMP) and (R)-(+)-1-amino-2-methoxymethylpyrrolidine (RAMP), versatile chiral auxiliaries”. Org. Synth. 65, 173. o. ; Coll. Vol. 8: 26
- ↑ (1987) „Asymmetric syntheses using the SAMP-/RAMP-hydrazone method: (S)-(+)-4-methyl-3-heptanone”. Org. Synth. 65, 183. o. ; Coll. Vol. 8: 403
Fordítás[szerkesztés]
Ez a szócikk részben vagy egészben a Hydrazone című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.