„Guillain–Barré-szindróma” változatai közötti eltérés
| [nem ellenőrzött változat] | [nem ellenőrzött változat] |
Syp (vitalap | szerkesztései) a Szindrómák kategória hozzáadva (a HotCattel) |
Hivatkozások, külső linkek, további olvasnivalók hozzáadása, hiányzó hivatkozásokra figyelmeztető doboz törlése |
||
| 1. sor: | 1. sor: | ||
{{nincs forrás}} |
|||
[[Fájl:Spirodoc FVC.jpg|alt= Kézi spirométer, grafikus kijelzővel, amivel előrejelezhetőek a légzési nehézségek|thumb|Kézi spirométer, grafikus kijelzővel, amivel előrejelezhetőek a légzési nehézségek]] |
[[Fájl:Spirodoc FVC.jpg|alt= Kézi spirométer, grafikus kijelzővel, amivel előrejelezhetőek a légzési nehézségek|thumb|Kézi spirométer, grafikus kijelzővel, amivel előrejelezhetőek a légzési nehézségek]] |
||
'''Guillain–Barré-szindróma (GBS)''', néha '''Guillain–Barré–Strohl-szindróma''' vagy '''Landry-típusú bénulás''' egy gyorsan rosszabodó több ideget érintő károsodás (polineuropátia), amit típusosan az alsó végtagokban kezdődő felszálló jellegű, szimmetrikus végtaggyengeség és zsibbadás jellemez. A betegség érinti a [[Idegrendszer|perifériás idegrendszert]] és jellemzően valamilyen fertőzés hatására alakul, ami előidézi az immunmediált idegek hibás működését. Az érintettek közül sokan észlelnek érzékelésbeli változást vagy számolnak be fájdalom kialakulásáról majd ezt követően a lábakat, később a kezeket érintő izomgyengeségről, ami gyorsan kifejlődik (fél és két nap között). A Guillain–Barré-szindróma károsítja a perifériás idegeket körülvevő mielint, aminek eredményeképp az idegi impulzusok átvitele megszakad, hasonlóan, mint a [[Sclerosis multiplex|sclerosis multiplex]] esetében. Az akut fázis során, a betegség életveszélyessé is válhat, körülbelül a betegek negyede igényel intenzív osztályi ellátást, gépi lélegeztetést a légzés mesterséges fenntartása miatt. Néhány betegnél előfordulhat az [[autonóm idegrendszer]] működésbeli hullámzása, ami veszélyes, abnormális szívveréshez és [[vérnyomás|vérnyomáshoz]] vezethet. |
'''Guillain–Barré-szindróma (GBS)''', néha '''Guillain–Barré–Strohl-szindróma''' vagy '''Landry-típusú bénulás''' egy gyorsan rosszabodó több ideget érintő károsodás (polineuropátia), amit típusosan az alsó végtagokban kezdődő felszálló jellegű, szimmetrikus végtaggyengeség és zsibbadás jellemez. A betegség érinti a [[Idegrendszer|perifériás idegrendszert]] és jellemzően valamilyen fertőzés hatására alakul, ami előidézi az immunmediált idegek hibás működését. Az érintettek közül sokan észlelnek érzékelésbeli változást vagy számolnak be fájdalom kialakulásáról majd ezt követően a lábakat, később a kezeket érintő izomgyengeségről, ami gyorsan kifejlődik (fél és két nap között). A Guillain–Barré-szindróma károsítja a perifériás idegeket körülvevő mielint, aminek eredményeképp az idegi impulzusok átvitele megszakad, hasonlóan, mint a [[Sclerosis multiplex|sclerosis multiplex]] esetében. Az akut fázis során, a betegség életveszélyessé is válhat, körülbelül a betegek negyede igényel intenzív osztályi ellátást, gépi lélegeztetést a légzés mesterséges fenntartása miatt. Néhány betegnél előfordulhat az [[autonóm idegrendszer]] működésbeli hullámzása, ami veszélyes, abnormális szívveréshez és [[vérnyomás|vérnyomáshoz]] vezethet. |
||
| 7. sor: | 5. sor: | ||
==Tünetei== |
==Tünetei== |
||
| ⚫ | A betegség első tünetei a zsibbadás és bizsergő érzés, izomgyengeség és [[fájdalom]]. Ezek külön-külön, együtt vagy valamilyen kombinációban is jelentkezhetnek. Ezt követően jelenik meg az alsó végtagok és a karok szimmetrikus gyengesége, ami idővel fokozódik. Az izomgyengeség maximális súlyosságának elérése fél nap és két hét között ingadozhat, ezt követően állandósul. Ötből egy embernél az izomgyengeség tovább folytatódik egészen négy hétig. A nyak izmai szintén érintettek lehetnek, és körülbelül a betegek felénél a fej mozgatásáért és az arcizmokért felelősek agyidegek is érintettek. Emiatt előfordulhat arcizom-gyengeség, nyelési nehézség és néha a szemmozgató izmok gyengesége is. Az esetek 8%-ban az izomgyengeség csak a lábakat érinti. A húgyhólyagért és a végbélnyílásért felelős izmok érintettsége nem jellemző. Az összes Guillain–Baré-szindróma által sújtott ember harmada nem veszíti el később se a járás képességét. Amikortól az izomgyengeség nem fokozódik tovább, beáll egy stabil állapot (remisszió) mielőtt javulás lenne észrevehető. A remisszió két naptól hat hónapig tarthat, azonban a medián időtartam |
||
| ⚫ | A betegség első tünetei a zsibbadás és bizsergő érzés, izomgyengeség és [[fájdalom]]. Ezek külön-külön, együtt vagy valamilyen kombinációban is jelentkezhetnek.<!--NEJM2012--> Ezt követően jelenik meg az alsó végtagok és a karok szimmetrikus gyengesége, ami idővel fokozódik.<ref name=NEJM2012>{{cite journal|last1=Yuki|first1=Nobuhiro|last2=Hartung|first2=Hans-Peter|title=Guillain–Barré Syndrome|journal=New England Journal of Medicine|date=14 June 2012|volume=366|issue=24|pages=2294–2304|doi=10.1056/NEJMra1114525|pmid=22694000}}</ref> Az izomgyengeség maximális súlyosságának elérése fél nap és két hét között ingadozhat, ezt követően állandósul.<ref name=NEJM2012/> Ötből egy embernél az izomgyengeség tovább folytatódik egészen négy hétig.<ref name=NatRevNeurol2014/> A nyak izmai szintén érintettek lehetnek, és körülbelül a betegek felénél a fej mozgatásáért és az arcizmokért felelősek agyidegek is érintettek. Emiatt előfordulhat arcizom-gyengeség, nyelési nehézség és néha a szemmozgató izmok gyengesége is.<ref name=NatRevNeurol2014>{{cite journal | last1=van den Berg | first1=Bianca | last2=Walgaard | first2=Christa | last3=Drenthen | first3=Judith | last4=Fokke | first4=Christiaan | last5=Jacobs | first5=Bart C. | last6=van Doorn | first6=Pieter A. | title=Guillain–Barré syndrome: pathogenesis, diagnosis, treatment and prognosis | journal=Nature Reviews Neurology | date=15 July 2014 | volume=10 | issue=8 | pages=469–482 | doi=10.1038/nrneurol.2014.121 | pmid=25023340 }}</ref> Az esetek 8%-ban az izomgyengeség csak a lábakat érinti.<ref name=NatRevNeurol2014/> A húgyhólyagért és a végbélnyílásért felelős izmok érintettsége nem jellemző.<ref name=NEJM2012/> Az összes Guillain–Baré-szindróma által sújtott ember harmada nem veszíti el később se a járás képességét. Amikortól az izomgyengeség nem fokozódik tovább, beáll egy stabil állapot (remisszió) mielőtt javulás lenne észrevehető. A remisszió két naptól hat hónapig tarthat, azonban a medián időtartam egy hét.<ref name=NatRevNeurol2014/> Fájdalommal kapcsolatos tünetei az emberek több, mint felének vannak, beleértve a hátfájdalmakat, fájdalmas bizsergés érzését, izomfájdalmat és a fejjel és nyakkal kapcsolatos fájdalmakat, amik az agyhártya gyulladáshoz kapcsolhatóak.<ref name=NatRevNeurol2014/> |
||
| ⚫ | |||
| ⚫ | |||
Gyermekeknél, különösen a hat éves kornál fiatalabbaknál, a diagnózis megállapítás nehézkes lehet és a fájdalommal és a nehézkes járással kapcsolatos panaszok is az elején gyakran félrevezetőek és más kiváltó okot feltételeznek, mint vírusos fertőzés vagy ízületi és csont problémák. |
Gyermekeknél, különösen a hat éves kornál fiatalabbaknál, a diagnózis megállapítás nehézkes lehet és a fájdalommal és a nehézkes járással kapcsolatos panaszok is az elején gyakran félrevezetőek és más kiváltó okot feltételeznek, mint vírusos fertőzés<ref name=NatRevNeurol2014/> vagy ízületi és csont problémák.<ref name=Ryan2013>{{cite journal|last1=Ryan|first1=Monique M.|title=Pediatric Guillain-Barré syndrome|journal=Current Opinion in Pediatrics|date=December 2013|volume=25|issue=6|pages=689–693|doi=10.1097/MOP.0b013e328365ad3f|pmid=24240288}}</ref> |
||
A neurológia vizsgálat során a betegség tipikus jellemzői a csökkent izomerő és a csökkent vagy teljesen hiányzó saját reflex. Azonban az emberek egy kis csoportjánál, mielőtt teljes reflexhiány lépne fel az érintett végtagokban a reflex normális, sőt néhányuknál a reflexek még fokozódtak is. A Guillain–Barré-szindróma Miller Fisher féle szubtípusánál a szemizom-gyengeség markánsabban jelenik meg és ami mellett koordinációs problémával (ataxia) is előfordulhat. Az öntudat normál esetben nincs érintve a Guillain–Barré-szindrómánál, azonban a "Bickerstaff-féle agyvelőgyulladás" szubtípus esetén előfordulhat aluszékonyság, álmosság vagy akár kóma is. |
A neurológia vizsgálat során a betegség tipikus jellemzői a csökkent izomerő és a csökkent vagy teljesen hiányzó saját reflex. Azonban az emberek egy kis csoportjánál, mielőtt teljes reflexhiány lépne fel az érintett végtagokban a reflex normális, sőt néhányuknál a reflexek még fokozódtak is.<ref name=NatRevNeurol2014/> A Guillain–Barré-szindróma Miller Fisher féle szubtípusánál a szemizom-gyengeség markánsabban jelenik meg és ami mellett koordinációs problémával (ataxia) is előfordulhat.<ref name=NEJM2012/> Az öntudat normál esetben nincs érintve a Guillain–Barré-szindrómánál, azonban a "Bickerstaff-féle agyvelőgyulladás" szubtípus esetén előfordulhat aluszékonyság, álmosság vagy akár kóma is.<ref name=vanDoorn2008/><ref name=Shahrizaila2013>{{cite journal|last1=Shahrizaila|first1=N.|last2=Yuki|first2=N.|title=Bickerstaff brainstem encephalitis and Fisher syndrome: anti-GQ1b antibody syndrome|journal=Journal of Neurology, Neurosurgery & Psychiatry|date=15 September 2012|volume=84|issue=5|pages=576–583|doi=10.1136/jnnp-2012-302824|pmid=22984203}}</ref> |
||
===Légzési elégtelenség=== |
===Légzési elégtelenség=== |
||
A betegség által érintett emberek 25%-nál fejlődik ki a légzőizmok gyengesége, ami aztán légzési elégtelenséghez vezet, ami miatt a szervezet nem tudja fenntartatni a vérben az egészséges oxigén és/vagy széndioxid szintet. Emiatt szükség lehet intubációra és a légzés mesterséges támogatására lélegeztető gép segítségével, ez általában intenzív osztályon történik. A lélegeztető gép szükségessége előre jelezhető két légzésteszttel: erőltetett vitálkapacitás (FVC) és negatív belégzési erő (NIF). Amennyiben az FVC értéke kevesebb, mint 15 ml per testtömeg kilogramm vagy az NIF értéke kevesebb, mint 60 cmH2O akkor ezek súlyos légzési elégtelenségre utalnak. Azon emberek 60%-nál, akiknek lélegeztetőgépre van szükségük, ez az életveszélyes helyzet tovább komplikálódik egyéb egészségügyi problémával is, mint például tüdőgyulladás, súlyos fertőzések, tüdőembólia és az emésztőrendszer vérzése. |
A betegség által érintett emberek 25%-nál fejlődik ki a légzőizmok gyengesége, ami aztán légzési elégtelenséghez vezet, ami miatt a szervezet nem tudja fenntartatni a vérben az egészséges oxigén és/vagy széndioxid szintet.<ref name=NEJM2012/><ref name=NatRevNeurol2014/><ref name=vanDoorn2010>{{cite journal | author=van Doorn PA, Kuitwaard K, Walgaard C ''et al'' | title=IVIG treatment and prognosis in Guillain-Barré syndrome | journal=Journal of Clinical Immunology | date=May 2010 | volume=30 Suppl 1 | pages=S74–8 | doi=10.1007/s10875-010-9407-4 | pmid=20396937 | pmc=2883091}}</ref> Emiatt szükség lehet intubációra és a légzés mesterséges támogatására lélegeztető gép segítségével, ez általában intenzív osztályon történik. A lélegeztető gép szükségessége előre jelezhető két légzésteszttel: erőltetett vitálkapacitás (FVC) és negatív belégzési erő (NIF). Amennyiben az FVC értéke kevesebb, mint 15 ml per testtömeg kilogramm vagy az NIF értéke kevesebb, mint 60 cmH2O akkor ezek súlyos légzési elégtelenségre utalnak.<ref name=Dimachkie2013>{{cite journal|author=Dimachkie MM, Barohn RJ|title=Guillain-Barré syndrome and variants|journal=Neurology Clinics|date=May 2013|volume=31|issue=2|pages=491-510|pmid=23642721|pmc=3939842|doi=10.1016/j.ncl.2013.01.005}}</ref> Azon emberek 60%-nál, akiknek lélegeztetőgépre van szükségük, ez az életveszélyes helyzet tovább komplikálódik egyéb egészségügyi problémával is, mint például tüdőgyulladás, súlyos fertőzések, tüdőembólia és az emésztőrendszer vérzése.<ref name=NEJM2012/> |
||
===Az autonóm idegrendszer hibás működése=== |
===Az autonóm idegrendszer hibás működése=== |
||
Az autonóm idegrendszer szabályozza a szervezet belső környezetét tehát felel a pulzusért és a vérnyomás fenntartásáért is. A Guillain–Barré-szindrómában szenvedő emberek kétharmadánál a betegség erre is hatással van, azonban ennek hatás az egyes embereknél változó. Húsz százalékuknál tapasztalható súlyosan ingadozó vérnyomás és rendszertelen szívverés, amely akár addig is súlyosbodhat, hogy megáll a szívverés és [[szívritmus-szabályozó|szívritmus-szabályozót]] kell |
Az autonóm idegrendszer szabályozza a szervezet belső környezetét tehát felel a pulzusért és a vérnyomás fenntartásáért is. A Guillain–Barré-szindrómában szenvedő emberek kétharmadánál a betegség erre is hatással van, azonban ennek hatás az egyes embereknél változó.<ref name=NatRevNeurol2014/> Húsz százalékuknál tapasztalható súlyosan ingadozó vérnyomás és rendszertelen szívverés, amely akár addig is súlyosbodhat, hogy megáll a szívverés és [[szívritmus-szabályozó|szívritmus-szabályozót]] kell alkalmazni.<ref name=NEJM2012/> Egyéb, kapcsolódó problémák még az abnormális verejtékezés és a [[pupilla|pupilla reflex]] megváltozása.<ref name=vanDoorn2008>{{cite journal|last1=van Doorn|first1=Pieter A|last2=Ruts|first2=Liselotte|last3=Jacobs|first3=Bart C|title=Clinical features, pathogenesis, and treatment of Guillain-Barré syndrome|journal=The Lancet Neurology|date=October 2008|volume=7|issue=10|pages=939–950|doi=10.1016/S1474-4422(08)70215-1|pmid=18848313}}</ref> Az autonóm idegrendszer hibás működése még azokat is érinthet, akiknél nem jelentkezik súlyos izomgyengeség.<ref name=vanDoorn2008/> |
||
==Okok== |
==Okok== |
||
[[Fájl:ARS Campylobacter jejuni.jpg|alt= A Campylobacter jejuni pásztázó elektronmikroszkópos képe, ami a Guillain–Barré-szindróma kiváltásának 30%-ért felelős.|thumb|A ''Campylobacter jejuni'' [[pásztázó elektronmikroszkóp|pásztázó elektronmikroszkópos]] képe, ami a Guillain–Barré-szindróma kiváltásának 30%-ért felelős.]] |
[[Fájl:ARS Campylobacter jejuni.jpg|alt= A Campylobacter jejuni pásztázó elektronmikroszkópos képe, ami a Guillain–Barré-szindróma kiváltásának 30%-ért felelős.|thumb|A ''Campylobacter jejuni'' [[pásztázó elektronmikroszkóp|pásztázó elektronmikroszkópos]] képe, ami a Guillain–Barré-szindróma kiváltásának 30%-ért felelős.]] |
||
| ⚫ | A Guillain-Barré szindrómában szenvedő emberek kétharmada tapasztalt fertőzést a betegség panaszainak megjelenése előtt. Ezek a fertőzések leginkább emésztőrendszeri és légzőszervet érintőek voltak. Sok esetben a pontos fertőzés is megállapítható volt. Megközelítőleg az esetek 30%-ban a [[Campylobacteriosis|Campylobacter jejuni]] volt a kiváltó ok, ami hasmenést okoz. Az esetek további 10%-a citomegalovírusoknak (CMV, HHV-5) tulajdonítható. Mindezek ellenére, csak néhány olyan embernél fejlődik ki Guillain–Barré-szindróma, akik ''Campylobacter''-rel vagy CMV-vel fertőződtek (0,25-0,65 per 1000 eset és 0,6-2,2 per 1000 |
||
| ⚫ | A Guillain-Barré szindrómában szenvedő emberek kétharmada tapasztalt fertőzést a betegség panaszainak megjelenése előtt. Ezek a fertőzések leginkább emésztőrendszeri és légzőszervet érintőek voltak. Sok esetben a pontos fertőzés is megállapítható volt.<ref name=NatRevNeurol2014/> Megközelítőleg az esetek 30%-ban a [[Campylobacteriosis|Campylobacter jejuni]] volt a kiváltó ok, ami hasmenést okoz. Az esetek további 10%-a citomegalovírusoknak (CMV, HHV-5) tulajdonítható. Mindezek ellenére, csak néhány olyan embernél fejlődik ki Guillain–Barré-szindróma, akik ''Campylobacter''-rel vagy CMV-vel fertőződtek (0,25-0,65 per 1000 eset és 0,6-2,2 per 1000 epizód, külön-külön).<ref name=NEJM2012/> Az érintett Campylobacter törzstől függhet a GBS kockázata. A baktérium különböző formáinak a felszínén különböző lipopoliszacharidok találhatóak és amíg néhányuk kiválthatja a betegséget, mások nem váltják ki.<ref name=NatRevNeurol2014/> |
||
| ⚫ | A GBS és más fertőzések kapcsolata jóval bizonytalanabb. Két másik herpeszvírus ([[Epstein–Barr-vírus|Epstein-Barr vírus]]/HHV-4 és varicella zoster vírus/HHV-3) és a Mycoplasma pneumoniae baktérium összefüggésbe hozható a GBS-szel. A trópusi vírusfertőzés a [[Dengue-láz]] szintén kapcsolatba hozható a GBS bizonyos eseteivel. A Guillain–Barré-szindrómás embereknél jóval gyakrabban állapítottak meg hepatitisz E vírusfertőzést előzőleg. |
||
| ⚫ | A GBS és más fertőzések kapcsolata jóval bizonytalanabb. Két másik herpeszvírus ([[Epstein–Barr-vírus|Epstein-Barr vírus]]/HHV-4 és varicella zoster vírus/HHV-3) és a Mycoplasma pneumoniae baktérium összefüggésbe hozható a GBS-szel.<ref name=NEJM2012/> A trópusi vírusfertőzés a [[Dengue-láz]] szintén kapcsolatba hozható a GBS bizonyos eseteivel.<ref name="Carod2013">{{cite journal|author=Carod-Artal FJ, Wichmann O, Farrar J, Gascón J|title=Neurological complications of dengue virus infection|journal=The Lancet Neurology|volume=12|issue=9|pages=906-19|date=September 2013|pmid=23948177| doi=10.1016/S1474-4422(13)70150-9}}</ref> A Guillain–Barré-szindrómás embereknél jóval gyakrabban állapítottak meg hepatitisz E vírusfertőzést előzőleg.<ref name=NatRevNeurol2014/> |
||
| ⚫ | Néhány esetet kiválthatott influenza vírus és influenza oltás. 1976-os sertésinfluenza járvány utáni influenza immunizációt követően megnövekedett a Guillain–Barré-szindrómás betegek száma. 1 000 000 beoltott között 8,8-nál fejlődött ki a betegség. Azóta, a vakcinációnak tulajdonítható esetek közeli megfigyelése bebizonyította, hogy az influenza maga is képes GBS-t okozni. Az esetek kisszámú megnövekedését figyelték meg időszakos oltási kampányok során, azonban nem azonos mértékben. A 2009-es influenza oltás (H1N1/PDM09 ellen kifejlesztett) nem okozott jelentős növekedést a megbetegedések között. Az influenza oltás előnyei nagyobb haszonnal járnak, mint az annak következtében kialakuló GBS megbetegedés kis kockázata. Oltási szempontból még azok is biztonságosnak tekinthetőek jövőbeli oltási szempontból, akiknél előzőleg GBS alakult ki. Egyéb vakcinák esetében, mint a [[járványos gyermekbénulás]] elleni, vagy a [[tetanusz]] és a [[kanyaró]] elleni vakcinák esetében nem találtak összefüggést a GBS-szel. |
||
| ⚫ | Néhány esetet kiválthatott influenza vírus és influenza oltás. 1976-os sertésinfluenza járvány utáni influenza immunizációt követően megnövekedett a Guillain–Barré-szindrómás betegek száma. 1 000 000 beoltott között 8,8-nál fejlődött ki a betegség. Azóta, a vakcinációnak tulajdonítható esetek közeli megfigyelése bebizonyította, hogy az influenza maga is képes GBS-t okozni. Az esetek kisszámú megnövekedését figyelték meg időszakos oltási kampányok során, azonban nem azonos mértékben.<ref name=Lehmann2010>{{cite journal | author = Lehmann HC, Hartung HP, Kieseier BC, Hughes RA | title = Guillain-Barré syndrome following influenza vaccination | journal = The Lancet Infectious Diseases | volume = 10 | issue = 9 | pages = 643–51 | date = Sep 2010 | pmid = 20797646 | doi = 10.1016/S1473-3099(10)70140-7}}</ref> A 2009-es influenza oltás (H1N1/PDM09 ellen kifejlesztett) nem okozott jelentős növekedést a megbetegedések között.<ref name=NEJM2012/> Az influenza oltás előnyei nagyobb haszonnal járnak, mint az annak következtében kialakuló GBS megbetegedés kis kockázata.<ref name=Rinaldi2013>{{cite journal|last1=Rinaldi|first1=Simon|title=Update on Guillain-Barré syndrome|journal=Journal of the Peripheral Nervous System|date=June 2013|volume=18|issue=2|pages=99–112|doi=10.1111/jns5.12020|pmid=23781958}}</ref> Oltási szempontból még azok is biztonságosnak tekinthetőek jövőbeli oltási szempontból, akiknél előzőleg GBS alakult ki.<ref name=NatRevNeurol2014/> Egyéb vakcinák esetében, mint a [[járványos gyermekbénulás]] elleni, vagy a [[tetanusz]] és a [[kanyaró]] elleni vakcinák esetében nem találtak összefüggést a GBS-szel.<ref name=Ryan2013/> |
||
==Patogenezis== |
==Patogenezis== |
||
[[Fájl:Neuron.jpg|alt= Egy tipikus neuron vázlatos képe.|thumb|440x440px|Egy tipikus neuron vázlatos képe]] |
[[Fájl:Neuron.jpg|alt= Egy tipikus neuron vázlatos képe.|thumb|440x440px|Egy tipikus neuron vázlatos képe]] |
||
A Guillain–Barré-szindróma során az idegek rendellenes működését az [[immunrendszer|immunrendszernek]] perifériás idegrendszer idegsejtjei és támogató struktúrái ellen indított támadása okozza. Az [[idegsejt]] sejttestei (soma vagy perikaryon) a [[Gerincvelői idegek és idegfonatok|gerincvelőben]] találhatóak és azok hosszú nyúlványai (axon) szállítják az idegi elektromos impulzusokat a neuromuszkuláris szinapszishoz, ahol aztán az impulzus továbbjut az izom felé. Az [[Axon (szövettan)|axonokat]] mielint tartalmazó ún. Schwann-sejtek borítják. Két Schwann-sejt között az axonnak egy-egy velőshüvely nélküli szakasza látható. Ez a Ranvier-féle befűződés. Különböző típusú Guillain–Barré-szindrómák jellemzője a immunrendszer különféle támadása. A betegség demyelinizációs szubtípúsa (AIDP, lásd lejjebb) során fehérvérsejtek (T-limfociták és makrofágok) támadják meg a mielin burkot. Ezt a folyamatot megelőzi a vérben található proteinek egy csoportjának az aktiválódása. Ezzel szemben az axonális szubtípusnál IgG antitestek és a komplement fehérjék közvetlenül támadják az axont borító sejtmembránt, limfocita sejtek nélkül. |
A Guillain–Barré-szindróma során az idegek rendellenes működését az [[immunrendszer|immunrendszernek]] perifériás idegrendszer idegsejtjei és támogató struktúrái ellen indított támadása okozza. Az [[idegsejt]] sejttestei (soma vagy perikaryon) a [[Gerincvelői idegek és idegfonatok|gerincvelőben]] találhatóak és azok hosszú nyúlványai (axon) szállítják az idegi elektromos impulzusokat a neuromuszkuláris szinapszishoz, ahol aztán az impulzus továbbjut az izom felé. Az [[Axon (szövettan)|axonokat]] mielint tartalmazó ún. Schwann-sejtek borítják. Két Schwann-sejt között az axonnak egy-egy velőshüvely nélküli szakasza látható.<ref name=NEJM2012/> Ez a Ranvier-féle befűződés. Különböző típusú Guillain–Barré-szindrómák jellemzője a immunrendszer különféle támadása. A betegség demyelinizációs szubtípúsa (AIDP, lásd lejjebb) során fehérvérsejtek (T-limfociták és makrofágok) támadják meg a mielin burkot. Ezt a folyamatot megelőzi a vérben található proteinek egy csoportjának az aktiválódása. Ezzel szemben az axonális szubtípusnál IgG antitestek és a komplement fehérjék közvetlenül támadják az axont borító sejtmembránt, limfocita sejtek nélkül.<ref name=NEJM2012/> |
||
A Guillain–Barré-szindróma axonális formájánál (de nem a demyelinizációs szubtípusnál) közvetlenül az idegsejtet támadó különböző antitestekről számoltak be. Ezek gangliozid molekulákhoz kapcsolódnak, az anyag csoportjait megtalálták a periferiális idegeknél. A gangliozid egy keramidot tartalmazó molekula, amely a hexóz típusú cukrok egy kis csoportjához kötődik és számos N-acetil neuraminsav csoportot tartalmaz. A négy kulcsfontosságú az antitestek által megtámadott gangliozid molekulák a GM1, GD1a, GT1a és GQ1b. A különböző anti-gangliozid antitesteket különböző tulajdonságok kapcsolhatók; például a GQ1b molekulához kapcsolódó antitest összefüggésbe hozható a GBS Miller Fisher-féle szubtípusával és kapcsolódó formáival beleértve a Bickerstaff-féle agyvelőgyulladást. Ilyen típusú antitestek fertőzés utáni termelése valószínűleg molekuláris mimikri következménye, ahol az immunrendszer mikrobiákból eredő anyagokra reagál, azonban ennek eredményeként létrejövő antitestek a szervezetben természetesen is létező epitópokkal is reakcióba lépnek. ''Campylobacter'' fertőzést követően, a szervezet IgA osztályú antitesteket kezd el termelni, azonban az emberek egy kis csoportja IgA mellett IgG antitesteket is termel a mikrobiákból származó anyagokkal szemben (pl. lipooligoszacharidok, azaz O-láncot nem tartalmazó, ún. nyers LPS), amelyek keresztkölcsönhatásba kerülnek az emberi idegsejt gangliozid molekuláival. Jelenleg nem ismert, hogy ez a folyamat, hogyan kerüli meg a gangliozidokkal szembeni centrális toleranciát, aminek el kellene nyomnia a szervezet saját anyagaival szembeni antitest termelést. Nem mindegyik anti-gangliozid antitest okoz betegséget, és nemrég felmerült azaz elképzelés, hogy néhány antitest több, mint egy típusú epitóphoz képes egyszerre kapcsolódni (heterodimér kötődés) és ez határozza meg a választ. Továbbá, a patogenikus antitestek kifejlődése függhet egyéb, a bélben élő baktérium törzstől. |
A Guillain–Barré-szindróma axonális formájánál (de nem a demyelinizációs szubtípusnál) közvetlenül az idegsejtet támadó különböző antitestekről számoltak be. Ezek gangliozid molekulákhoz kapcsolódnak, az anyag csoportjait megtalálták a periferiális idegeknél. A gangliozid egy keramidot tartalmazó molekula, amely a hexóz típusú cukrok egy kis csoportjához kötődik és számos N-acetil neuraminsav csoportot tartalmaz.<!--NEJM2012--> A négy kulcsfontosságú az antitestek által megtámadott gangliozid molekulák a GM1, GD1a, GT1a és GQ1b. A különböző anti-gangliozid antitesteket különböző tulajdonságok kapcsolhatók; például a GQ1b molekulához kapcsolódó antitest összefüggésbe hozható a GBS Miller Fisher-féle szubtípusával és kapcsolódó formáival beleértve a Bickerstaff-féle agyvelőgyulladást.<ref name=NEJM2012/> Ilyen típusú antitestek fertőzés utáni termelése valószínűleg molekuláris mimikri következménye, ahol az immunrendszer mikrobiákból eredő anyagokra reagál, azonban ennek eredményeként létrejövő antitestek a szervezetben természetesen is létező epitópokkal is reakcióba lépnek..<ref name=NEJM2012/><ref name=Kuwabara2013>{{cite journal|author=Kuwabara S, Yuki N|title=Axonal Guillain-Barré syndrome: concepts and controversies|journal=The Lancet Neurology|volume=12|issue=12|pages=1180-8|date=December 2013|pmid=24229616|doi=10.1016/S1474-4422(13)70215-1}}</ref> ''Campylobacter'' fertőzést követően, a szervezet IgA osztályú antitesteket kezd el termelni, azonban az emberek egy kis csoportja IgA mellett IgG antitesteket is termel a mikrobiákból származó anyagokkal szemben (pl. lipooligoszacharidok, azaz O-láncot nem tartalmazó, ún. nyers LPS), amelyek keresztkölcsönhatásba kerülnek az emberi idegsejt gangliozid molekuláival. Jelenleg nem ismert, hogy ez a folyamat, hogyan kerüli meg a gangliozidokkal szembeni centrális toleranciát, aminek el kellene nyomnia a szervezet saját anyagaival szembeni antitest termelést.<ref name=WillisonGoodyear2013/> Nem mindegyik anti-gangliozid antitest okoz betegséget, és nemrég felmerült azaz elképzelés, hogy néhány antitest több, mint egy típusú epitóphoz képes egyszerre kapcsolódni (heterodimér kötődés) és ez határozza meg a választ. Továbbá, a patogenikus antitestek kifejlődése függhet egyéb, a bélben élő baktérium törzstől.<ref name=WillisonGoodyear2013>{{cite journal|last1=Willison|first1=Hugh J.|last2=Goodyear|first2=Carl S.|title=Glycolipid antigens and autoantibodies in autoimmune neuropathies|journal=Trends in Immunology|date=September 2013|volume=34|issue=9|pages=453–459|doi=10.1016/j.it.2013.05.001|pmid=23770405}}</ref> |
||
==Diagnózis== |
==Diagnózis== |
||
| ⚫ | A Guillain–Barré-szindróma diagnózisa olyan ténymegállapításoktól függ, mint az izombénulás gyors kifejlődése, reflexhiány, lázhiány és egy valószínűsítő esemény. A diagnózis alátámasztására agy-gerincvelői folyadék vizsgálatot (gerinccsapoláson keresztül) és ingervezetési vizsgálatot szoktak elvégezni. Anti-gangliozid antitestekre való tesztet szintén sokszor végezne, azonban a diagnózis megállapításához való hozzájárulásuk többnyire korlátozott. Vértesztet elvégzése szintén bevett gyakorlat, hogy kizárhassák a gyengeség egyéb okozóit, mint a vér alacsony kálium szintjét (hypokalaemia). Az abnormálisan alacsony nátrium szint gyakran előfordul Guillain–Barré-szindrómánál. Ez a nem hatékony antidiuretikus hormon elválasztás (Schwartz–Bartter-szindróma) következménye, ami fokozott vízvisszatartáshoz vezet (vízmérgezés). |
||
| ⚫ | A Guillain–Barré-szindróma diagnózisa olyan ténymegállapításoktól függ, mint az izombénulás gyors kifejlődése, reflexhiány, lázhiány és egy valószínűsítő esemény. A diagnózis alátámasztására rendszerint agy-gerincvelői folyadék vizsgálatot (gerinccsapoláson keresztül) és ingervezetési vizsgálatot szoktak elvégezni.<ref name=NEJM2012/><ref name=NatRevNeurol2014/> Anti-gangliozid antitestekre való tesztet szintén sokszor végezne, azonban a diagnózis megállapításához való hozzájárulásuk többnyire korlátozott.<ref name=NatRevNeurol2014/> Vértesztet elvégzése szintén bevett gyakorlat, hogy kizárhassák a gyengeség egyéb okozóit, mint a vér alacsony kálium szintjét (hypokalaemia).<ref name=NEJM2012/> Az abnormálisan alacsony nátrium szint gyakran előfordul Guillain–Barré-szindrómánál. Ez a nem hatékony antidiuretikus hormon elválasztás (Schwartz–Bartter-szindróma) következménye, ami fokozott vízvisszatartáshoz vezet (vízmérgezés).<ref>{{cite journal | author=Spasovski G, Vanholder R, Allolio B ''et al'' | title=Clinical practice guideline on diagnosis and treatment of hyponatraemia | journal=European Journal of Endocrinology | date=25 Feb 2014 | volume=170 | issue=3 | pages=G1-47 | doi=10.1530/EJE-13-1020 | url=http://www.eje-online.org/content/170/3/G1.full}}</ref> |
||
| ⚫ | |||
| ⚫ | Számos esetben, a gerincvelőn MRI vizsgálatot alkalmaznak, hogy megkülönböztessék a Guillain–Barré-szindrómát egyéb, végtag gyengeséget okozó, panaszoktól, mint például a gerincvelői kompresszió.<ref name=NEJM2012/><ref name=NatRevNeurol2014/> Amennyiben az MRI viszgálat az gerincvelői ideggyökök megnövekedését mutat, az utalhat GBS-re.<ref name=NatRevNeurol2014/> |
||
===Gerincvelői folyadék=== |
===Gerincvelői folyadék=== |
||
Az agyat és a gerincvelőt [[agy-gerincvelői folyadék]] veszi körül és a gerinccsapolás során a keresztcsigolyák közé szúrt kis tű segítségével vesznek mintát a folyadékból. A Guillain–Barré-szindróma egy jellemzője a megemelkedett protein szint alacsony számú fehérvérsejt mellett (albumin citológiai elválasztás). Ez a tulajdonság számos egyéb betegségtől (limfóma, járványos gyermekbénulás) megkülönbözteti a BGS-t, amely esetekben viszont mind a fehérje és a fehérvérsejt szám emelkedett szintet mutat. Mindezek ellenére, a tünetek megjelenését követő első pár nap után a gerinccsapolás a BGS-szel rendelkező emberek 50%-ban, az első hét utána az emberek 80%-ban nem vezet eredményre, ennek következményeként a normál eredmények nem zárják ki a BGS-t. |
Az agyat és a gerincvelőt [[agy-gerincvelői folyadék]] veszi körül és a gerinccsapolás során a keresztcsigolyák közé szúrt kis tű segítségével vesznek mintát a folyadékból. A Guillain–Barré-szindróma egy jellemzője a megemelkedett protein szint alacsony számú fehérvérsejt mellett (albumin citológiai elválasztás). Ez a tulajdonság számos egyéb betegségtől (limfóma, járványos gyermekbénulás) megkülönbözteti a BGS-t, amely esetekben viszont mind a fehérje és a fehérvérsejt szám emelkedett szintet mutat.<!--NatRevNeurol2014--> Mindezek ellenére, a tünetek megjelenését követő első pár nap után a gerinccsapolás a BGS-szel rendelkező emberek 50%-ban, az első hét utána az emberek 80%-ban nem vezet eredményre, ennek következményeként a normál eredmények nem zárják ki a BGS-t.<ref name=NatRevNeurol2014/> |
||
Ismételt gerinccsapolás a betegség alatt nem ajánlott. A fehérje szintek emelkedhetnek a beavatkozást következtében. |
Ismételt gerinccsapolás a betegség alatt nem ajánlott. A fehérje szintek emelkedhetnek a beavatkozást következtében.<ref name=NatRevNeurol2014/> |
||
===Neurofiziológia=== |
===Neurofiziológia=== |
||
Elektrodiagnosztikai vizsgálatok, mint a tűs elektromiográfia (EMG) és idegvezetési vizsgálatok meghosszabbodott disztális lappangási időt, ingervezetési lassulást, ingervezetés megszakadást és a demyelinizációs esetekben a motoros ideg akciós potenciáljának (CMAP) szóródását mutathatják. Az F-hullámok és a H-reflexek meghosszabbodhatnak vagy teljesen hiányozhatnak. Tűs elektromiográfia vizsgálat gyakran normális súlyos eseteknél. Csökkent, neuropatikus gyógyulás látható a gyenge izmokban. Amennyiben valamekkora axonális sérülés történt a betegség kialakulását követő háromtól négy hétig terjedő időszakban, akkor fibrilláció, izomremegés látható a tűs EMG során. Elsődleges axonális sérülés esetén a jellemzők magukban foglalják az akciós potenciál csökkent amplitúdóját ingervezetési lassulás nélkül. |
Elektrodiagnosztikai vizsgálatok, mint a tűs elektromiográfia (EMG) és idegvezetési vizsgálatok meghosszabbodott disztális lappangási időt, ingervezetési lassulást, ingervezetés megszakadást és a demyelinizációs esetekben a motoros ideg akciós potenciáljának (CMAP) szóródását mutathatják.<ref name=Uncini2012>{{cite journal|author=Uncini A, Kuwabara S|title=Electrodiagnostic criteria for Guillain-Barrè syndrome: a critical revision and the need for an update|journal=Clinical Neurophysiology|volume=123|issue=8|pages=1487-95|date=August 2012|pmid= 22480600|doi=10.1016/j.clinph.2012.01.025}}</ref> Az F-hullámok és a H-reflexek meghosszabbodhatnak vagy teljesen hiányozhatnak. Tűs elektromiográfia vizsgálat gyakran normális súlyos eseteknél. Csökkent, neuropatikus gyógyulás látható a gyenge izmokban. Amennyiben valamekkora axonális sérülés történt a betegség kialakulását követő háromtól négy hétig terjedő időszakban, akkor fibrilláció, izomremegés látható a tűs EMG során. Elsődleges axonális sérülés esetén a jellemzők magukban foglalják az akciós potenciál csökkent amplitúdóját ingervezetési lassulás nélkül. |
||
===Klinikai szubtípusok=== |
===Klinikai szubtípusok=== |
||
A Guillain–Barré-szindróma több szubtípusa ismert. Ennek ellenére, számos embernél tapasztalhatóak olyan tünetek, amelyek egymást átfedik és a pontos osztályozást nehezítik. Minden szubtípusnak van részleges formája. Például, néhány ember csak izolált szemmozgásbeli vagy koordinációs problémát észlel; ezeket tüneteket a Miller Fisher típusú szindrómához kapcsolják és hasonló anti-gangliozid antitest mintákat is produkál. |
A Guillain–Barré-szindróma több szubtípusa ismert.<ref name=NatRevNeurol2014/><ref name=Uncini2012/> Ennek ellenére, számos embernél tapasztalhatóak olyan tünetek, amelyek egymást átfedik és a pontos osztályozást nehezítik.<ref name=vanDoorn2008/><ref name=Wakerley2014>{{cite journal|author=Wakerley BR, Uncini A, Yuki N; GBS Classification Group|title=Guillain-Barré and Miller Fisher syndromes--new diagnostic classification|journal=Nature Reviews Neurology.|volume=10|issue=9|pages=537-44|date=September 2014|pmid=25072194|doi=10.1038/nrneurol.2014.138}}</ref> Minden szubtípusnak van részleges formája. Például, néhány ember csak izolált szemmozgásbeli vagy koordinációs problémát észlel; ezeket tüneteket a Miller Fisher típusú szindrómához kapcsolják és hasonló anti-gangliozid antitest mintákat is produkál. |
||
<ref name=Wakerley2014/> |
|||
{| class="wikitable" |
{| class="wikitable" |
||
!Típus |
!Típus |
||
| 86. sor: | 93. sor: | ||
|Miller Fisher-szindróma |
|Miller Fisher-szindróma |
||
|Ataxia, szemizom-gyengeség, reflexhiány, de többnyire végtaggyengeség nélkül |
|Ataxia, szemizom-gyengeség, reflexhiány, de többnyire végtaggyengeség nélkül |
||
|Ez a változat elterjedtebb a férfiak, mint a nők körében (2:1 arányban). A megbetegedések tipikusan tavasszal fordulnak elő és az érintettek átlagéletkora 43 év. |
|Ez a változat elterjedtebb a férfiak, mint a nők körében (2:1 arányban). A megbetegedések tipikusan tavasszal fordulnak elő és az érintettek átlagéletkora 43 év.<ref name="Mori2012">{{cite journal|author=Mori M, Kuwabara S, Yuki N|title=Fisher syndrome: clinical features, immunopathogenesis and management|journal=Expert Rev Neurother|volume=12|issue=1|pages=39-51|date=January 2012|pmid= 22149656|doi=10.1586/ern.11.182}}</ref> |
||
|Általában normális, néha diszkrét változás a szenzoros idegek vezetésében, H-reflex megállapítása |
|Általában normális, néha diszkrét változás a szenzoros idegek vezetésében, H-reflex megállapítása |
||
|GQ1b, GT1a |
|GQ1b, GT1a |
||
|} |
|} |
||
A Guillain–Barré-szindróma teljes diagnosztikai lefedettsége érdekében sokszor több, egyéb vizsgálatot is bevonnak. A Bickerstaff-féle agyvelőgyulladásra ma például a Miller Fisher-szindróma egy fajtájaként tekintenek, ahogy az ehhez kapcsolódó egyik állapota is, amit, úgy jellemeznek, mint "súlyos ataxiás alváshiány"-t, ahol a koordináció és az álmosság jelen vannak, azonban nem érzékelhető izomgyengeség. BBE jellemzői a súlyos szemizombénulás (oftalmoplégia), ataxia és tudatzavar, illetve hozzá kapcsolható még a hiányzó vagy csökkent saját reflex és a Babinski reflex (talpi reflex). A betegség lefolyása lehet egyfázisú vagy visszaeső. Nagyszámú, szabálytalan, hiperintenzív károsodásokat írtak le főként az agytörzsben, különösen a hídban (nyúltvelőt a középaggyal összekötő rész), a középagyban és a nyúltvelőben. A súlyos, kezdeti tünetei ellenére a BBE prognózisa jónak mondható. Az [[Mágnesesrezonancia-képalkotás|MRI]] kritikus szerepet játszik a BBE diagnózisában. Jó pár BBE beteghez társítottak axonális Guillain–Barré-szindrómát, ami feltételezi, hogy a két betegség szorosan kapcsolódik egymáshoz. |
A Guillain–Barré-szindróma teljes diagnosztikai lefedettsége érdekében sokszor több, egyéb vizsgálatot is bevonnak. A Bickerstaff-féle agyvelőgyulladásra ma például a Miller Fisher-szindróma egy fajtájaként tekintenek, ahogy az ehhez kapcsolódó egyik állapota is, amit, úgy jellemeznek, mint "súlyos ataxiás alváshiány"-t, ahol a koordináció és az álmosság jelen vannak, azonban nem érzékelhető izomgyengeség.<ref name=Wakerley2014/> BBE jellemzői a súlyos szemizombénulás (oftalmoplégia), ataxia és tudatzavar, illetve hozzá kapcsolható még a hiányzó vagy csökkent saját reflex és a Babinski reflex (talpi reflex).<ref name=Wakerley2014/> A betegség lefolyása lehet egyfázisú vagy visszaeső. Nagyszámú, szabálytalan, hiperintenzív károsodásokat írtak le főként az agytörzsben, különösen a hídban (nyúltvelőt a középaggyal összekötő rész), a középagyban és a nyúltvelőben. A súlyos, kezdeti tünetei ellenére a BBE prognózisa jónak mondható. Az [[Mágnesesrezonancia-képalkotás|MRI]] kritikus szerepet játszik a BBE diagnózisában. Jó pár BBE beteghez társítottak axonális Guillain–Barré-szindrómát, ami feltételezi, hogy a két betegség szorosan kapcsolódik egymáshoz. |
||
Jelenleg vita tárgyát képezi, hogy az önálló súlyos érzékvesztés tekinthető-e a Guillain–Barré-szindróma egy formájának; ennek előfordulása ritka, összehasonlítva az olyan GBS-szel, ahol izomgyengeség érzékelhető azonban nincsenek érzékeléssel kapcsolatos tünetek. |
Jelenleg vita tárgyát képezi, hogy az önálló súlyos érzékvesztés tekinthető-e a Guillain–Barré-szindróma egy formájának; ennek előfordulása ritka, összehasonlítva az olyan GBS-szel, ahol izomgyengeség érzékelhető azonban nincsenek érzékeléssel kapcsolatos tünetek.<ref name=Rinaldi2013/> |
||
==Kezelése== |
==Kezelése== |
||
===Immunterápia=== |
===Immunterápia=== |
||
Utólagos kezelésébe beletartozik a szervezet idegrendszer elleni támadásának csökkentése plazmaferezisen keresztül vagy az antitestek véráramból történő kiszűrésével, vagy intravénás immunglobulin-kezelés (IVIg) alkalmazásával annak érdekében, hogy ártalmatlanítsa a káros antitesteket és csökkentse a gyulladást. A két kezelés egyformán hatásos és a kettő kombinációja jelentősen jobb hatással |
Utólagos kezelésébe beletartozik a szervezet idegrendszer elleni támadásának csökkentése plazmaferezisen keresztül vagy az antitestek véráramból történő kiszűrésével, vagy intravénás immunglobulin-kezelés (IVIg) alkalmazásával annak érdekében, hogy ártalmatlanítsa a káros antitesteket és csökkentse a gyulladást. A két kezelés egyformán hatásos és a kettő kombinációja nem bír jelentősen jobb hatással, mint külön-külön.<ref>{{cite journal|last1=Hughes|first1=RA|last2=Swan|first2=AV|last3=van Doorn|first3=PA|title=Intravenous immunoglobulin for Guillain-Barré syndrome.|journal=The Cochrane Database of Systematic Reviews|date=Sep 19, 2014|volume=9|pages=CD002063|pmid=25238327|doi=10.1002/14651858.CD002063.pub6}}</ref> A plazmaferezis alkalmazása a tünetek megjelenését követő négy héten belül meggyorsítja a felépülést.<ref name=Hughes>{{cite journal | author = Hughes RA, Wijdicks EF, Barohn R, Benson E, Cornblath DR, Hahn AF, Meythaler JM, Miller RG, Sladky JT, Stevens JC | title = Practice parameter: immunotherapy for Guillain-Barré syndrome: report of the Quality Standards Subcommittee of the American Academy of Neurology | journal = Neurology | volume = 61 | issue = 6 | pages = 736–40 | date = September 2003 | pmid = 14504313 | doi = 10.1212/WNL.61.6.736 | url = http://www.neurology.org/content/61/6/736.full.html }}</ref> Az IVIg ugyanolyan hatékony, mint a plazmaferezis, amennyiben a tünetek megjelenését követő két hétben kezdik el alkalmazni és kevesebb szövődménye is van.<ref name=Hughes/> Többnyire az IVIg-et alkalmazzák először a könnyű alkalmazhatóság és gyógyszerbiztonsági profilja miatt. A használata nem kockázatmentes; néha okozhat májgyulladást vagy ritka esetekben vese elégtelenséget.<ref name="Dantal2013">{{cite journal|author=Dantal J|title=Intravenous immunoglobulins: in-depth review of excipients and acute kidney injury risk|journal=American Journal of Nephrology |volume=38|issue=4|pages=275-84|date=October 2013|pmid=24051350|doi=10.1159/000354893|url=http://www.karger.com/Article/FullText/354893}}</ref> A glükokortozidokat önmagukban nem találták hatásosnak a felépülés meggyorsításában és potenciálisan késleltetheti is azt.<ref>{{cite journal|last1=Hughes|first1=RA|last2=van Doorn|first2=PA|title=Corticosteroids for Guillain-Barré syndrome.|journal=The Cochrane Database of Systematic Reviews|date=15 August 2012|volume=8|pages=CD001446|doi=10.1002/14651858.CD001446.pub4|pmid=22895921}}</ref> |
||
===Fájdalom=== |
===Fájdalom=== |
||
A fájdalom jellemző tünete a Guillain–Barré-szindrómában szenvedő betegeknek, azonban a tanulmányok azt mutatják, hogy a fájdalom csökkentésére használt különböző kezelések között nincs olyan különbség, ami miatt ajánlani lehetne egy bizonyosat. |
A fájdalom jellemző tünete a Guillain–Barré-szindrómában szenvedő betegeknek, azonban a tanulmányok azt mutatják, hogy a fájdalom csökkentésére használt különböző kezelések között nincs olyan különbség, ami miatt ajánlani lehetne egy bizonyosat.<ref>{{cite journal|last1=Liu|first1=J|last2=Wang|first2=LN|last3=McNicol|first3=ED|title=Pharmacological treatment for pain in Guillain-Barré syndrome.|journal=The Cochrane Database of Systematic Reviews|date=20 October 2013|volume=10|pages=CD009950|doi=10.1002/14651858.CD009950.pub2|pmid=24142399}}</ref> |
||
===Rehabilitáció=== |
===Rehabilitáció=== |
||
Az akut fázist követően a rehabilitációs kezelés sokszor tartalmazza több tudományágat átfogó csapat segítségét, akik elsősorban a beteg mindennapi tevékenységeinek hatékonyabb elvégzésére, segítésére fókuszálnak. Munkaterapeuta felajánlhat olyan eszközt (mint kerekesszék vagy evőeszközök), ami megkönnyíti a beteget mindennapi teendőinek független ellátásában. Gyógytornász segít a megfelelő funkcionális mozgások elsajátításában, elkerülve a különböző kompenzációs mozgásokat, amelyek hosszútávon negatívan befolyásolhatják a felépülést. Emellett néhány bizonyíték azt támasztja alá, hogy a fizioterápia segít, hogy a Guillain–Barré-szindrómás beteg újra visszanyerje az erejét, állóképességét és járásminőségét, ugyanakkor |
Az akut fázist követően a rehabilitációs kezelés sokszor tartalmazza több tudományágat átfogó csapat segítségét, akik elsősorban a beteg mindennapi tevékenységeinek hatékonyabb elvégzésére, segítésére fókuszálnak. Munkaterapeuta felajánlhat olyan eszközt (mint kerekesszék vagy evőeszközök), ami megkönnyíti a beteget mindennapi teendőinek független ellátásában. Gyógytornász segít a megfelelő funkcionális mozgások elsajátításában, elkerülve a különböző kompenzációs mozgásokat, amelyek hosszútávon negatívan befolyásolhatják a felépülést. Emellett néhány bizonyíték azt támasztja alá, hogy a fizioterápia segít, hogy a Guillain–Barré-szindrómás beteg újra visszanyerje az erejét, állóképességét és járásminőségét,<ref>{{cite journal | author = Davidson I, Wilson C, Walton T, Brissenden S | title = Physiotherapy and Guillain–Barré syndrome: Results of a national survey | journal = Physiotherapy | volume = 95 | issue = 3 | pages = 157–163 | year = 2009 | pmid = 19635334 | pmc = | doi = 10.1016/j.physio.2009.04.001 }}</ref> ugyanakkor megelőzi az izommerevedéseket, felfekvéseket és a kardiopulmonáris (szív-tüdő) nehézségeket.<ref>{{cite journal | author = Karavatas SG | year = 2005 | title = The role of neurodevelopmental sequencing in the physical therapy management of a geriatric patient with Guillain–Barre syndrome. | journal = Topics in Geriatric Rehabilitation | volume = 21 | issue = 2 | pages = 133–135 | url = http://www.nursingcenter.com/lnc/JournalArticle?Article_ID=585111&Journal_ID=515682&Issue_ID=585095 | doi=10.1097/00013614-200504000-00008}}</ref> Beszédterapeuták segítenek visszaszerezni a beszéd és nyelési képességet, különösen olyan betegeknél, akiket intubáltak vagy gégemetszésen estek át. Sem az amantadint, sem az aszkorbinsavat nem találták hatékonynak fáradtság ellen.<ref>{{cite journal|last1=White|first1=CM|last2=van Doorn|first2=PA|last3=Garssen|first3=MP|last4=Stockley|first4=RC|title=Interventions for fatigue in peripheral neuropathy.|journal=The Cochrane database of systematic reviews|date=18 December 2014|volume=12|pages=CD008146|pmid=25519471|doi=10.1002/14651858.CD008146.pub2}}</ref> |
||
==Prognózis== |
==Prognózis== |
||
| ⚫ | |||
| ⚫ | |||
| ⚫ | A legtöbb betegnél a tünetek erősödnek az első és harmadik közötti időszakban. A felépülés többnyire a betegséget követő negyedik héttől kezdődik, azonban felépülés gyorsasága és mértéke változó. Körülbelül a betegek 80%-a teljesen felépül néhány hónaptól egy évig terjedő időszakon belül, azonban egy kisebb részüknél néhány tünet állandósulhat, mint például a reflexhiány. A betegek kb. 5-10%-a épül fel valamilyen súlyos rokkantsággal, a legtöbb ilyen esetben súlyos proximális motoros és szenzoros axonnál sérülés marad vissza az axonális regeneráció képtelenségével. A betegek kb. 5-10% tapasztal egyszeri vagy többszöri visszaesést, amely eseteket ezután úgy osztályoznak, mint krónikus gyulladásos demyelinizációs polineuropátia. |
||
| ⚫ | A legtöbb betegnél a tünetek erősödnek az első és harmadik közötti időszakban.<ref name=NEJM2012/> A felépülés többnyire a betegséget követő negyedik héttől kezdődik, azonban felépülés gyorsasága és mértéke változó.<ref name=NEJM2012/> Körülbelül a betegek 80%-a teljesen felépül néhány hónaptól egy évig terjedő időszakon belül, azonban egy kisebb részüknél néhány tünet állandósulhat, mint például a reflexhiány. A betegek kb. 5-10%-a épül fel valamilyen súlyos rokkantsággal, a legtöbb ilyen esetben súlyos proximális motoros és szenzoros axonnál sérülés marad vissza az axonális regeneráció képtelenségével. A betegek kb. 5-10% tapasztal egyszeri vagy többszöri visszaesést, amely eseteket ezután úgy osztályoznak, mint krónikus gyulladásos demyelinizációs polineuropátia. |
||
| ⚫ | Kutatási tanulmányokban Guillain–Barré-szindrómás eseteket egy 0-tól 6-ig terjedő skálán rögzítenek, ahol a 0 a teljesen egészségeset jelenti, az 1 a nagyon enyhe tünetekkel rendelkező de még futni képes beteget, 2 az a skálán aki képes járni de nem képes futni, 3 az akinek botra vagy egyéb támogató eszközre van szüksége, 4 az ágy vagy kerekesszékhez kötött, 5 akinek hosszabb távon szüksége van valamilyen légzést segítő eszközre, 6 halál. |
||
| ⚫ | Kutatási tanulmányokban Guillain–Barré-szindrómás eseteket egy 0-tól 6-ig terjedő skálán rögzítenek, ahol a 0 a teljesen egészségeset jelenti, az 1 a nagyon enyhe tünetekkel rendelkező de még futni képes beteget, 2 az a skálán aki képes járni de nem képes futni, 3 az akinek botra vagy egyéb támogató eszközre van szüksége, 4 az ágy vagy kerekesszékhez kötött, 5 akinek hosszabb távon szüksége van valamilyen légzést segítő eszközre, 6 halál.<ref>{{cite journal | author=Hughes RA, Swan AV, Raphaël JC, Annane D, van Koningsveld R, van Doorn PA | title=Immunotherapy for Guillain-Barré syndrome: a systematic review | journal=Brain | date=Sep 2007 | volume=130 | pages=2245–57 | pmid=17337484 | doi=10.1093/brain/awm004 | url=http://brain.oxfordjournals.org/content/130/9/2245}}</ref> |
||
| ⚫ | A Guillain–Barré-szindróma prognózisát többnyire a kor határozza meg (a 40 év fölöttieknek rosszabb a kilátásuk), és betegség két hét utáni súlyossága. Továbbá azoknak a prognózisa, akik hasmenésben szenvedtek a betegség kialakulása előtt szintén rosszabb. Annak akinél az idegvezetési vizsgálatok során ingervezetés megszakadását mutatja, 6 hónapos időtávban szintén rosszabb a kilátása. Azoknak, akik intravénás immunglobulin-kezelést (IVIg) kaptak és két héttel a kezelés után a vérben található IgG alacsony megemelkedését mutatták ki, szintén gyengébbek a kilátásai 6 hónapos időtávban, mint azoknak, akiknek az IgG szintjük jelentősen megnőtt. |
||
| ⚫ | A Guillain–Barré-szindróma prognózisát többnyire a kor határozza meg (a 40 év fölöttieknek rosszabb a kilátásuk), és betegség két hét utáni súlyossága. Továbbá azoknak a prognózisa, akik hasmenésben szenvedtek a betegség kialakulása előtt szintén rosszabb.<ref name=vanDoorn2010/> Annak akinél az idegvezetési vizsgálatok során ingervezetés megszakadását mutatja, 6 hónapos időtávban szintén rosszabb a kilátása.<ref name=vanDoorn2010/> Azoknak, akik intravénás immunglobulin-kezelést (IVIg) kaptak és két héttel a kezelés után a vérben található IgG alacsony megemelkedését mutatták ki, szintén gyengébbek a kilátásai 6 hónapos időtávban, mint azoknak, akiknek az IgG szintjük jelentősen megnőtt.<ref name=vanDoorn2010/> |
||
==Epidemiológia== |
==Epidemiológia== |
||
A Nyugati országokban, az évi esetszámot 0,89 és 1,89 közé teszik 100 000 emberenként. Gyermekek és fiatal felnőttek kevésbé érintettek, mint az idősek. Az ő esetükben az élet minden tizedik évével a kockázat 20%-kal folyamatosan emelkedik. A férfiaknál nagyobb valószínűséggel fejlődik a Guillain–Barré-szindróma, mint a nőknél. A férfiak relatív kockázata 1,78 a nőkkel összehasonlítva. |
A Nyugati országokban, az évi esetszámot 0,89 és 1,89 közé teszik 100 000 emberenként. Gyermekek és fiatal felnőttek kevésbé érintettek, mint az idősek. Az ő esetükben az élet minden tizedik évével a kockázat 20%-kal folyamatosan emelkedik.<ref name=Sejvar2011>{{cite journal|last1=Sejvar|first1=James J.|last2=Baughman|first2=Andrew L.|last3=Wise|first3=Matthew|last4=Morgan|first4=Oliver W.|title=Population incidence of Guillain-Barré syndrome: a systematic review and meta-analysis|journal=Neuroepidemiology|date=2011|volume=36|issue=2|pages=123–133|doi=10.1159/000324710|pmid=21422765|url=http://www.karger.com/Article/FullText/324710}}</ref> A férfiaknál nagyobb valószínűséggel fejlődik a Guillain–Barré-szindróma, mint a nőknél. A férfiak relatív kockázata 1,78 a nőkkel összehasonlítva.<ref name=NEJM2012/><ref name=Sejvar2011/> |
||
A különböző szubtípusok elterjedtsége jelentősen változik országonként. Európában és az Egyesült Államokban az érintett emberek 60-80%-nak a betegség demyelinizációs szubtípusa (AIDP) jelentkezik, az AMAN típusú csak kis számú (6-7%) embert érint. Ázsiában és Közép- és Dél-Amerikában ez az arány jóval magasabb (30-65%). Ez valószínűleg az emberek különféle betegségnek való kitettsége miatt van így, de köze lehet az adott populáció genetikai karakterisztikájához is. A Miller Fisher féle változatáról úgy gondolják, hogy jóval gyakoribb Délkelet-Ázsiában. |
A különböző szubtípusok elterjedtsége jelentősen változik országonként. Európában és az Egyesült Államokban az érintett emberek 60-80%-nak a betegség demyelinizációs szubtípusa (AIDP) jelentkezik, az AMAN típusú csak kis számú (6-7%) embert érint. Ázsiában és Közép- és Dél-Amerikában ez az arány jóval magasabb (30-65%). Ez valószínűleg az emberek különféle betegségnek való kitettsége miatt van így, de köze lehet az adott populáció genetikai karakterisztikájához is.<ref name=NatRevNeurol2014/> A Miller Fisher féle változatáról úgy gondolják, hogy jóval gyakoribb Délkelet-Ázsiában.<ref name=NEJM2012/><ref name=Shahrizaila2013/> |
||
==Története== |
==Története== |
||
[[Fájl:Georges Guillain.jpg|alt= Georges Guillain, orvos, (1876-1961)|thumb|Georges Guillain, orvos, (1876-1961)]] |
[[Fájl:Georges Guillain.jpg|alt= Georges Guillain, orvos, (1876-1961)|thumb|Georges Guillain, orvos, (1876-1961)<ref>{{cite journal|last1=Goetz|first1=C. G.|title=Georges Guillain's neurologic exploration of America|journal=Neurology|date=1 May 1998|volume=50|issue=5|pages=1451–1455|doi=10.1212/WNL.50.5.1451|pmid=9596004}}</ref>]] |
||
Egy francia orvos Jean-Baptiste Octave Landry volt az, aki először leírta a betegséget 1859-ben. 1916-ban Georges Guillain, Jean Alexandre Barré és André Strohl két katonát diagnosztizáltak a betegséggel és írták le a betegség alapvető diagnosztikai jellemzőit, az agy-gerincvelői folyadékban megnőtt fehérje koncentrációt de normál fehérvérsejt szám mellett. |
Egy francia orvos Jean-Baptiste Octave Landry volt az, aki először leírta a betegséget 1859-ben.<ref>{{cite journal| last1=Landry | first=Jean-Baptiste | title=Note sur la paralysie ascendante aiguë | journal=Gazette Hebdomadaire de Médecine et de Chirurgie | date=1859 | volume=6 | pages=472–474, 486–488} | [https://books.google.ca/books?id=rwxAAAAAcAAJ&dq=Gazette%20hebdomadaire%20de%20m%C3%A9decine%20et%20de%20chirurgie%201859&pg=PA486#v=onepage&q&f=false Link]}</ref> 1916-ban Georges Guillain, Jean Alexandre Barré és André Strohl két katonát diagnosztizáltak a betegséggel és írták le a betegség alapvető diagnosztikai jellemzőit, az agy-gerincvelői folyadékban megnőtt fehérje koncentrációt de normál fehérvérsejt szám mellett.<ref name=vanDoorn2008/> |
||
Egy kanadai neurológus C. Miller Fisher volt, aki a betegség egy variánsát leírta 1956-ban és aztán, akiről elnevezték ezt a szubtípust. Egy brit neurológus Edwin Bickerstaff és Philip Cloake voltak azok, akik az agyvelőgyulladásos szubtípust leírták 1951-ben és hozzájárultak később a betegség jobb megértéséhez egy 1957-ben írt tanulmánnyal. Guillain ezen tulajdonságok némelyikét már leírta, mielőtt megjelentették volna a betegség teljes leírást 1938-ban. További szubtípusokat írtak le azóta, mint például azt a változatát, amelyik teljes ataxiát okoz és azt a típust, amelyik elsősorban garat, a nyak és a karok gyengeségével jár. Az axonális szubtípust először 1990-ben írták le. |
Egy kanadai neurológus C. Miller Fisher volt, aki a betegség egy variánsát leírta 1956-ban és aztán, akiről elnevezték ezt a szubtípust.<ref name=Shahrizaila2013/><ref>{{cite journal | author = Fisher M | title = An unusual variant of acute idiopathic polyneuritis (syndrome of ophthalmolplegia, ataxia and areflexia) | journal = N. Engl. J. Med. | volume = 255 | issue = 2 | pages = 57–65 | year = 1956 | pmid = 13334797 | doi = 10.1056/NEJM195607122550201 }}</ref> Egy brit neurológus Edwin Bickerstaff és Philip Cloake voltak azok, akik az agyvelőgyulladásos szubtípust leírták 1951-ben és hozzájárultak később a betegség jobb megértéséhez egy 1957-ben írt tanulmánnyal.<ref name=Shahrizaila2013/><ref>{{cite journal|last1=Bickerstaff|first1=E.R.|last2=Cloake|first2=P.C.|title=Mesencephalitis and rhombencephalitis.|journal=British Medical Journal|date=14 July 1951|volume=2|issue=4723|pages=77-81|doi=10.1136/bmj.2.4723.77|pmid=14848512|pmc=2069534}}</ref><ref>{{cite journal|last1=Bickerstaff|first1=E.R.|title=Brain-stem encephalitis; further observations on a grave syndrome with benign prognosis.|journal=British Medical Journal|date=15 June 1957|volume=1|issue=5032|pages=1384-7|doi=10.1136/bmj.1.5032.1384|pmid=13436795|pmc=1973653}}</ref> Guillain ezen tulajdonságok némelyikét már leírta, mielőtt megjelentették volna a betegség teljes leírást 1938-ban.<ref name=Shahrizaila2013/> További szubtípusokat írtak le azóta, mint például azt a változatát, amelyik teljes ataxiát okoz és azt a típust, amelyik elsősorban garat, a nyak és a karok gyengeségével jár.<ref name=Shahrizaila2013/> Az axonális szubtípust először 1990-ben írták le.<ref name=Kuwabara2013/> |
||
Miután számos eset összeköthető volt egy sertésinfluenza oltással a diagnosztikai kritérium tovább fejlődött a késő 1970-es években. Ezeket később tovább finomították 1990-ben. Vakcináció biztonsági szempontól az esetleírást a Brighton Collaboration 2009-ben átnézte, de ennek főként kutatási célja volt. Plazma cserét először 1978-ban alkalmaztak és a hatékonyságát megerősítették nagyobb tanulmányokban 1985-ben. Az intravénás immunglobulint 1988-ban vezették be és korai 1990-es évek tanulmányaiban bebizonyították a plazma cserével egyenértékű hatását. |
Miután számos eset összeköthető volt egy sertésinfluenza oltással a diagnosztikai kritérium tovább fejlődött a késő 1970-es években. Ezeket később tovább finomították 1990-ben.<ref name=NatRevNeurol2014/><ref>{{cite journal|last1=Asbury|first1=Arthur K.|last2=Cornblath|first2=David R.|title=Assessment of current diagnostic criteria for Guillain-Barré syndrome.|journal=Annals of Neurology|date=1990|volume=27 Suppl|pages=S21-4|doi=10.1002/ana.410270707|pmid=2194422}}</ref> Vakcináció biztonsági szempontól az esetleírást a Brighton Collaboration 2009-ben átnézte,<ref>{{cite journal|last1=Sejvar|first1=James J.|last2=Kohl|first2=Katrin S.|last3=Gidudu|first3=Jane|last4=Amato|first4=Anthony|last5=Bakshi|first5=Nandini|last6=Baxter|first6=Roger|last7=Burwen|first7=Dale R.|last8=Cornblath|first8=David R.|last9=Cleerbout|first9=Jan|last10=Edwards|first10=Kathryn M.|last11=Heininger|first11=Ulrich|last12=Hughes|first12=Richard|last13=Khuri-Bulos|first13=Najwa|last14=Korinthenberg|first14=Rudolf|last15=Law|first15=Barbara J.|last16=Munro|first16=Ursula|last17=Maltezou|first17=Helena C.|last18=Nell|first18=Patricia|last19=Oleske|first19=James|last20=Sparks|first20=Robert|last21=Velentgas|first21=Priscilla|last22=Vermeer|first22=Patricia|last23=Wiznitzer|first23=Max|title=Guillain–Barré syndrome and Fisher syndrome: Case definitions and guidelines for collection, analysis, and presentation of immunization safety data|journal=Vaccine|date=January 2011|volume=29|issue=3|pages=599–612|doi=10.1016/j.vaccine.2010.06.003|pmid=20600491}}</ref> de ennek főként kutatási célja volt.<ref name=NatRevNeurol2014/> Plazma cserét először 1978-ban alkalmaztak és a hatékonyságát megerősítették nagyobb tanulmányokban 1985-ben.<ref name=Walgaard2011>{{cite journal|last1=Walgaard|first1=Christa|last2=Jacobs|first2=Bart C|last3=van Doorn|first3=Pieter A|title=Emerging drugs for Guillain-Barré syndrome|journal=Expert Opinion on Emerging Drugs|date=March 2011|volume=16|issue=1|pages=105–120|doi=10.1517/14728214.2011.531699|pmid=21352072}}</ref> Az intravénás immunglobulint 1988-ban vezették be és korai 1990-es évek tanulmányaiban bebizonyították a plazma cserével egyenértékű hatását.<ref name=Walgaard2011/> |
||
==Kutatási irányok== |
==Kutatási irányok== |
||
Guillain–Barré-szindróma működési mechanizmusának megértésében előrelépés történt az elmúlt években. Új kezelési eljárások kifejlesztése korlátozott az 1980-as és 90'-es években bevezetett immunterápia óta. A jelenlegi kutatások arra irányulnak, hogy bebizonyítsák, hogy vajon azoknak a betegeknek, akik kaptak előzőleg intravénás immunglobulint, hasznot jelentene-e egy második IVIg amennyiben a vérben mért antitestek szintje a kezelést követően csak kis mértékű emelkedést mutatott. Az immunszuppresszív gyógyszerekkel (mycophenolate mofetil, agyi eredetű neurotrof faktor és béta Interferon (IFN-β)) végzett tanulmányok nem támasztották alá hasznosságukat, hogy támogassák széleskörűen használatukat. |
Guillain–Barré-szindróma működési mechanizmusának megértésében előrelépés történt az elmúlt években.<ref name=Rinaldi2013/> Új kezelési eljárások kifejlesztése korlátozott az 1980-as és 90'-es években bevezetett immunterápia óta..<ref name=Rinaldi2013/><ref name=Walgaard2011/> A jelenlegi kutatások arra irányulnak, hogy bebizonyítsák, hogy vajon azoknak a betegeknek, akik kaptak előzőleg intravénás immunglobulint, hasznot jelentene-e egy második IVIg amennyiben a vérben mért antitestek szintje a kezelést követően csak kis mértékű emelkedést mutatott.<ref name=vanDoorn2010/><ref name=Walgaard2011/> Az immunszuppresszív gyógyszerekkel (mycophenolate mofetil, agyi eredetű neurotrof faktor és béta Interferon (IFN-β)) végzett tanulmányok nem támasztották alá hasznosságukat, hogy támogassák széleskörűen használatukat.<ref name=Walgaard2011/> |
||
| ⚫ | A tanulmányokban gyakran használnak állat modelleket (kísérleti autoimmun neuritis patkányokban) és néhány ágens ígéretesnek tűnik: glatiramer-acetát, quinpramine, fausadil (a Rho-kináz enzim egy inhibitora),<ref name=Rinaldi2013/> és egy szívgyógszer a flecainide.<ref name=Walgaard2011/> Laboratóriumi kutatások során egy anti-GD3 anti-gangliozid antitestet elleni antitest hatékonynak bizonyult.<ref name=Rinaldi2013/> A komplement rendszer (immunrendszert kiegészítő rendszer) GBS-ben betöltött szerepe valószínűsíti, hogy a komplement inhibitorok (mint az eculizumab gyógyszer) hatásosak lehetnek.<ref name=Walgaard2011/> |
||
== Jegyzetek == |
|||
{{Reflist|2}} |
|||
== További olvasnivalók == |
|||
* {{cite book|last1=Steinberg|first1=Gareth J. Parry, Joel S.|title=Guillain-Barré syndrome: from diagnosis to recovery (American Academy of Neurology) |date=2006|publisher=Pub Group West|location=New York, N.Y.|isbn=978-1932603569}} |
|||
== Külső hivatkozások == |
|||
* [http://www.gbs-cidp.org/ GBS/CIDP Foundation International] |
|||
| ⚫ | A tanulmányokban gyakran használnak állat modelleket (kísérleti autoimmun neuritis patkányokban) és néhány ágens ígéretesnek tűnik: glatiramer-acetát, quinpramine, fausadil (a Rho-kináz enzim egy inhibitora) és egy szívgyógszer a flecainide. Laboratóriumi kutatások során egy anti-GD3 anti-gangliozid antitestet elleni antitest hatékonynak bizonyult. A komplement rendszer (immunrendszert kiegészítő rendszer) GBS-ben betöltött szerepe valószínűsíti, hogy a komplement inhibitorok (mint az eculizumab gyógyszer) hatásosak lehetnek. |
||
[[Kategória:Szindrómák]] |
[[Kategória:Szindrómák]] |
||
A lap 2015. június 22., 11:38-kori változata
Guillain–Barré-szindróma (GBS), néha Guillain–Barré–Strohl-szindróma vagy Landry-típusú bénulás egy gyorsan rosszabodó több ideget érintő károsodás (polineuropátia), amit típusosan az alsó végtagokban kezdődő felszálló jellegű, szimmetrikus végtaggyengeség és zsibbadás jellemez. A betegség érinti a perifériás idegrendszert és jellemzően valamilyen fertőzés hatására alakul, ami előidézi az immunmediált idegek hibás működését. Az érintettek közül sokan észlelnek érzékelésbeli változást vagy számolnak be fájdalom kialakulásáról majd ezt követően a lábakat, később a kezeket érintő izomgyengeségről, ami gyorsan kifejlődik (fél és két nap között). A Guillain–Barré-szindróma károsítja a perifériás idegeket körülvevő mielint, aminek eredményeképp az idegi impulzusok átvitele megszakad, hasonlóan, mint a sclerosis multiplex esetében. Az akut fázis során, a betegség életveszélyessé is válhat, körülbelül a betegek negyede igényel intenzív osztályi ellátást, gépi lélegeztetést a légzés mesterséges fenntartása miatt. Néhány betegnél előfordulhat az autonóm idegrendszer működésbeli hullámzása, ami veszélyes, abnormális szívveréshez és vérnyomáshoz vezethet.
A klinikai diagnózis megállapítása többnyire a hasonló tüneteket okozó betegségek kizárásán keresztül történik, alátámasztva különböző tesztekkel ilyen az ingervezetési vizsgálat és az agy-gerincvelői folyadék vizsgálata. Különböző típusait különböztetjük meg, attól függően, hogy milyen területet érint az izomgyengeség, mi az ingervezetési vizsgálat eredménye és milyen anti-gangliozid antitestek vannak jelen. Azokban az esetekben, ahol súlyos izomgyengeség mutatkozik, az intravénás immunglobulin vagy plazmaferezis melletti támogató ápolás többségében jó felépüléshez vezet, ennek ellenére néhány betegnél előfordulhat folyamatos járásnehézség, fájdalomérzet és nehéz légzés. A Guillain–Barré-szindróma ritka, minden 100 000 emberből egy, kettő érintett éves szinten. A betegség Georges Guillain és Jean Alexandre Barré francia orvosok után kapta, a nevét, akik André Strohl-lal együtt 1916-ban leírták a betegséget.
Tünetei
A betegség első tünetei a zsibbadás és bizsergő érzés, izomgyengeség és fájdalom. Ezek külön-külön, együtt vagy valamilyen kombinációban is jelentkezhetnek. Ezt követően jelenik meg az alsó végtagok és a karok szimmetrikus gyengesége, ami idővel fokozódik.[1] Az izomgyengeség maximális súlyosságának elérése fél nap és két hét között ingadozhat, ezt követően állandósul.[1] Ötből egy embernél az izomgyengeség tovább folytatódik egészen négy hétig.[2] A nyak izmai szintén érintettek lehetnek, és körülbelül a betegek felénél a fej mozgatásáért és az arcizmokért felelősek agyidegek is érintettek. Emiatt előfordulhat arcizom-gyengeség, nyelési nehézség és néha a szemmozgató izmok gyengesége is.[2] Az esetek 8%-ban az izomgyengeség csak a lábakat érinti.[2] A húgyhólyagért és a végbélnyílásért felelős izmok érintettsége nem jellemző.[1] Az összes Guillain–Baré-szindróma által sújtott ember harmada nem veszíti el később se a járás képességét. Amikortól az izomgyengeség nem fokozódik tovább, beáll egy stabil állapot (remisszió) mielőtt javulás lenne észrevehető. A remisszió két naptól hat hónapig tarthat, azonban a medián időtartam egy hét.[2] Fájdalommal kapcsolatos tünetei az emberek több, mint felének vannak, beleértve a hátfájdalmakat, fájdalmas bizsergés érzését, izomfájdalmat és a fejjel és nyakkal kapcsolatos fájdalmakat, amik az agyhártya gyulladáshoz kapcsolhatóak.[2]
Sok Guillain–Barré-szindrómás beteg számolt be arról, hogy a konkrét neurológiai tünetek megjelenése előtt 3-6 héttel már érzékelte a fertőzés tüneteit magán. Ezek a tünetek lehettek felső légúti vagy hasmenéses tünetek.[1]
Gyermekeknél, különösen a hat éves kornál fiatalabbaknál, a diagnózis megállapítás nehézkes lehet és a fájdalommal és a nehézkes járással kapcsolatos panaszok is az elején gyakran félrevezetőek és más kiváltó okot feltételeznek, mint vírusos fertőzés[2] vagy ízületi és csont problémák.[3]
A neurológia vizsgálat során a betegség tipikus jellemzői a csökkent izomerő és a csökkent vagy teljesen hiányzó saját reflex. Azonban az emberek egy kis csoportjánál, mielőtt teljes reflexhiány lépne fel az érintett végtagokban a reflex normális, sőt néhányuknál a reflexek még fokozódtak is.[2] A Guillain–Barré-szindróma Miller Fisher féle szubtípusánál a szemizom-gyengeség markánsabban jelenik meg és ami mellett koordinációs problémával (ataxia) is előfordulhat.[1] Az öntudat normál esetben nincs érintve a Guillain–Barré-szindrómánál, azonban a "Bickerstaff-féle agyvelőgyulladás" szubtípus esetén előfordulhat aluszékonyság, álmosság vagy akár kóma is.[4][5]
Légzési elégtelenség
A betegség által érintett emberek 25%-nál fejlődik ki a légzőizmok gyengesége, ami aztán légzési elégtelenséghez vezet, ami miatt a szervezet nem tudja fenntartatni a vérben az egészséges oxigén és/vagy széndioxid szintet.[1][2][6] Emiatt szükség lehet intubációra és a légzés mesterséges támogatására lélegeztető gép segítségével, ez általában intenzív osztályon történik. A lélegeztető gép szükségessége előre jelezhető két légzésteszttel: erőltetett vitálkapacitás (FVC) és negatív belégzési erő (NIF). Amennyiben az FVC értéke kevesebb, mint 15 ml per testtömeg kilogramm vagy az NIF értéke kevesebb, mint 60 cmH2O akkor ezek súlyos légzési elégtelenségre utalnak.[7] Azon emberek 60%-nál, akiknek lélegeztetőgépre van szükségük, ez az életveszélyes helyzet tovább komplikálódik egyéb egészségügyi problémával is, mint például tüdőgyulladás, súlyos fertőzések, tüdőembólia és az emésztőrendszer vérzése.[1]
Az autonóm idegrendszer hibás működése
Az autonóm idegrendszer szabályozza a szervezet belső környezetét tehát felel a pulzusért és a vérnyomás fenntartásáért is. A Guillain–Barré-szindrómában szenvedő emberek kétharmadánál a betegség erre is hatással van, azonban ennek hatás az egyes embereknél változó.[2] Húsz százalékuknál tapasztalható súlyosan ingadozó vérnyomás és rendszertelen szívverés, amely akár addig is súlyosbodhat, hogy megáll a szívverés és szívritmus-szabályozót kell alkalmazni.[1] Egyéb, kapcsolódó problémák még az abnormális verejtékezés és a pupilla reflex megváltozása.[4] Az autonóm idegrendszer hibás működése még azokat is érinthet, akiknél nem jelentkezik súlyos izomgyengeség.[4]
Okok
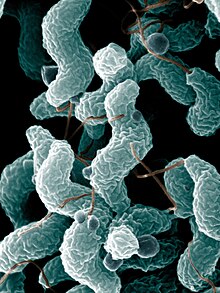
A Guillain-Barré szindrómában szenvedő emberek kétharmada tapasztalt fertőzést a betegség panaszainak megjelenése előtt. Ezek a fertőzések leginkább emésztőrendszeri és légzőszervet érintőek voltak. Sok esetben a pontos fertőzés is megállapítható volt.[2] Megközelítőleg az esetek 30%-ban a Campylobacter jejuni volt a kiváltó ok, ami hasmenést okoz. Az esetek további 10%-a citomegalovírusoknak (CMV, HHV-5) tulajdonítható. Mindezek ellenére, csak néhány olyan embernél fejlődik ki Guillain–Barré-szindróma, akik Campylobacter-rel vagy CMV-vel fertőződtek (0,25-0,65 per 1000 eset és 0,6-2,2 per 1000 epizód, külön-külön).[1] Az érintett Campylobacter törzstől függhet a GBS kockázata. A baktérium különböző formáinak a felszínén különböző lipopoliszacharidok találhatóak és amíg néhányuk kiválthatja a betegséget, mások nem váltják ki.[2]
A GBS és más fertőzések kapcsolata jóval bizonytalanabb. Két másik herpeszvírus (Epstein-Barr vírus/HHV-4 és varicella zoster vírus/HHV-3) és a Mycoplasma pneumoniae baktérium összefüggésbe hozható a GBS-szel.[1] A trópusi vírusfertőzés a Dengue-láz szintén kapcsolatba hozható a GBS bizonyos eseteivel.[8] A Guillain–Barré-szindrómás embereknél jóval gyakrabban állapítottak meg hepatitisz E vírusfertőzést előzőleg.[2]
Néhány esetet kiválthatott influenza vírus és influenza oltás. 1976-os sertésinfluenza járvány utáni influenza immunizációt követően megnövekedett a Guillain–Barré-szindrómás betegek száma. 1 000 000 beoltott között 8,8-nál fejlődött ki a betegség. Azóta, a vakcinációnak tulajdonítható esetek közeli megfigyelése bebizonyította, hogy az influenza maga is képes GBS-t okozni. Az esetek kisszámú megnövekedését figyelték meg időszakos oltási kampányok során, azonban nem azonos mértékben.[9] A 2009-es influenza oltás (H1N1/PDM09 ellen kifejlesztett) nem okozott jelentős növekedést a megbetegedések között.[1] Az influenza oltás előnyei nagyobb haszonnal járnak, mint az annak következtében kialakuló GBS megbetegedés kis kockázata.[10] Oltási szempontból még azok is biztonságosnak tekinthetőek jövőbeli oltási szempontból, akiknél előzőleg GBS alakult ki.[2] Egyéb vakcinák esetében, mint a járványos gyermekbénulás elleni, vagy a tetanusz és a kanyaró elleni vakcinák esetében nem találtak összefüggést a GBS-szel.[3]
Patogenezis

A Guillain–Barré-szindróma során az idegek rendellenes működését az immunrendszernek perifériás idegrendszer idegsejtjei és támogató struktúrái ellen indított támadása okozza. Az idegsejt sejttestei (soma vagy perikaryon) a gerincvelőben találhatóak és azok hosszú nyúlványai (axon) szállítják az idegi elektromos impulzusokat a neuromuszkuláris szinapszishoz, ahol aztán az impulzus továbbjut az izom felé. Az axonokat mielint tartalmazó ún. Schwann-sejtek borítják. Két Schwann-sejt között az axonnak egy-egy velőshüvely nélküli szakasza látható.[1] Ez a Ranvier-féle befűződés. Különböző típusú Guillain–Barré-szindrómák jellemzője a immunrendszer különféle támadása. A betegség demyelinizációs szubtípúsa (AIDP, lásd lejjebb) során fehérvérsejtek (T-limfociták és makrofágok) támadják meg a mielin burkot. Ezt a folyamatot megelőzi a vérben található proteinek egy csoportjának az aktiválódása. Ezzel szemben az axonális szubtípusnál IgG antitestek és a komplement fehérjék közvetlenül támadják az axont borító sejtmembránt, limfocita sejtek nélkül.[1]
A Guillain–Barré-szindróma axonális formájánál (de nem a demyelinizációs szubtípusnál) közvetlenül az idegsejtet támadó különböző antitestekről számoltak be. Ezek gangliozid molekulákhoz kapcsolódnak, az anyag csoportjait megtalálták a periferiális idegeknél. A gangliozid egy keramidot tartalmazó molekula, amely a hexóz típusú cukrok egy kis csoportjához kötődik és számos N-acetil neuraminsav csoportot tartalmaz. A négy kulcsfontosságú az antitestek által megtámadott gangliozid molekulák a GM1, GD1a, GT1a és GQ1b. A különböző anti-gangliozid antitesteket különböző tulajdonságok kapcsolhatók; például a GQ1b molekulához kapcsolódó antitest összefüggésbe hozható a GBS Miller Fisher-féle szubtípusával és kapcsolódó formáival beleértve a Bickerstaff-féle agyvelőgyulladást.[1] Ilyen típusú antitestek fertőzés utáni termelése valószínűleg molekuláris mimikri következménye, ahol az immunrendszer mikrobiákból eredő anyagokra reagál, azonban ennek eredményeként létrejövő antitestek a szervezetben természetesen is létező epitópokkal is reakcióba lépnek..[1][11] Campylobacter fertőzést követően, a szervezet IgA osztályú antitesteket kezd el termelni, azonban az emberek egy kis csoportja IgA mellett IgG antitesteket is termel a mikrobiákból származó anyagokkal szemben (pl. lipooligoszacharidok, azaz O-láncot nem tartalmazó, ún. nyers LPS), amelyek keresztkölcsönhatásba kerülnek az emberi idegsejt gangliozid molekuláival. Jelenleg nem ismert, hogy ez a folyamat, hogyan kerüli meg a gangliozidokkal szembeni centrális toleranciát, aminek el kellene nyomnia a szervezet saját anyagaival szembeni antitest termelést.[12] Nem mindegyik anti-gangliozid antitest okoz betegséget, és nemrég felmerült azaz elképzelés, hogy néhány antitest több, mint egy típusú epitóphoz képes egyszerre kapcsolódni (heterodimér kötődés) és ez határozza meg a választ. Továbbá, a patogenikus antitestek kifejlődése függhet egyéb, a bélben élő baktérium törzstől.[12]
Diagnózis
A Guillain–Barré-szindróma diagnózisa olyan ténymegállapításoktól függ, mint az izombénulás gyors kifejlődése, reflexhiány, lázhiány és egy valószínűsítő esemény. A diagnózis alátámasztására rendszerint agy-gerincvelői folyadék vizsgálatot (gerinccsapoláson keresztül) és ingervezetési vizsgálatot szoktak elvégezni.[1][2] Anti-gangliozid antitestekre való tesztet szintén sokszor végezne, azonban a diagnózis megállapításához való hozzájárulásuk többnyire korlátozott.[2] Vértesztet elvégzése szintén bevett gyakorlat, hogy kizárhassák a gyengeség egyéb okozóit, mint a vér alacsony kálium szintjét (hypokalaemia).[1] Az abnormálisan alacsony nátrium szint gyakran előfordul Guillain–Barré-szindrómánál. Ez a nem hatékony antidiuretikus hormon elválasztás (Schwartz–Bartter-szindróma) következménye, ami fokozott vízvisszatartáshoz vezet (vízmérgezés).[13]
Számos esetben, a gerincvelőn MRI vizsgálatot alkalmaznak, hogy megkülönböztessék a Guillain–Barré-szindrómát egyéb, végtag gyengeséget okozó, panaszoktól, mint például a gerincvelői kompresszió.[1][2] Amennyiben az MRI viszgálat az gerincvelői ideggyökök megnövekedését mutat, az utalhat GBS-re.[2]
Gerincvelői folyadék
Az agyat és a gerincvelőt agy-gerincvelői folyadék veszi körül és a gerinccsapolás során a keresztcsigolyák közé szúrt kis tű segítségével vesznek mintát a folyadékból. A Guillain–Barré-szindróma egy jellemzője a megemelkedett protein szint alacsony számú fehérvérsejt mellett (albumin citológiai elválasztás). Ez a tulajdonság számos egyéb betegségtől (limfóma, járványos gyermekbénulás) megkülönbözteti a BGS-t, amely esetekben viszont mind a fehérje és a fehérvérsejt szám emelkedett szintet mutat. Mindezek ellenére, a tünetek megjelenését követő első pár nap után a gerinccsapolás a BGS-szel rendelkező emberek 50%-ban, az első hét utána az emberek 80%-ban nem vezet eredményre, ennek következményeként a normál eredmények nem zárják ki a BGS-t.[2]
Ismételt gerinccsapolás a betegség alatt nem ajánlott. A fehérje szintek emelkedhetnek a beavatkozást következtében.[2]
Neurofiziológia
Elektrodiagnosztikai vizsgálatok, mint a tűs elektromiográfia (EMG) és idegvezetési vizsgálatok meghosszabbodott disztális lappangási időt, ingervezetési lassulást, ingervezetés megszakadást és a demyelinizációs esetekben a motoros ideg akciós potenciáljának (CMAP) szóródását mutathatják.[14] Az F-hullámok és a H-reflexek meghosszabbodhatnak vagy teljesen hiányozhatnak. Tűs elektromiográfia vizsgálat gyakran normális súlyos eseteknél. Csökkent, neuropatikus gyógyulás látható a gyenge izmokban. Amennyiben valamekkora axonális sérülés történt a betegség kialakulását követő háromtól négy hétig terjedő időszakban, akkor fibrilláció, izomremegés látható a tűs EMG során. Elsődleges axonális sérülés esetén a jellemzők magukban foglalják az akciós potenciál csökkent amplitúdóját ingervezetési lassulás nélkül.
Klinikai szubtípusok
A Guillain–Barré-szindróma több szubtípusa ismert.[2][14] Ennek ellenére, számos embernél tapasztalhatóak olyan tünetek, amelyek egymást átfedik és a pontos osztályozást nehezítik.[4][15] Minden szubtípusnak van részleges formája. Például, néhány ember csak izolált szemmozgásbeli vagy koordinációs problémát észlel; ezeket tüneteket a Miller Fisher típusú szindrómához kapcsolják és hasonló anti-gangliozid antitest mintákat is produkál. [15]
| Típus | Tünetek | Érintett populáció | Idegvezetési vizsgálatok | Anti-gangliozid antitest |
|---|---|---|---|---|
| Súlyos gyulladásos demyelinizációs polineuropátia
(AIDP) |
Szenzoros tünetek és izom gyengeség, gyakran koponya ideggyengeséggel és a vegetatív idegrendszert is érinti | Legelterjedtebb Európában és Észak-Amerikában | Demyelinizációs polineuropátia | Nincs egyértelmű összefüggés |
| Súlyos motoros axonális neuropátia
(AMAN) |
Részleges izomgyengeség, az esetek kevesebb, mint 10%-ban szenzoros tünetek nélkül, koponya idegek érintettsége nem jellemző | Ritka Európában és Észak-Amerikában, jelentősen elterjedt Ázsiában, Közép- és Dél-Amerikában | Axonális polineuropátia, normál szenzoros akciós potenciál | GM1a/b, GD1a & GalNac-GD1a |
| Súlyos motoros és szenzoros axonális neuropátia
(AMSAN) |
Súlyos izomgyengeség, hasonlóan, mint az AMAN-nál de szenzoros tünetekkel | - | Axonális polineuropátia, csökkent vagy hiányzó szenzoros akciós potenciál | GM1, GD1a |
| A garatot, a nyakat és a karokat érintő változat | Főként a garatot, a nyakat, az arcot és vállizmokat érintő gyengeség | - | Általában normális, néha axonális neuropátia a karkoban | Főként GT1a, esetenként GQ1b, ritkán GD1a |
| Miller Fisher-szindróma | Ataxia, szemizom-gyengeség, reflexhiány, de többnyire végtaggyengeség nélkül | Ez a változat elterjedtebb a férfiak, mint a nők körében (2:1 arányban). A megbetegedések tipikusan tavasszal fordulnak elő és az érintettek átlagéletkora 43 év.[16] | Általában normális, néha diszkrét változás a szenzoros idegek vezetésében, H-reflex megállapítása | GQ1b, GT1a |
A Guillain–Barré-szindróma teljes diagnosztikai lefedettsége érdekében sokszor több, egyéb vizsgálatot is bevonnak. A Bickerstaff-féle agyvelőgyulladásra ma például a Miller Fisher-szindróma egy fajtájaként tekintenek, ahogy az ehhez kapcsolódó egyik állapota is, amit, úgy jellemeznek, mint "súlyos ataxiás alváshiány"-t, ahol a koordináció és az álmosság jelen vannak, azonban nem érzékelhető izomgyengeség.[15] BBE jellemzői a súlyos szemizombénulás (oftalmoplégia), ataxia és tudatzavar, illetve hozzá kapcsolható még a hiányzó vagy csökkent saját reflex és a Babinski reflex (talpi reflex).[15] A betegség lefolyása lehet egyfázisú vagy visszaeső. Nagyszámú, szabálytalan, hiperintenzív károsodásokat írtak le főként az agytörzsben, különösen a hídban (nyúltvelőt a középaggyal összekötő rész), a középagyban és a nyúltvelőben. A súlyos, kezdeti tünetei ellenére a BBE prognózisa jónak mondható. Az MRI kritikus szerepet játszik a BBE diagnózisában. Jó pár BBE beteghez társítottak axonális Guillain–Barré-szindrómát, ami feltételezi, hogy a két betegség szorosan kapcsolódik egymáshoz.
Jelenleg vita tárgyát képezi, hogy az önálló súlyos érzékvesztés tekinthető-e a Guillain–Barré-szindróma egy formájának; ennek előfordulása ritka, összehasonlítva az olyan GBS-szel, ahol izomgyengeség érzékelhető azonban nincsenek érzékeléssel kapcsolatos tünetek.[10]
Kezelése
Immunterápia
Utólagos kezelésébe beletartozik a szervezet idegrendszer elleni támadásának csökkentése plazmaferezisen keresztül vagy az antitestek véráramból történő kiszűrésével, vagy intravénás immunglobulin-kezelés (IVIg) alkalmazásával annak érdekében, hogy ártalmatlanítsa a káros antitesteket és csökkentse a gyulladást. A két kezelés egyformán hatásos és a kettő kombinációja nem bír jelentősen jobb hatással, mint külön-külön.[17] A plazmaferezis alkalmazása a tünetek megjelenését követő négy héten belül meggyorsítja a felépülést.[18] Az IVIg ugyanolyan hatékony, mint a plazmaferezis, amennyiben a tünetek megjelenését követő két hétben kezdik el alkalmazni és kevesebb szövődménye is van.[18] Többnyire az IVIg-et alkalmazzák először a könnyű alkalmazhatóság és gyógyszerbiztonsági profilja miatt. A használata nem kockázatmentes; néha okozhat májgyulladást vagy ritka esetekben vese elégtelenséget.[19] A glükokortozidokat önmagukban nem találták hatásosnak a felépülés meggyorsításában és potenciálisan késleltetheti is azt.[20]
Fájdalom
A fájdalom jellemző tünete a Guillain–Barré-szindrómában szenvedő betegeknek, azonban a tanulmányok azt mutatják, hogy a fájdalom csökkentésére használt különböző kezelések között nincs olyan különbség, ami miatt ajánlani lehetne egy bizonyosat.[21]
Rehabilitáció
Az akut fázist követően a rehabilitációs kezelés sokszor tartalmazza több tudományágat átfogó csapat segítségét, akik elsősorban a beteg mindennapi tevékenységeinek hatékonyabb elvégzésére, segítésére fókuszálnak. Munkaterapeuta felajánlhat olyan eszközt (mint kerekesszék vagy evőeszközök), ami megkönnyíti a beteget mindennapi teendőinek független ellátásában. Gyógytornász segít a megfelelő funkcionális mozgások elsajátításában, elkerülve a különböző kompenzációs mozgásokat, amelyek hosszútávon negatívan befolyásolhatják a felépülést. Emellett néhány bizonyíték azt támasztja alá, hogy a fizioterápia segít, hogy a Guillain–Barré-szindrómás beteg újra visszanyerje az erejét, állóképességét és járásminőségét,[22] ugyanakkor megelőzi az izommerevedéseket, felfekvéseket és a kardiopulmonáris (szív-tüdő) nehézségeket.[23] Beszédterapeuták segítenek visszaszerezni a beszéd és nyelési képességet, különösen olyan betegeknél, akiket intubáltak vagy gégemetszésen estek át. Sem az amantadint, sem az aszkorbinsavat nem találták hatékonynak fáradtság ellen.[24]
Prognózis
A Guillain–Barré-szindróma halálos kimenetelű is lehet, amennyiben különböző komplikációk lépnek fel, úgy mint súlyos fertőzések, vérrögök vagy szívleállás az idegrendszer helytelen működése miatt. A megfelelő kezelés ellenére ez az esetek 5%-ban bekövetkezik.[1]
A legtöbb betegnél a tünetek erősödnek az első és harmadik közötti időszakban.[1] A felépülés többnyire a betegséget követő negyedik héttől kezdődik, azonban felépülés gyorsasága és mértéke változó.[1] Körülbelül a betegek 80%-a teljesen felépül néhány hónaptól egy évig terjedő időszakon belül, azonban egy kisebb részüknél néhány tünet állandósulhat, mint például a reflexhiány. A betegek kb. 5-10%-a épül fel valamilyen súlyos rokkantsággal, a legtöbb ilyen esetben súlyos proximális motoros és szenzoros axonnál sérülés marad vissza az axonális regeneráció képtelenségével. A betegek kb. 5-10% tapasztal egyszeri vagy többszöri visszaesést, amely eseteket ezután úgy osztályoznak, mint krónikus gyulladásos demyelinizációs polineuropátia.
Kutatási tanulmányokban Guillain–Barré-szindrómás eseteket egy 0-tól 6-ig terjedő skálán rögzítenek, ahol a 0 a teljesen egészségeset jelenti, az 1 a nagyon enyhe tünetekkel rendelkező de még futni képes beteget, 2 az a skálán aki képes járni de nem képes futni, 3 az akinek botra vagy egyéb támogató eszközre van szüksége, 4 az ágy vagy kerekesszékhez kötött, 5 akinek hosszabb távon szüksége van valamilyen légzést segítő eszközre, 6 halál.[25]
A Guillain–Barré-szindróma prognózisát többnyire a kor határozza meg (a 40 év fölöttieknek rosszabb a kilátásuk), és betegség két hét utáni súlyossága. Továbbá azoknak a prognózisa, akik hasmenésben szenvedtek a betegség kialakulása előtt szintén rosszabb.[6] Annak akinél az idegvezetési vizsgálatok során ingervezetés megszakadását mutatja, 6 hónapos időtávban szintén rosszabb a kilátása.[6] Azoknak, akik intravénás immunglobulin-kezelést (IVIg) kaptak és két héttel a kezelés után a vérben található IgG alacsony megemelkedését mutatták ki, szintén gyengébbek a kilátásai 6 hónapos időtávban, mint azoknak, akiknek az IgG szintjük jelentősen megnőtt.[6]
Epidemiológia
A Nyugati országokban, az évi esetszámot 0,89 és 1,89 közé teszik 100 000 emberenként. Gyermekek és fiatal felnőttek kevésbé érintettek, mint az idősek. Az ő esetükben az élet minden tizedik évével a kockázat 20%-kal folyamatosan emelkedik.[26] A férfiaknál nagyobb valószínűséggel fejlődik a Guillain–Barré-szindróma, mint a nőknél. A férfiak relatív kockázata 1,78 a nőkkel összehasonlítva.[1][26]
A különböző szubtípusok elterjedtsége jelentősen változik országonként. Európában és az Egyesült Államokban az érintett emberek 60-80%-nak a betegség demyelinizációs szubtípusa (AIDP) jelentkezik, az AMAN típusú csak kis számú (6-7%) embert érint. Ázsiában és Közép- és Dél-Amerikában ez az arány jóval magasabb (30-65%). Ez valószínűleg az emberek különféle betegségnek való kitettsége miatt van így, de köze lehet az adott populáció genetikai karakterisztikájához is.[2] A Miller Fisher féle változatáról úgy gondolják, hogy jóval gyakoribb Délkelet-Ázsiában.[1][5]
Története

Egy francia orvos Jean-Baptiste Octave Landry volt az, aki először leírta a betegséget 1859-ben.[28] 1916-ban Georges Guillain, Jean Alexandre Barré és André Strohl két katonát diagnosztizáltak a betegséggel és írták le a betegség alapvető diagnosztikai jellemzőit, az agy-gerincvelői folyadékban megnőtt fehérje koncentrációt de normál fehérvérsejt szám mellett.[4]
Egy kanadai neurológus C. Miller Fisher volt, aki a betegség egy variánsát leírta 1956-ban és aztán, akiről elnevezték ezt a szubtípust.[5][29] Egy brit neurológus Edwin Bickerstaff és Philip Cloake voltak azok, akik az agyvelőgyulladásos szubtípust leírták 1951-ben és hozzájárultak később a betegség jobb megértéséhez egy 1957-ben írt tanulmánnyal.[5][30][31] Guillain ezen tulajdonságok némelyikét már leírta, mielőtt megjelentették volna a betegség teljes leírást 1938-ban.[5] További szubtípusokat írtak le azóta, mint például azt a változatát, amelyik teljes ataxiát okoz és azt a típust, amelyik elsősorban garat, a nyak és a karok gyengeségével jár.[5] Az axonális szubtípust először 1990-ben írták le.[11]
Miután számos eset összeköthető volt egy sertésinfluenza oltással a diagnosztikai kritérium tovább fejlődött a késő 1970-es években. Ezeket később tovább finomították 1990-ben.[2][32] Vakcináció biztonsági szempontól az esetleírást a Brighton Collaboration 2009-ben átnézte,[33] de ennek főként kutatási célja volt.[2] Plazma cserét először 1978-ban alkalmaztak és a hatékonyságát megerősítették nagyobb tanulmányokban 1985-ben.[34] Az intravénás immunglobulint 1988-ban vezették be és korai 1990-es évek tanulmányaiban bebizonyították a plazma cserével egyenértékű hatását.[34]
Kutatási irányok
Guillain–Barré-szindróma működési mechanizmusának megértésében előrelépés történt az elmúlt években.[10] Új kezelési eljárások kifejlesztése korlátozott az 1980-as és 90'-es években bevezetett immunterápia óta..[10][34] A jelenlegi kutatások arra irányulnak, hogy bebizonyítsák, hogy vajon azoknak a betegeknek, akik kaptak előzőleg intravénás immunglobulint, hasznot jelentene-e egy második IVIg amennyiben a vérben mért antitestek szintje a kezelést követően csak kis mértékű emelkedést mutatott.[6][34] Az immunszuppresszív gyógyszerekkel (mycophenolate mofetil, agyi eredetű neurotrof faktor és béta Interferon (IFN-β)) végzett tanulmányok nem támasztották alá hasznosságukat, hogy támogassák széleskörűen használatukat.[34]
A tanulmányokban gyakran használnak állat modelleket (kísérleti autoimmun neuritis patkányokban) és néhány ágens ígéretesnek tűnik: glatiramer-acetát, quinpramine, fausadil (a Rho-kináz enzim egy inhibitora),[10] és egy szívgyógszer a flecainide.[34] Laboratóriumi kutatások során egy anti-GD3 anti-gangliozid antitestet elleni antitest hatékonynak bizonyult.[10] A komplement rendszer (immunrendszert kiegészítő rendszer) GBS-ben betöltött szerepe valószínűsíti, hogy a komplement inhibitorok (mint az eculizumab gyógyszer) hatásosak lehetnek.[34]
Jegyzetek
- ↑ a b c d e f g h i j k l m n o p q r s t u v w (2012. június 14.) „Guillain–Barré Syndrome”. New England Journal of Medicine 366 (24), 2294–2304. o. DOI:10.1056/NEJMra1114525. PMID 22694000.
- ↑ a b c d e f g h i j k l m n o p q r s t u v w (2014. július 15.) „Guillain–Barré syndrome: pathogenesis, diagnosis, treatment and prognosis”. Nature Reviews Neurology 10 (8), 469–482. o. DOI:10.1038/nrneurol.2014.121. PMID 25023340.
- ↑ a b (2013. december 1.) „Pediatric Guillain-Barré syndrome”. Current Opinion in Pediatrics 25 (6), 689–693. o. DOI:10.1097/MOP.0b013e328365ad3f. PMID 24240288.
- ↑ a b c d e (2008. október 1.) „Clinical features, pathogenesis, and treatment of Guillain-Barré syndrome”. The Lancet Neurology 7 (10), 939–950. o. DOI:10.1016/S1474-4422(08)70215-1. PMID 18848313.
- ↑ a b c d e f (2012. szeptember 15.) „Bickerstaff brainstem encephalitis and Fisher syndrome: anti-GQ1b antibody syndrome”. Journal of Neurology, Neurosurgery & Psychiatry 84 (5), 576–583. o. DOI:10.1136/jnnp-2012-302824. PMID 22984203.
- ↑ a b c d e van Doorn PA, Kuitwaard K, Walgaard C et al (2010. május 1.). „IVIG treatment and prognosis in Guillain-Barré syndrome”. Journal of Clinical Immunology 30 Suppl 1, S74–8. o. DOI:10.1007/s10875-010-9407-4. PMID 20396937.
- ↑ Dimachkie MM, Barohn RJ (2013. május 1.). „Guillain-Barré syndrome and variants”. Neurology Clinics 31 (2), 491-510. o. DOI:10.1016/j.ncl.2013.01.005. PMID 23642721.
- ↑ Carod-Artal FJ, Wichmann O, Farrar J, Gascón J (2013. szeptember 1.). „Neurological complications of dengue virus infection”. The Lancet Neurology 12 (9), 906-19. o. DOI:10.1016/S1474-4422(13)70150-9. PMID 23948177.
- ↑ Lehmann HC, Hartung HP, Kieseier BC, Hughes RA (2010. szeptember 1.). „Guillain-Barré syndrome following influenza vaccination”. The Lancet Infectious Diseases 10 (9), 643–51. o. DOI:10.1016/S1473-3099(10)70140-7. PMID 20797646.
- ↑ a b c d e f (2013. június 1.) „Update on Guillain-Barré syndrome”. Journal of the Peripheral Nervous System 18 (2), 99–112. o. DOI:10.1111/jns5.12020. PMID 23781958.
- ↑ a b Kuwabara S, Yuki N (2013. december 1.). „Axonal Guillain-Barré syndrome: concepts and controversies”. The Lancet Neurology 12 (12), 1180-8. o. DOI:10.1016/S1474-4422(13)70215-1. PMID 24229616.
- ↑ a b (2013. szeptember 1.) „Glycolipid antigens and autoantibodies in autoimmune neuropathies”. Trends in Immunology 34 (9), 453–459. o. DOI:10.1016/j.it.2013.05.001. PMID 23770405.
- ↑ Spasovski G, Vanholder R, Allolio B et al (2014. február 25.). „Clinical practice guideline on diagnosis and treatment of hyponatraemia”. European Journal of Endocrinology 170 (3), G1-47. o. DOI:10.1530/EJE-13-1020.
- ↑ a b Uncini A, Kuwabara S (2012. augusztus 1.). „Electrodiagnostic criteria for Guillain-Barrè syndrome: a critical revision and the need for an update”. Clinical Neurophysiology 123 (8), 1487-95. o. DOI:10.1016/j.clinph.2012.01.025. PMID 22480600.
- ↑ a b c d Wakerley BR, Uncini A, Yuki N; GBS Classification Group (2014. szeptember 1.). „Guillain-Barré and Miller Fisher syndromes--new diagnostic classification”. Nature Reviews Neurology. 10 (9), 537-44. o. DOI:10.1038/nrneurol.2014.138. PMID 25072194.
- ↑ Mori M, Kuwabara S, Yuki N (2012. január 1.). „Fisher syndrome: clinical features, immunopathogenesis and management”. Expert Rev Neurother 12 (1), 39-51. o. DOI:10.1586/ern.11.182. PMID 22149656.
- ↑ (2014. szeptember 19.) „Intravenous immunoglobulin for Guillain-Barré syndrome.”. The Cochrane Database of Systematic Reviews 9, CD002063. o. DOI:10.1002/14651858.CD002063.pub6. PMID 25238327.
- ↑ a b Hughes RA, Wijdicks EF, Barohn R, Benson E, Cornblath DR, Hahn AF, Meythaler JM, Miller RG, Sladky JT, Stevens JC (2003. szeptember 1.). „Practice parameter: immunotherapy for Guillain-Barré syndrome: report of the Quality Standards Subcommittee of the American Academy of Neurology”. Neurology 61 (6), 736–40. o. DOI:10.1212/WNL.61.6.736. PMID 14504313.
- ↑ Dantal J (2013. október 1.). „Intravenous immunoglobulins: in-depth review of excipients and acute kidney injury risk”. American Journal of Nephrology 38 (4), 275-84. o. DOI:10.1159/000354893. PMID 24051350.
- ↑ (2012. augusztus 15.) „Corticosteroids for Guillain-Barré syndrome.”. The Cochrane Database of Systematic Reviews 8, CD001446. o. DOI:10.1002/14651858.CD001446.pub4. PMID 22895921.
- ↑ (2013. október 20.) „Pharmacological treatment for pain in Guillain-Barré syndrome.”. The Cochrane Database of Systematic Reviews 10, CD009950. o. DOI:10.1002/14651858.CD009950.pub2. PMID 24142399.
- ↑ Davidson I, Wilson C, Walton T, Brissenden S (2009). „Physiotherapy and Guillain–Barré syndrome: Results of a national survey”. Physiotherapy 95 (3), 157–163. o. DOI:10.1016/j.physio.2009.04.001. PMID 19635334.
- ↑ Karavatas SG (2005). „The role of neurodevelopmental sequencing in the physical therapy management of a geriatric patient with Guillain–Barre syndrome.”. Topics in Geriatric Rehabilitation 21 (2), 133–135. o. DOI:10.1097/00013614-200504000-00008.
- ↑ (2014. december 18.) „Interventions for fatigue in peripheral neuropathy.”. The Cochrane database of systematic reviews 12, CD008146. o. DOI:10.1002/14651858.CD008146.pub2. PMID 25519471.
- ↑ Hughes RA, Swan AV, Raphaël JC, Annane D, van Koningsveld R, van Doorn PA (2007. szeptember 1.). „Immunotherapy for Guillain-Barré syndrome: a systematic review”. Brain 130, 2245–57. o. DOI:10.1093/brain/awm004. PMID 17337484.
- ↑ a b (2011. július 27.) „Population incidence of Guillain-Barré syndrome: a systematic review and meta-analysis”. Neuroepidemiology 36 (2), 123–133. o. DOI:10.1159/000324710. PMID 21422765.
- ↑ (1998. május 1.) „Georges Guillain's neurologic exploration of America”. Neurology 50 (5), 1451–1455. o. DOI:10.1212/WNL.50.5.1451. PMID 9596004.
- ↑ {{cite journal| last1=Landry | first=Jean-Baptiste | title=Note sur la paralysie ascendante aiguë | journal=Gazette Hebdomadaire de Médecine et de Chirurgie | date=1859 | volume=6 | pages=472–474, 486–488} | Link}
- ↑ Fisher M (1956). „An unusual variant of acute idiopathic polyneuritis (syndrome of ophthalmolplegia, ataxia and areflexia)”. N. Engl. J. Med. 255 (2), 57–65. o. DOI:10.1056/NEJM195607122550201. PMID 13334797.
- ↑ (1951. július 14.) „Mesencephalitis and rhombencephalitis.”. British Medical Journal 2 (4723), 77-81. o. DOI:10.1136/bmj.2.4723.77. PMID 14848512.
- ↑ (1957. június 15.) „Brain-stem encephalitis; further observations on a grave syndrome with benign prognosis.”. British Medical Journal 1 (5032), 1384-7. o. DOI:10.1136/bmj.1.5032.1384. PMID 13436795.
- ↑ (1990. július 27.) „Assessment of current diagnostic criteria for Guillain-Barré syndrome.”. Annals of Neurology 27 Suppl, S21-4. o. DOI:10.1002/ana.410270707. PMID 2194422.
- ↑ (2011. január 1.) „Guillain–Barré syndrome and Fisher syndrome: Case definitions and guidelines for collection, analysis, and presentation of immunization safety data”. Vaccine 29 (3), 599–612. o. DOI:10.1016/j.vaccine.2010.06.003. PMID 20600491.
- ↑ a b c d e f g (2011. március 1.) „Emerging drugs for Guillain-Barré syndrome”. Expert Opinion on Emerging Drugs 16 (1), 105–120. o. DOI:10.1517/14728214.2011.531699. PMID 21352072.
További olvasnivalók
- Guillain-Barré syndrome: from diagnosis to recovery (American Academy of Neurology). New York, N.Y.: Pub Group West (2006. július 27.). ISBN 978-1932603569
