Gram-pozitív baktériumok
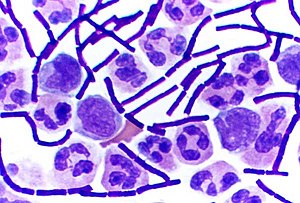

A Gram-pozitív baktériumok olyan baktériumok, melyek Gram-festés során pozitív eredményt mutatnak; ezt az eljárást hagyományosan a baktériumok két kategóriába való besorolására alkalmazzák. Az osztályozás és a festés során tapasztalt eltérő eredmények a sejtfalak különbözőségére vezethetőek vissza.
A Gram-pozitív baktériumok felveszik az eljárás során használt kristályibolya festékanyagot, majd lilára színeződve jelennek meg a mikroszkóp alatt. Ők ugyanis vastag peptidoglikán-réteget tartalmazó sejtfallal rendelkeznek, ami megköti a festéket, miközben az a minta többi részéről lemosódik a színtelenítési szakaszban.
A Gram-negatív baktériumok a színtelenítési lépés után már nem tartalmazzák a festéket. Az alkoholos öblítés során alkalmazott tömény alkohol roncsolja a Gram-negatív sejtek külső membránját, ezzel a sejtfalat porózusabbá téve, de végül a sejt nem tudja megkötni a kristályibolyát. Az ő peptidogikán-rétegük ugyanis sokkal vékonyabb, ami egy belső sejtmembrán és egy külső bakteriális membrán közé szorul, így az utófestés során használt festéket (szafranint vagy fukszint) már megkötik, és vörösre vagy rózsaszínre festődnek.
A vastagabb peptidoglikán-réteg ellenére a Gram-pozitív baktériumok a külső membrán hiányából kifolyólag fogékonyabbak a sejtfalat megcélzó antibiotikumokkal szemben, mint a Gram-negatívak.


Jellemzők[szerkesztés]
A Gram-pozitív baktériumokra általánosságban a következők jellemzőek:[1]
- Citoplazmatikus lipidmembrán
- Vastag peptidoglikán-réteg
- Teichoinsavak és lipoidok vannak jelen lipoteicholsavakat alkotva, amelyek kelátképző ágensenként szolgálnak, valamint különböző típusú adhéziót tesznek lehetővé.
- A peptidoglikánláncok egy DD-transzpeptidáz nevű bakteriális enzim révén keresztkötésekkel kapcsolódnak össze egy merev sejtfalat képezve.
- A periplazma sokkal kisebb mértékben van jelen, mint a Gram-negatív baktériumokban.
Néhány faj rendelkezik tokkal, melyek általában poliszacharidokból épülnek fel. Szintén csak pár fajon található ostor; ebben az esetben csupán két alapi testtel rögzülnek, míg a Gram-negatívok esetében ezekből négy figyelhető meg. A Gram-pozitív és a Gram-negatív baktériumok is rendszerint rendelkeznek egy felszíni réteggel, amit S-rétegnek nevezünk. A Gram-pozitív baktériumokban ez az S-réteg a peptidoglikán-réteghez kapcsolódik, a Gram-negatívoké viszont közvetlenül a külső membránhoz csatlakozik. A Gram-pozitív baktériumok sejtfalában jellemzően teichoinsav is található. Néhány ezek közül lipoteicholsav, ezeknek van egy lipid komponense a sejtmembránban, ami részt vesz a peptidoglikán rögzítésében is.
Osztályozás[szerkesztés]
A sejtalak meghatározásával egyetemben a Gram-festés is egy gyors módszer a baktériumfajok elkülönítésére. A festés, a növekedés mértéke és az antibiotikum-érzékenységi teszt más makroszkopikus és fiziológiai tesztekkel együtt képezi a baktériumok osztályozásának és felosztásának alapját.

Kezdetben a Monera országot négy törzsre osztották fel elsősorban a Gram-festésre alapozva: Firmicutes (pozitív eredmény), Gracilicutes (negatív), Mollicutes (semleges) és Mendocutes (variábilis festődés).A kései mikrobiológusnak, Carl Woese-nek és munkatársainak, valamint az Illinois Egyetemen dolgozó kollégáinak a 16S riboszómális RNS-sel kapcsolatos filogenetikai tanulmányai után a Gram-pozitív baktériumok monofiletikus elképzelése megingott.[2] A 16S RNS szekvenciájának molekuláris vizsgálataira alapozva Woese tizenkét baktériumtörzset állapított meg. Ezek közül kettő Gram-pozitívokat foglalt magában, amik a DNS-ükben található guanin- és citozinarány szerint lettek még további két csoportra osztva. A magas G+C tartalmú törzsek az Actinobacteria közé kerültek, az alacsonyak pedig a Firmicutes-hoz.[2] Az Actinobacteria-hoz a Corynebacterium, Mycobacterium, Nocardia és Streptomyces nemzetségek tartoznak. A Firmicutes ugyan 45-60% GC-t tartalmaz, de ez az Actinobacteria GC-bázisarányánál még mindig alacsonyabb.[1]
A külső sejtmembrán fontossága a bakteriális osztályozásban[szerkesztés]

Bár a baktériumokat hagyományosan két nagy csoportba, a Gram-pozitívak és Gram-negatívak közé sorolják, a rendszertani felosztás a festődésen kívül más szempontokat is figyelembe vesz, és emiatt sokszor nehézségekbe ütközik.[3][4][5][6] A Gram-festésre adott pozitív vagy negatív válasz sem egy megbízható rendszerezési jelleg, ugyanis ez a két baktériumtípus nem képez filogenetikailag egymással összefüggő csoportokat.[3] Azonban - ugyan a festődés egy tapasztalaton alapuló kritérium -, ennek alapjai a bakteriális sejtfal ultrastruktúrájának és kémiai összetételének feljebb említett különbségeiben keresendő, azaz főleg a külső lipidmembrán hiányában vagy jelenlétében.[3][7]
Minden Gram-pozitív baktérium egy egyrétegű lipidmembrán borítással rendelkezik, ezen felül pedig általában egy 20-80 nm vastag peptidoglikán-réteg található, amihez hozzákötődik a Gram-festék. Számos más baktérium azonban - melyek szintén egyrétegű membránnal határoltak -, negatív eredményt mutatnak a festési eljárás során, mert vagy peptidoglikán-réteg nélküliek, vagy a sejtfalösszetételük nem teszi lehetővé a festékanyag megkötését, mégis közeli rokonságot mutatnak a Gram-pozitív baktériumokkal. Ilyen például a Mycoplasma nemzetség.
Az egyrétegű membrán megléte miatt monoderm baktériumként is hivatkozhatunk rájuk.[3][7]
A Gram-pozitív baktériumokkal ellentétben minden archetípusos Gram-negatív baktérium két membránnal határolt, egy belső, citoplazma felőlivel és egy külsővel. A sejtfal csupán egy vékony (2-3 nm vastagságú) peptidoglikán-réteg, mely a két membrán között helyezkedik el. A köztes térrészt periplazmikus térnek nevezzük. (Így ezek az úgynevezett diderm baktériumok).[3][7] Az egy és két membránnal rendelkező baktériumok közötti különbségek számos fontos fehérje (mint a DnaK vagy GroEL) esetében bekövetkező, konzervált indelekben (azaz aminosavak beépülésében- és kiesésében) is nyomon követhető.[3][4][7][8] Valószínűleg a monoderm baktériumok az ősibbek. Több megfigyelés eredménye is arra enged következtetni, hogy a Gram-negatív baktériumok külső sejtmembránja az antibakteriális szelekciós nyomás egy védekező mechanizmusaként alakult ki.[3][4][7][8] A Gram-pozitív baktériumok ugyanis jelentős antibiotikumtermelők, és erre az anyagokra a Gram-negatívak rezisztensek. Néhány baktérium, mint a Deinococcus fajok, melyek a vastag peptidoglikán-rétegük következtében megfestődnek, de külső membránjuk is van, a monoderm és diderm baktériumok közötti átmenetnek tekinthetőek.[3][8] A két membránnal rendelkező baktériumok még további csoportokra oszthatók:
- egyszerű diderm baktériumok, melyek lipopoliszacharid nélküliek
- archetípusos diderm baktériumok, amik már tartalmaznak lipopoliszacharidot
- diderm baktériumok, melyeknél a külső membrán mycolic savból épül fel.[5][8][9]
Kivételek[szerkesztés]
Általánosságban a Gram-pozitív baktériumok egy kettős lipidrétegből felépülő membránnal rendelkeznek, míg a Gram-negatív baktériumoknak két kettős rétegű membránjuk van. Néhány taxonnál nem is figyelhető meg peptidoglikán (mint az Archea domén, a Mollicutes osztály esetében, a Rickettsiales néhány képviselőjénél és a rovar-endoszimbiontáknál az Enterobacteriales renden belül), ezek az ún. Gram-variábilis baktériumok, bár ezen belül is akadnak kivételek. A Deinococcus-Thermus baktériumok Gram-pozitív módra festődnek, viszont felépítésükben a Gram-negatívokhoz hasonlítanak, vagyis két membránnal rendelkeznek. A Cloroflexinél egy membrán van, ő viszont (néhány kivétellel[10]) mégis negatív eredményt mutat.[11] Rokonai, a TM7 klád és a Ktedonobacteria törzs szintén egymembránúak.[12][13]
Néhány Firmicutes faj viszont nem Gram-pozitív. Ezek egy része a Mollicutes osztályba tartozik (amit ma már a Tenericutes törzsbe sorolnak), és nem tartalmaznak peptidoglikánt (vagyis Gram-variáns), másik része pedig a Negativicutes osztályba, ami magában foglalja a Selenomonas nemzetséget, melybe Gram-negatív fajok sorolhatóak.[9] Emellett számos taxon (azaz a Negativicutes, Fusobacteria, Synergistetes és Elusimcrobia), amik vagy a Firmicutes törzs egy részét képezik, vagy azzal közelrokon ágon helyezkednek el, diderm sejtfelépítéssel rendelkeznek.[6][8][9] Azonban a HSP60 (GroEL) fehérje egy konzervált indel-ében a hagyományosan Gram-negatív baktériumok közé sorolt törzsek (pl. Proteobacteria, Chlamydiae, Cyanobacteria, Acidobacteria stb.) különböznek a többi atipikus, két membránnal rendelkező baktériumtól, ugyanúgy, mint a monoderm baktériumtörzsektől.[8] A meghatározott szekvenciájú, hagyományos LPS (lipopoliszacharid)-tartalmú Gram-negatív baktériumtörzsek ezen konzervált indel-ének a jelenléte bizonyítja, hogy ezek monofiletikus kládot alkotnak, és külső membránvesztés egyik faj esetében sem következett be.[8]
Patogenezis[szerkesztés]

Klasszikus értelemben hat Gram-pozitív nemzetség patogén az emberre nézve. Ezek közül kettő, a Streptococcus és Staphylococcus kokkusz (vagyis gömbalakú). A többi a bacillusok (pálcikaalakúak) közé tartozik, de a spóraképzésük alapján ezeket még további alcsoportokra lehet osztani. A Corynebacterium és a Listeria (kokkobacillus) képviselői spóranélküliek, míg a Bacillus és Clostridium fajok egyedfejlődésük során spórákat képeznek.[14] Ez utóbbiak is még elkülöníthetőek egymástól sejtlégzés szerint: A Bacillus fakultatív anaerob, a Clostridium viszont obligát anaerob.[15] Három nemzetség, a Rathybacter, Leifsonia és Clavibacter is még a patogének közé tartozik, ezek növényi megbetegedéseket okoznak. A Gram-pozitív baktériumok komoly, néha halálos kimenetelű fertőzéseket idézhetnek elő újszülöttekben.[16]
Bakteriális transzformáció[szerkesztés]
A transzformáció a három horizontális géntranszferfolyamat egyike, mely során külső genetikai anyag adódik át egyik (donor) baktériumsejtből a másik (recipiens) baktériumsejtbe. A másik a konjugáció (genetikai anyag közvetlen átvitele két bakteriális sejt között), a harmadik folyamat pedig a transzdukció (a baktérium DNS-ének injektálása egy másik baktériumsejtbe egy bakteriofág vírus által).[17] A transzformáció során a genetikai anyag egy közvetítő közegen halad át, így az örökítőanyag felvétele teljesen a recipiens baktériumtól függ.[17]
2014-ben körülbelül 80 baktériumfajról tudták, hogy transzformációra képesek, amelyek között nagyjából egyforma arányban voltak Gram-pozitív és Gram-negatív baktériumok, bár ez a szám túlbecsült lehet, ugyanis több faj esetében ezt a képességet csak tanulmányok igazolják.[17] A Gram-pozitív baktériumok közötti transzformációt a gyógyászatban fontos fajoknál vizsgálták, mint a Streptococcus pneumoniae, Streptococcus mutans, Streptococcus aureus és Streptococcus sanguinis esetében, illetve egy Gram-pozitív talajlakó baktériumnál, a Bacillus subtilis-nél.[18]
Ortográfiai megjegyzés[szerkesztés]
A Gram-pozitív és Gram-negatív jelzők Hans Christian Gram vezetéknevéből származnak mint eponimikus melléknevek. A kezdőbetű lehet nagybetű (G) és kisbetű (g) is attól függően, milyen stílus útmutató (style guide) szabályozza a publikáció írását (pl. CDC esetében a kisbetűs forma használatos).[19] Könyvekben, más ismeretterjesztő szövegekben általában nagybetűvel írjuk.
Jegyzetek[szerkesztés]
- ↑ a b Madigan, Michael T.; Martinko, John M. (2006). Brock Biology of Microorganisms (11th ed.). Pearson Prentice Hall. ISBN 978-0131443297.
- ↑ a b Woese, C. R. (1987). "Bacterial evolution". Microbiological Reviews. 51 (2): 221–271. PMC 373105. PMID 2439888.
- ↑ a b c d e f g h Gupta, R. S. (2000. május 15.). „The natural evolutionary relationships among prokaryotes”. Critical Reviews in Microbiology 26 (2), 111–131. o. DOI:10.1080/10408410091154219. PMID 10890353.
- ↑ a b c Gupta, R. S. (2000). "The natural evolutionary relationships among prokaryotes"(PDF). Critical Reviews in Microbiology. 26 (2): 111–131. CiteSeerX 10.1.1.496.1356. doi:10.1080/10408410091154219. PMID 10890353.
- ↑ a b Desvaux, M.; Hébraud, M.; Talon, R.; Henderson, I. R. (2009). "Secretion and subcellular localizations of bacterial proteins: A semantic awareness issue". Trends in Microbiology. 17 (4): 139–145. doi:10.1016/j.tim.2009.01.004. PMID 19299134.
- ↑ a b Sutcliffe, I. C. (2010). "A phylum level perspective on bacterial cell envelope architecture". Trends in Microbiology. 18 (10): 464–470. doi:10.1016/j.tim.2010.06.005. PMID 20637628.
- ↑ a b c d e Gupta, R. S. (1998). "What are archaebacteria: life's third domain or monoderm prokaryotes related to Gram-positive bacteria? A new proposal for the classification of prokaryotic organisms". Molecular Microbiology. 29 (3): 695–707. doi:10.1046/j.1365-2958.1998.00978.x. PMID 9723910.
- ↑ a b c d e f g Gupta, R. S. (2011). "Origin of diderm (gram-negative) bacteria: antibiotic selection pressure rather than endosymbiosis likely led to the evolution of bacterial cells with two membranes". Antonie van Leeuwenhoek. 100 (2): 171–182. doi:10.1007/s10482-011-9616-8. PMC 3133647. PMID 21717204.
- ↑ a b c Marchandin, H.; Teyssier, C.; Campos, J.; Jean-Pierre, H.; Roger, F.; Gay, B.; Carlier, J.-P.; Jumas-Bilak, E. (2009). "Negativicoccus succinicivorans gen. Nov., sp. Nov., isolated from human clinical samples, emended description of the family Veillonellaceae and description of Negativicutes classis nov., Selenomonadales ord. Nov. And Acidaminococcaceae fam. Nov. In the bacterial phylum Firmicutes". International Journal of Systematic and Evolutionary Microbiology. 60 (6): 1271–1279. doi:10.1099/ijs.0.013102-0. PMID 19667386.
- ↑ Yabe, S.; Aiba, Y.; Sakai, Y.; Hazaka, M.; Yokota, A. (2010). "Thermogemmatispora onikobensis gen. nov., sp. nov. And Thermogemmatispora foliorum sp. nov., isolated from fallen leaves on geothermal soils, and description of Thermogemmatisporaceae fam. Nov. And Thermogemmatisporales ord. Nov. Within the class Ktedonobacteria". International Journal of Systematic and Evolutionary Microbiology. 61 (4): 903–910. doi:10.1099/ijs.0.024877-0. PMID 20495028.
- ↑ Sutcliffe, I. C. (2011). "Cell envelope architecture in the Chloroflexi: A shifting frontline in a phylogenetic turf war". Environmental Microbiology. 13 (2): 279–282. doi:10.1111/j.1462-2920.2010.02339.x. PMID 20860732.
- ↑ Hugenholtz, P.; Tyson, G. W.; Webb, R. I.; Wagner, A. M.; Blackall, L. L. (2001). "Investigation of Candidate Division TM7, a Recently Recognized Major Lineage of the Domain Bacteria with No Known Pure-Culture Representatives". Applied and Environmental Microbiology. 67 (1): 411–419. doi:10.1128/AEM.67.1.411-419.2001. PMC 92593. PMID 16751552.
- ↑ Cavaletti, L.; Monciardini, P.; Bamonte, R.; Schumann, P.; Rohde, M.; Sosio, M.; Donadio, S. (2006). "New Lineage of Filamentous, Spore-Forming, Gram-Positive Bacteria from Soil". Applied and Environmental Microbiology. 72 (6): 4360–4369. doi:10.1128/AEM.00132-06. PMC 1489649. PMID 16751552.
- ↑ Gladwin, Mark; Trattler, Bill (2007). Clinical Microbiology Made Ridiculously Simple. Miami, Florida: MedMaster. pp. 4–5. ISBN 978-0-940780-81-1.
- ↑ Sahebnasagh, R.; Saderi, H.; Owlia, P. (4–7 September 2011). Detection of methicillin-resistant Staphylococcus aureus strains from clinical samples in Tehran by detection of the mecA and nuc genes. The First Iranian International Congress of Medical Bacteriology. Tabriz, Iran.
- ↑ MacDonald, Mhairi (2015). Avery's Neonatology: Pathophysiology and Management of the Newborn. Philadelphia: Wolters Kluwer. ISBN 9781451192681. Access provided by the University of Pittsburgh.
- ↑ a b c Johnston, C.; Martin, B.; Fichant, G.; Polard, P; Claverys, J. P. (2014). "Bacterial transformation: distribution, shared mechanisms and divergent control". Nature Reviews. Microbiology. 12 (3): 181–96. doi:10.1038/nrmicro3199. PMID 24509783.
- ↑ Michod, R. E.; Bernstein, H.; Nedelcu, A. M. (2008). "Adaptive value of sex in microbial pathogens". Infection, Genetics and Evolution. 8 (3): 267–85. doi:10.1016/j.meegid.2008.01.002. PMID 18295550.
- ↑ "Emerging Infectious Diseases Journal Style Guide". CDC.gov. Centers for Disease Control and Prevention.
További információk[szerkesztés]
- 3D structures of proteins associated with plasma membrane of Gram-positive bacteria
- 3D structures of proteins associated with outer membrane of Gram-positive bacteria
Fordítás[szerkesztés]
- Ez a szócikk részben vagy egészben a Gram-positive bacteria című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
