Sav-bázis indikátor
A sav-bázis indikátor (lat. indicare, jelez szóból) olyan anyag, amely színváltozással jelzi egy oldat kémhatásának megváltozását. A legismertebb sav-bázis indikátorok: lakmusz, fenolftalein.
A sav-bázis indikátorok így jelzik az oldat pH-ját vagy annak változását. A sav-bázis indikátorok olyan gyenge savak vagy gyenge bázisok, amelynek disszociációja során színváltozás következik be. Ez annak a következménye, hogy a kation és az anion más színű, mint a disszociálatlan molekula. Ezen folyamatok során a molekulán belül kötésátrendeződés is megtörténhet, ebből adódik a színváltozás. Az egyes indikátorok színváltozása meghatározott pH intervallumban következik be (átcsapási tartomány).
Elmélet
Az indikátor vegyületek által végzett pH-mérést kolorimetriás mérésnek nevezzük. Ehhez indikátoranyagokat alkalmazunk, amelyek meghatározott pH-értékek esetén megváltoztatják színüket - ezt a színváltozást nevezzük átcsapásnak.[1] A mérést papírral és oldattal végezhetjük. Előbbi esetben olyan szívóképes szűrőpapírokat alkalmazunk, amelyeket indikátoranyagokkal impregnáltak. Ezek pontos pH mérésre nem alkalmasak, ám mivel gyors és egyszerű megoldást jelentenek, igen népszerűek. A segítségükkel elsősorban azt határozhatjuk meg, hogy savas vagy lúgos-e a pH.
A kolorimetriás mérések leggyakoribb hibalehetőségei:[2][3]
- Hőmérséklet hiba: A pH-indikátor papírok skálája általában 20 Celsius-fokra kalibráltak. Az ettől eltérő hőmérsékleten történő mérések nem vehetőek pontosnak, általában további méréseket kell végezni az érték pontos meghatározásához.
- Sajátszín hiba: A kolorimetriás pH-mérésnél az indikátor színátcsapása szolgál a mérési eredmény alapjául. Amennyiben a vizsgálandó oldat maga is színes, úgy a sajátszín zavarhatja a pontos leolvasást.
- Sav-bázis hiba: A sav-bázis indikátorok kémiai összetételüket illetően maguk is savakat, illetve bázisokat tartalmazó anyagok. Az indikátorok ionszegény mérendő közegbe (pl. desztillált víz, igen gyengén hidrolizált sav- ill. lúgoldatok) juttatása ill. mártása következtében kis mértékben beoldódnak, és így megváltoztatják a mérendő közeg pH-ját, amit azután a maradék indikátor rész visszamér. Ez az a hiba, amit a szakirodalom ún. „sav-bázis”hibának említ, és akár 1 pH egység hibához is vezethet kedvezőtlen esetben, amikor a híg, ionszegény, ill. nem pufferolt oldatok mérése történik. A pufferek kétkomponensű stabil kémhatású oldatok. Kémhatásuk akkor sem változik (bizonyos kapacitáshatárig) ha eltérő kémhatású oldatot adagolunk hozzá, így megakadályozzák, hogy a mérési eljárás során a pH-érték megváltozzon.[4] Ugyanez a hiba indikátor oldat alkalmazása esetén tizedrészre csökkenthető. Más esetekben úgynevezett „nem vérző” indikátorcsíkokat ajánlatos használni az ilyen hibakiküszöbölése céljából.
- Sóhiba: A hidrogénionokon kívül – ha jóval kisebb mértékben is, de – hatással vannak az indikátorok színváltozására a különféle kationok is. Éppen ezért tömény sóoldatokban előfordulhat kismértékű színeltolódás. Ezt a jelenséget nevezzük sóhibának. Amennyiben a sókoncentráció 0,2 mol/l alatt van, akkor egyáltalán nem jelentkezik ez a probléma.
- Alkoholhiba: Indikátorral „színezett” alkoholos oldatoknál előfordul, hogy ugyanolyan színt mutató indikátoros vizes pufferoldattal összehasonlítva nem egyforma kémhatású oldatok vannak a háttérben. Az oldószerváltozás bizonyos mértékben eltolhatja a sav-bázis egyensúlyt, aminek következtében az indikátor konstansok is megváltoznak.
- Alkaloidhiba: Alkaloidokat tartalmazó oldatokban, ha indikátort cseppentünk bele, alkaloidszármazékok keletkezése figyelhető meg, amely megnehezíti, illetve pontatlanná teszi a mérést. Alkaloidok jelenléte esetében ajánlatos a vakérték meghatározása az alkaloidhiba mértékének tisztázása céljából.
Az indikátorok működése
A sav-bázis indikátorok gyenge savak vagy gyenge bázisok, melyek általános reakcióvázlata így írható fel:
A HInd itt a savat, az Ind- pedig az indikátor konjugált bázisát jelöli. Ezek aránya adja meg a színt és kapcsolja azt a pH-értékhez.
Alkalmazásuk
A sav-bázis indikátorokat gyakran használják titrálási folyamatoknál az analitikai kémia és biológia területén, hogy meghatározzák egyes kémiai folyamatok kimenetelét. Problémát jelenthet és jelentős szubjektív hibákhoz vezethet a „detektorok” (ez esetben az emberi szem) sokfélesége, amellyel a színt meghatározzák. Az indikátorok alkalmazása azért okoz gyakran elvi hibát, mert a színátcsapás pH-ja ritkán egyezik meg az ekvivalenciapont pH-jával.[5] Az olyan esetekben, amikor a pH pontos meghatározására van szükség, gyakran pH-metriás módszert alkalmaznak. Egyes esetekben, amikor csak a pH körülbelüli meghatározása szükséges, több indikátort használnak, hogy egyenletes színváltozást érjenek el egy nagyobb pH-érték tartományban.
Az alábbi táblázatban laboratóriumokban gyakran használt indikátorok láthatóak. Az indikátorok az átcsapási tartományban rendszerint köztes színeket vesznek fel, így például a fenol vörös színt mutat 6,8 és 8,4 pH-érték között. Az indikátor koncentrációja és a hőmérséklet függvényében az átcsapási tartomány némileg eltolódhat.
| Indikátor | Szín alacsony pH-értéknél | Átcsapási tartomány alsó határa | Átcsapási tartomány felső határa | Szín magas pH-értéknél |
|---|---|---|---|---|
| Kristályibolya | sárga | 0,0 | 2,0 | kék-ibolya |
| Malachitzöld (első átcsapás) | sárga | 0,0 | 2,0 | zöld |
| Malachitzöld (második átcsapás) | zöld | 11,6 | 14,0 | színtelen |
| Timolkék (első átcsapás) | vörös | 1,2 | 2,8 | sárga |
| Timolkék (második átcsapás) | sárga | 8,0 | 9,6 | kék |
| Metilsárga | vörös | 2,9 | 4,0 | sárga |
| Brómfenolkék | sárga | 3,0 | 4,6 | kék |
| Kongóvörös | kék-ibolya | 3,0 | 5,0 | vörös |
| Metilnarancs | vörös | 3,1 | 4,4 | sárga |
| Brómkrezolzöld | sárga | 3,8 | 5,4 | kék |
| Metilvörös | vörös | 4,4 | 6,2 | sárga |
| Metil-lila | lila | 4,8 | 5,4 | zöld |
| Lakmusz | vörös | 4,5 | 8,3 | kék |
| Brómkrezol lila | sárga | 5,2 | 6,8 | lila |
| Brómkrezol kék | sárga | 6,0 | 7,6 | kék |
| Fenolvörös | sárga | 6,4 | 8,0 | vörös |
| Természetes vörös | vörös | 6,8 | 8,0 | sárga |
| Naftolftalein | színtelen-vöröses | 7,3 | 8,7 | zöldeskék |
| Krezolvörös | sárga | 7,2 | 8,8 | vöröses-lila |
| Krezolftalein | színtelen | 8,2 | 9,8 | lila |
| Fenolftalein | színtelen | 8,3 | 10,0 | püspöklila |
| Timolftalein | színtelen | 9,3 | 10,5 | kék |
| Alizarin-sárga | sárga | 10,2 | 12,0 | vörös |
| Indigókármin | kék | 11,4 | 13,0 | sárga |
Mesterséges indikátorok
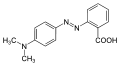
Azovegyületek
Azobenzol-származékok

| Név | R1 | R2 | R3 |
|---|---|---|---|
| metilnarancs(en) | (CH3)2N | H | NaO—SO2 |
| metilvörös(en) | COOH | H | |
| metilsárga(en) | H | H | |
| tropeolin OO(en) | C6H5NH | H | NaO—SO2 |
-
metilnarancs
-
metilvörös
-
metilsárga
-
tropeolin OO
Trifenilmetán vegyületek
(ftalein-származékok)
2 típusuk létezik:
1; Ftaleinek R = COOH
2; Szulfoftaleinek R = SO3H
Főbb képviselőik
Ftaleinek
- fenolftalein
- krezolftalein
- timolftalein
Szulfoftaleinek
- fenolvörös
- timolkék
- brómfenolkék
Természetes indikátorok
A természetben található sok festékanyag között vannak olyanok, amelyek színe állandó, viszont vannak olyanok, amelyeké nem, mert bizonyos körülmények hatására (akár már napsütésre is) megváltozik a színük. Ezen kívül savas és lúgos hatásra is történhet változás. Ezen színváltozás a sejtnedv pH-értékének megváltozása miatt alakul ki. A legtöbb természetes indikátor ezen az elven működik.
Legfontosabb természetes indikátorok

Források
- ↑ A pH „érzékelése” indikátorokkal. www.inc.bme.hu (Hozzáférés: 2015. március 9.) (PDF) arch
- ↑ A pH mérést befolyásoló tényezők. phmerok.hu (2014. szeptember 15.) (Hozzáférés: 2015. március 9.)
- ↑ Nagy László: PH mérés indikátorokkal. www.muszeroldal.hu (Hozzáférés: 2015. március 9.) (PDF)
- ↑ Mire jók a pufferoldatok? phmerok.hu (2014. szeptember 8.) (Hozzáférés: 2015. március 9.)
- ↑ Zékány László: PH-potenciometria. www.inorg.unideb.hu (Hozzáférés: 2015. március 9.) (PDF) arch
További információk