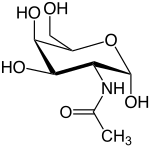
N-Acetilgalaktózamin
| N-Acetilgalaktózamin | |||
| |||
| IUPAC-név | 2-(Acetilamino)-2-dezoxi-d-galaktóz | ||
| Más nevek |
| ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 1811-31-0 | ||
| PubChem | 84265 | ||
| ChemSpider | 76020 | ||
| DrugBank | DB03567 | ||
| KEGG | C01074 | ||
| ChEBI | 40356 | ||
| |||
| |||
| InChIKey | OVRNDRQMDRJTHS-CBQIKETKSA-N | ||
| UNII | 833755V695 | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C8H15NO6 | ||
| Moláris tömeg | 221.21 g/mol | ||
| Olvadáspont | 172 to 173 °C | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
Az N-acetilgalaktózamin (GalNAc) a galaktózból származtatható aminocukor.
Funkció[szerkesztés]
Emberben az N-acetilgalaktózamin az A vércsoport antigénjének utolsó szénhidrátja.[1]
Jellemzően ez a szerinhez vagy treoninhoz csatlakozó első monoszacharid a fehérje-O-glikoziláció bizonyos formáiban.
Az N-acetilgalaktózamin a sejtkommunikációban fontos, és az érzőideg-szerkezetekben koncentráltan van jelen emberben és állatban is. A GalNAc-transzferázok szerin- és treoninpreferenciái izoenzimfüggőek, és modulálják a mucinglikozilációt. Emberben 20, Drosophilában 14, Caenorhabditis elegansban 9 ilyen izoenzim található, a még kisebb eukariótákban pedig még ennél is kevesebb.[2]
A GalNAc célzóligandumként használható vizsgált antiszenz oligonukleotidokban és a májat célzó siRNS-terápiákban, ahol az aszialoglikoprotein-receptorokhoz köt a májsejtekben.[3]
Az immunglobulin A1 zsanérrészének csoportos glikánhűsége a GalNAc-T2 általi féligrendezett glikozilációja során jelenik meg.[4]
Jegyzetek[szerkesztés]
- ↑ Donald M. Marcus (1964). „Immunochemical Studies on Blood Groups”. Biochemistry 3 (3), 437–443. o. DOI:10.1021/bi00891a023.
- ↑ Daniel EJP, las Rivas M, Lira-Navarrete E, García-García A, Hurtado-Guerrero R, Clausen H, Gerken TA (2020. április 18.). „Ser and Thr acceptor preferences of the GalNAc-Ts vary among isoenzymes to modulate mucin-type O-glycosylation”. Glycobiology 30 (11), 910–922. o. DOI:10.1093/glycob/cwaa036. PMID 32304323. (Hozzáférés: 2024. február 29.)
- ↑ Nair, Jayaprakash K (2014). „Multivalent N-Acetylgalactosamine-Conjugated siRNA Localizes in Hepatocytes and Elicits Robust RNAi-Mediated Gene Silencing”. Journal of the American Chemical Society 136 (49), 16958–16961. o. DOI:10.1021/ja505986a. PMID 25434769.
- ↑ Stewart TJ, Takahashi K, Whitaker RH, Raska M, Placzek WJ, Novak J, Renfrow MB (2019. május 13.). „IgA1 hinge-region clustered glycan fidelity is established early during semi-ordered glycosylation by GalNAc-T2”. Glycobiology 29 (7), 543–556. o. DOI:10.1093/glycob/cwz007. PMID 30759204.
Fordítás[szerkesztés]
Ez a szócikk részben vagy egészben a N-Acetylgalactosamine című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
További információk[szerkesztés]
| Az itt található információk kizárólag tájékoztató jellegűek, nem minősülnek orvosi szakvéleménynek, nem pótolják az orvosi kivizsgálást és kezelést. A cikk tartalmát a Wikipédia önkéntes szerkesztői alakítják ki, és bármikor módosulhat. |

